用溴盐氧化法从矿石中浸出金试验研究
2020-08-21杨炯
杨 炯
(陕西地矿汉中地质大队检测中心,陕西 汉中 723000)
氰化法浸出金工艺较为成熟,对矿石适应性强,金回收率高,至今仍是黄金浸出的主要方法。但氰化物有剧毒,对于高砷、高锑等难选冶金矿资源也存在适用性问题;而非氰化技术安全环保,在难选冶金矿资源开发、提高资源利用率方面具有独特优势。所以,非氰化浸金技术研究一直在进行[1-2]。目前,关于生物制剂法、硫代硫酸盐法、高温氯化法、次氯酸钠法、多硫化法、碘法等的研究都有很大进展,但都不够成熟,对不同矿石的适应性较差,生产过程中也存在一些问题,所以尚未得到推广应用[3-16]。
多年来,国外在溴法浸金方面的研究已有一些成果和工业应用实例,但工艺细节未见报道;国内目前亦罕见自主研究成果。试验研究了以无毒无害的溴盐(NaBr)、氧化剂(YA)、配合剂(NaCl)溶液体系(Bromine salt,oxidant and complexing agent system,以下简称“BOC体系”)从矿石中溶解金。
1 试验部分
试验所用矿石:取自陕西汉中勉县某金矿。1#样品为原矿石,2#样品为选厂浮选金精矿。
1#样品属于贫硫化物含金石英脉型氧化矿石,金属矿物主要有褐铁矿、赤铁矿,其次为磁铁矿、方铅矿等;脉石矿物主要为石英,其次为斜长石、黑云母等。矿石中的金主要是自然金,粒度较细小,0.053~0.010 mm的颗粒占63.5%,粒级<0.010 mm的极细粒金占36.5%。自然金主要赋存在金属矿物之间或裂隙中或与金属矿物连生,被褐铁矿包裹的金约占15%。
2#样品为该原矿石经浮选所得金精矿,粒度为-200目≥95%。
矿石多元素分析结果见表1。

表1 矿石多元素分析结果 %
试验所用试剂:氧化剂YA,化学纯;NaBr,NaCl,分析纯。
试验设备:原子吸收分光光度计,普析TAS990型,北京普析通用仪器有限公司;XL箱式炉,SG-XL1400型,上海光学精密机械研究所;震荡机,HY-8A型大容量调速振荡器,常州朗越仪器制造有限公司。
2 试验原理与方法
2.1 试验原理
金在溶液中的溶解过程是一个氧化-还原过程,Au失去电子形成Au+或Au3+进入溶液:

(1)

(2)
由于Au电极电位较高,电负性高达2.54,在化合物中吸引电子的能力很强(一般情况下,金属元素的电负性<1.80),所以Au不易失去电子,不易被氧化,化学稳定性很高。上述过程可逆,在一定条件下会达到动态平衡。
溴盐在水溶液中形成Br-,其中一部分被氧化剂YA氧化生成Br2:

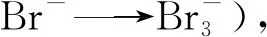
配合物的形式降低了溶解过程中Au3+的浓度,也使金溶解过程平衡右移。
根据能斯特方程,
式中:[氧化型]a/[还原型]b—参与电极反应所有氧化侧物质浓度幂的乘积与参与电极反应所有还原侧物质浓度幂的乘积之比,a,b等于各物质在电极反应中的系数;E—氧化型和还原型物质在热力学温度T及某一浓度时的电极电势,V;EΘ—标准电极电势,V;R—气体常数,8.314 3 J/(K·mol);T—热力学温度K;F—法拉第常数,965 00 C/mol;n—电极反应中得失电子数。
配合剂的加入有金配合物形成,金离子[氧化型]浓度降低,其实质是降低了金电极电位,增强了金还原能力,从而使金更“易溶”。
溶液中未被氧化的Br-也起配合剂作用,其配合机制与Cl-相同[1]。
金在溴-溴化物溶液中的电化学过程为:
阴极反应,

阳极反应,
总反应,
溴盐法提金就是用YA将NaBr中的Br-氧化成Br2,再利用Br2的氧化性和NaCl提供的Cl-与金形成配合物,两者共同作用促进金的溶解;同时BOC体系不与脉石和其他矿物发生反应,从而实现金的选择性浸出。
2.2 试验方法
BOC体系溶液的配制:氧化剂、溴盐及配合剂加水配制成溶液,即BOC体系溶液。
在2 000 mL烧杯中,加入1 000 mL蒸馏水,根据单次试验设计的试剂用量,依次加入溴盐NaBr、配合剂NaCl,待完全溶解后,加入氧化剂YA,搅拌均匀,静置1 h,备用(储放时间≤72 h)。
从矿石中浸出金:称取矿石及精矿粉各100 g(精确至0.1 g,精矿粉在650 ℃下焙烧2 h),分别放入500 mL带盖广口塑料瓶中,并分别加入上述试剂300 mL,摇匀,拧紧瓶盖,在振荡速度120 r/min 条件下振荡1 h,之后静置1 h,反复至试验结束。之后进行固液分离,浸出渣洗涤后于105 ℃下烘干,用原子吸收分光光度法(AAS)测定其中金质量分数,计算金浸出率。
3 试验结果与讨论
3.1 氧化剂用量对金浸出率的影响
试验条件:溴盐NaBr浓度0.146 mol/L,配合剂NaCl浓度0.513 mol/L,浸出时间24 h,浸出温度18 ℃。氧化剂YA用量对金浸出率的影响试验结果如图1所示。
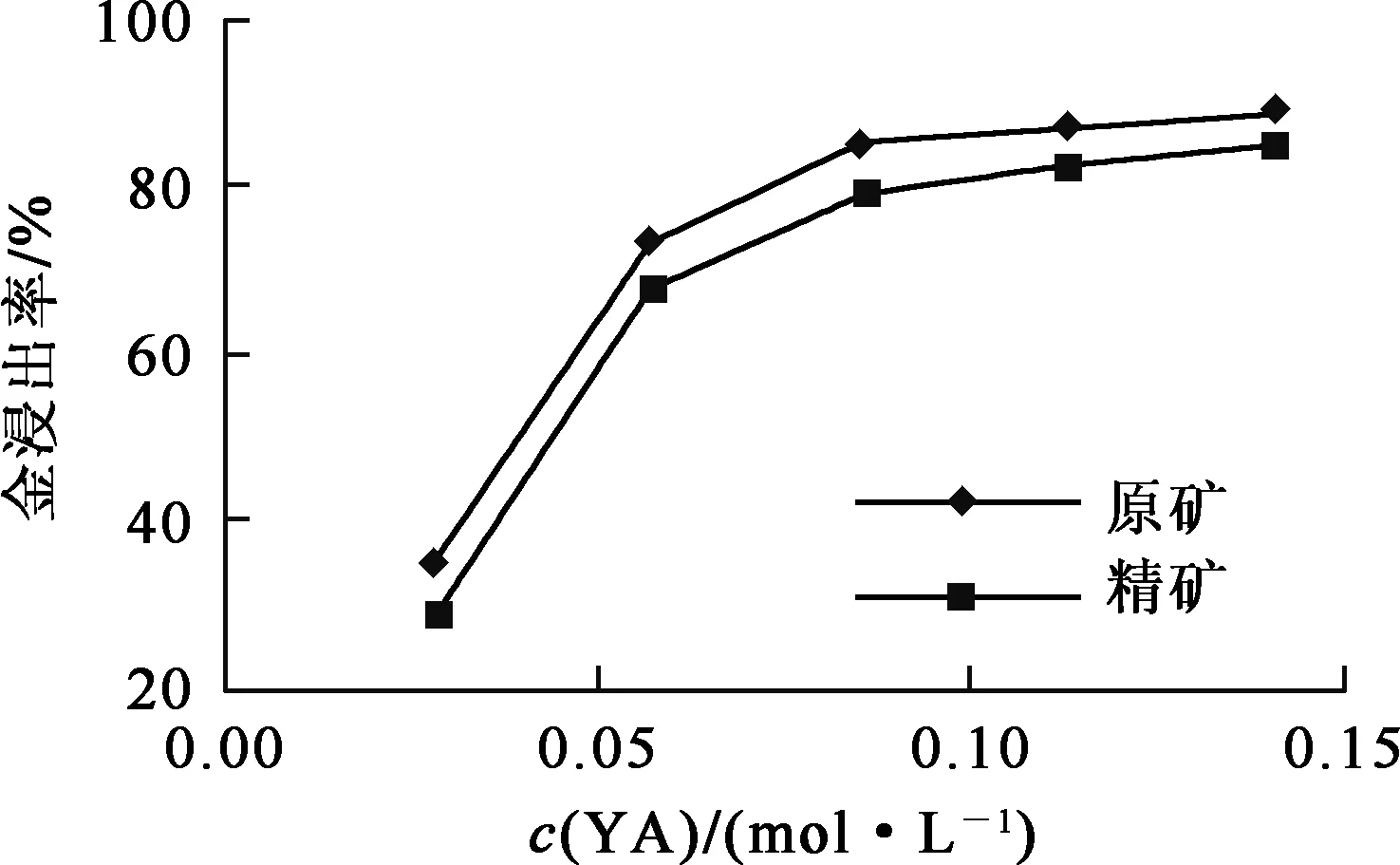
图1 氧化剂YA用量对金浸出率的影响
由图1看出:矿石及精矿的金浸出率均随YA用量增大而提高;YA浓度≤0.071 mol/L时,随YA浓度提高,金浸出率提高幅度较大;YA浓度≥0.071 mol/L后,金浸出率提高幅度较小。随YA用量增大,溶液中被氧化的Br-增多,Br2浓度增大,促使反应向金溶解方向进行;YA浓度≥0.141 mol/L后,溶液中有刺激性气体(Br2)逸出。综合考虑,氧化剂YA浓度选用0.071 mol/L。
3.2 溴盐用量对金浸出率的影响
试验条件:氧化剂YA浓度0.071 mol/L,配合剂NaCl浓度0.513 mol/L,浸出时间24 h,浸出温度18 ℃。溴盐NaBr用量对金浸出率的影响试验结果如图2所示。

图2 溴盐NaBr用量对金浸出率的影响
由图2看出:原矿及精矿的金浸出率均随NaBr用量增大而逐步提高;NaBr浓度≤0.146 mol/L时,金浸出率随NaBr浓度增大而大幅提高;NaBr浓度≥0.146 mol/L后,金浸出率趋于稳定,变化幅度不大。由金在溴-溴化物溶液中的电化学可知,金的浸出主要是Br2对金的氧化作用。溴盐NaBr虽然是Br2的提供者,但在溴盐提供足够Br-情况下,Br2浓度与氧化剂YA用量呈正相关,所以NaBr浓度≥0.146 mol/L后,金浸出率波动不大。综合考虑,NaBr浓度选用0.146 mol/L。
3.3 配合剂用量对金浸出率的影响
试验条件:溴盐NaBr浓度0.146 mol/L,氧化剂YA浓度0.071 mol/L,浸出时间24 h,浸出温度18 ℃。配合剂NaCl浓度对金浸出率的影响试验结果如图3所示。可以看出:原矿石及精矿的金浸出率均随NaCl用量增加而提高;金浸出率在60%~90%范围内,NaCl浓度选择范围较大。

图3 配合剂NaCl浓度对金浸出率的影响
金的化学浸出主要是Br2的氧化和配合剂的配合共同作用的结果。溴盐提供足够Br-情况下,未被氧化成Br2的大量Br-本身就是溶解金的配合剂。试验中,以NaCl作配合剂是因为NaCl比溴盐更廉价,也可强化对Br-的配合作用。综合考虑,配合剂NaCl浓度选用0.342 mol/L。
3.4 浸出时间对金浸出率的影响
试验条件:溴盐NaBr浓度0.146 mol/L,氧化剂YA浓度0.071 mol/L,配合剂NaCl浓度0.342 mol/L,浸出温度18 ℃。浸出时间对金浸出率的影响试验结果如图4所示。
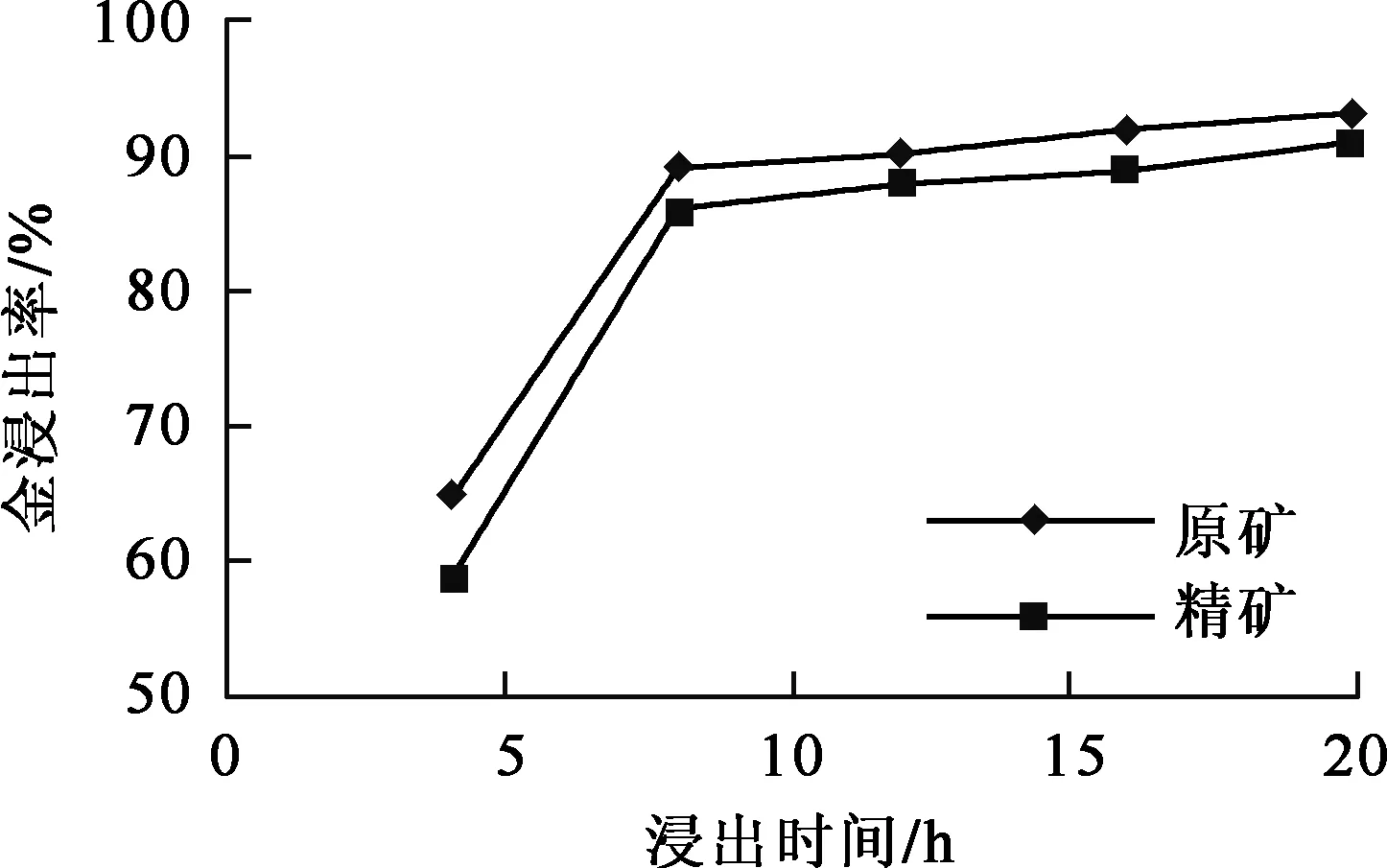
图4 浸出时间对金浸出率的影响
由图4看出:原矿及精矿的金浸出率均随浸出时间延长而提高;浸出8 h后,金浸出率趋于稳定,接近90%。
3.5 综合条件下金的浸出
体系酸度对金浸出率有明显影响[1-2]。溶液pH较高时,发生下列反应而消耗溴:

室温下,金最佳溶解体系pH为4~6,电位0.7~0.9 V(相对甘汞电极)。Br2可在较低温度下氧化浸出金[2],浸出在室温(17~25 ℃)条件下即可完成。
根据上述试验确定的适宜条件对矿石进行浸出,结果见表2。
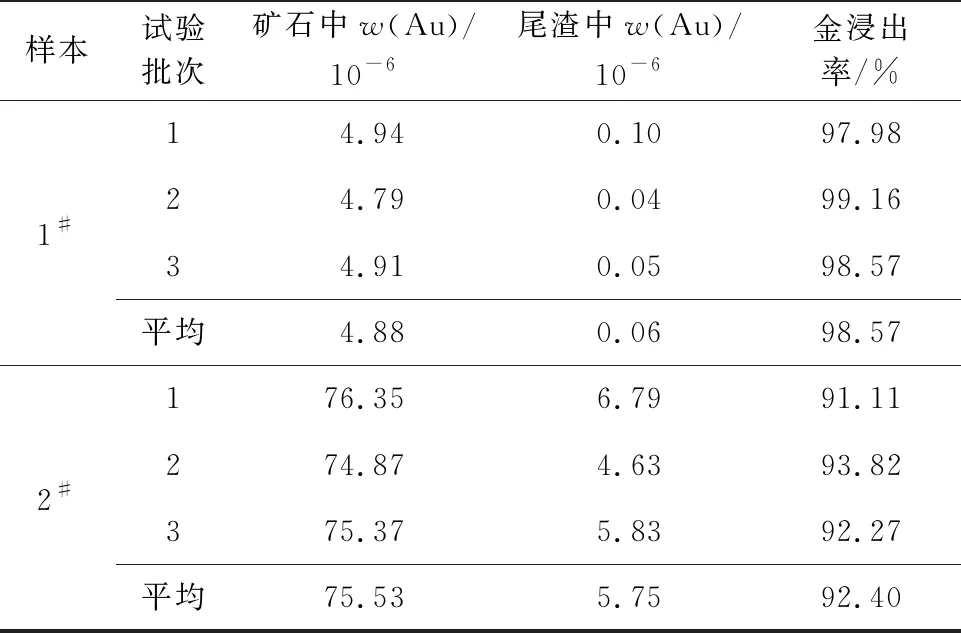
表2 综合浸出试验结果
4 结论
采用氧化剂、溴盐及氯化钠体系可以从含金矿石中浸出金,适宜条件下,金浸出率超过90%。方法要求矿石中的金为微粒或亚微粒级,对于粒级分布宽、颗粒较大、含包裹金的矿石,应采取重选、焙烧、预氧化等措施进行预处理。
该工艺采用非氰无毒试剂,环境友好;常温、常压下操作,安全可靠;适应高海拔地区缺氧环境;浸出速度较快,生产周期短;尾渣无须特殊处理。虽然试剂成本稍高,但溴化钠可循环利用,加之尾渣无须特殊处理,综合成本与氰化法相当。此技术对于黄金生产具有可替代氰化法的巨大潜力,值得进一步研究。
