脐带间充质干细胞移植对急性颅脑创伤大鼠超氧化物歧化酶及白细胞介素-12的影响
2020-08-21彭定伟张博张秀娟回月彤王磊商崇智王强董化江徐健张赛
彭定伟,张博,张秀娟,回月彤,王磊,商崇智,王强,董化江,徐健,张赛
(1.天津医科大学研究生院,天津 300070; 2.武警特色医学中心神经外科,天津 300162; 3.天津市神经修复重点实验室,天津 300162;4.天津市河东区东新街社区卫生服务中心,天津 300162; 5.武警后勤学院,天津 300189; 6.中国医学科学院北京协和医学院生物医学工程研究所,天津 300192)
颅脑创伤(traumatic brain injury,TBI)是世界范围内的严重公共卫生问题。儿童及青壮年的TBI致残率、死亡率均较高,且TBI患者的治疗费用高昂,给患者家庭和社会带来巨大的经济负担[1]。尽管医疗技术水平不断提高,但由于神经细胞无法再生,导致颅脑损伤的治疗仍以对症治疗和康复治疗为主,治疗效果欠佳。随着干细胞技术的成熟与完善,通过干细胞治疗TBI,使损伤神经细胞再生以及神经功能恢复与重建成为可能[2]。干细胞技术是继药物、手术之后的第三次医学革命,人脐带华通胶中的人脐带间充质干细胞(umbilical cord-matrix stem cells,UC-MSCs)的含量较多,且华通胶来源的间充质干细胞(mesenchymal stem cells,MSCs)更原始,具有细胞干性强、体外扩增能力强、可在较短时间内获得满足临床需求的细胞数量、临床操作简便、可操作性强的特点[3-4]。此外,人脐带华通胶源性MSCs缺乏主要组织相容性复合体Ⅱ类抗原,免疫原性低,故在临床治疗过程中,无需配型即可进行同种异体的细胞移植[5-6]。本研究通过观察UC-MSCs移植(尾静脉注射方式)后TBI大鼠脑损伤组织超氧化物歧化酶(superoxide dismutase,SOD)及白细胞介素(interleukin,IL)-12表达水平的变化,探讨UC-MSCs移植对TBI后机体氧化应激及炎症反应的影响,以期为TBI的救治提供新的靶点和思路,现报道如下。
1 材料与方法
1.1UC-MSCs获取及体内移植 选取平津医院(武警医学院附属医院)的脐带作为本研究UC-MSCs的来源。去除脐带上皮组织以及两根脐带动脉和一根脐带静脉后的剩余组织即为华通胶。UC-MSCs中CD73、CD90、CD105阳性细胞数>95%,CD34阳性细胞数<3%;UC-MSCs细胞活力≥95%,病原菌排查未检出细菌,培养至第三代至第四代。UC-MSCs体内移植途径为尾静脉注射,移植细胞数量为1.0×106。本研究脐带采集经武警医学院附属医院伦理委员会审核批准,孕产妇及家属均知情同意并签署知情同意书。
1.2实验动物 45只无特定病原级雄性Sprague-Dawley(SD)大鼠[维通利华实验动物技术有限公司(北京),许可证号:SCXK(京)2012-0001],所有实验SD大鼠分笼喂养,进食和饮水自由,大鼠重量229~261 g,平均(240±25) g;室内平均温度(20.0±2.0) ℃,室内平均湿度(50.0±5.0)%,每日光照12 h。将实验SD大鼠依据随机数字法分为对照组、TBI模型组和TBI干细胞治疗组,每组15只。
对照组SD大鼠不予特殊处理,TBI模型组和TBI干细胞治疗组SD大鼠均使用电子大脑皮挫伤撞击仪行TBI造模。模型打击参数:深度为2.0 mm,速度为5 m/s,击锤停留时间120 s。造模SD大鼠大脑各层结构皮质下及间质血管高度扩张充血、散在多发出血点,脑组织高度水肿伴炎细胞浸润表现,即造模成功。在造模24 h后,给予TBI干细胞治疗组SD大鼠尾静脉注射1.0×106个UC-MSCs;对照组和TBI模型组大鼠给予同体积0.9%氯化钠溶液尾静脉注射。UC-MSCs移植后第10天采用安乐死方式处死3组SD大鼠,取TBI模型组和TBI干细胞治疗组损伤侧损伤部位脑组织标本备用,取对照组同侧脑组织标本备用。本实验动物的处理符合伦理学要求。
1.3反转录聚合酶链反应 检测脑组织中IL-12和SOD信使RNA(messenger RNA,mRNA)的变化,采用Trizol法提取创伤区周围脑组织RNA,按照试剂盒说明进行反转录,合成互补DNA。反应条件:在93 ℃条件下3 min;随后以3步循环在92 ℃条件下,预变性30 s;在60 ℃条件下,退火30 s,随后72 ℃延伸30 s,共循环29次;72 ℃再延伸10 min。IL-12引物序列IL-12 (104 bp):TTTCTAGATGCTGGCCAATACA;ATCTCGGTGGACCAAATTCC。SOD2引物序列 (110 bp):AGCGTGACTTTGGGTCTTT;GCGACCTTGCTCCTTATTG;β肌动蛋白(122 bp):GTGTGGATTGGTGGCTCTATC;CAGTCCGCCTAGAAGCATTT。
1.4蛋白印迹分析 将100 mg创伤区脑组织置于1 mL细胞裂解液与蛋白磷酸酶混合物(99∶1)中,经液氮研磨,在4 ℃条件下,以离心半径20 cm,12 000 r/min离心20 min,取上清液(即总蛋白),采用蛋白印迹分析方法检测脑组织SOD和IL-12蛋白的表达水平。取含相同质量蛋白的上清液待检。加入聚丙烯酰胺凝胶电泳蛋白上样缓冲液充分混匀,沸水浴5 min,-20 ℃储存备用。经分离胶(聚丙烯酰胺凝胶)电泳分离蛋白后转模(采用湿转法转移至聚偏二氟乙烯膜),使用质量分数为5%的脱脂牛奶封闭1 h;加入目的一抗(SOD或IL-12多克隆抗体),在4 ℃条件下孵育12 h。分别与二抗[辣根酶标记的山羊抗兔/小鼠免疫球蛋白G抗血清(1∶12 000)]20 ℃室温,缓慢摇床震荡孵育2 h。曝光、扫描底片、对条带的灰度值进行量化分析。
1.5免疫组织化学法 取各组动物备用脑组织标本,经磷酸盐缓冲液冲洗后使用4%的甲醛固定,石蜡包埋,切片机切片(厚5 μm)。具体步骤如下:①大鼠脑组织标本经脱蜡、入水、切片后,在切片标本上滴加正常山羊血清封闭液,室温下静置20 min后,滴加目的一抗,置于4 ℃冰箱孵育过夜;②加入二抗,在37 ℃条件下静置20 min,0.1 mol/L磷酸盐缓冲液3次×5 min;③滴加辣根酶标记链霉卵白素工作液,在37 ℃条件下静置20 min,0.1 mol/L磷酸盐缓冲液洗3次×5 min;④严格按照DAB试剂盒[金克隆(北京)生物技术有限公司生产,批号:PN3120]进行操作;⑤苏木精-伊红染色,1%盐酸酒精分化、1%胺水反蓝、充分水洗、脱水、二甲苯透明5 min两次、中性树脂封片;⑥对各组阳性和阴性组织相行400×显微照相,反应产物定量分析采用光密度值表示,测定阳性产物的平均光密度值。
1.6血清IL-12的测定 术后10 d右心房采血,以离心半径20 cm,3 000 r/min离心5 min,去上清后按照酶联免疫吸附试剂盒(美国Abcam公司,批号:Ab63939,IL-12/P70,96T/48T)说明书操作,检测血清IL-12水平。

2 结 果
2.1各组大鼠IL-12、SOD的mRNA及蛋白表达比较 各组大鼠IL-12、SOD的mRNA及蛋白表达比较差异有统计学意义(P<0.05),与对照组相比,TBI模型组击打侧脑组织IL-12 mRNA、SOD mRNA、IL-12蛋白及SOD蛋白表达水平明显上调(P<0.01);TBI干细胞治疗组SOD mRNA和SOD蛋白表达水平明显上调(P<0.01),IL-12 mRNA和IL-12蛋白表达比较差异无统计学意义(P>0.05)。与TBI模型组相比,TBI干细胞治疗组IL-12 mRNA和IL-12蛋白表达水平明显下调,SOD mRNA和SOD蛋白表达水平明显上调(P<0.01)。 见表1。
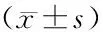
表1 各组大鼠IL-12、SOD的mRNA及蛋白表达比较
2.2各组脑组织SOD阳性细胞数比较 对照组、TBI模型组、TBI干细胞治疗组大鼠SOD阳性细胞数分别为(0.031±0.007)、(0.069±0.006)、(0.123±0.013),各组SOD阳性细胞数比较差异有统计学意义(F=2.104,P=0.005),与对照组相比,TBI模型组大鼠SOD阳性细胞数明显增多(P=0.003);与对照组及TBI模型组相比,TBI干细胞治疗组SOD阳性细胞数明显增多(均P<0.01)。见图1。
2.3各组血清IL-12水平比较 对照组、TBI模型组、TBI干细胞治疗组大鼠血清IL-12水平分别为(0.378±0.045) pg/mL、(5.450±0.941) pg/mL、(1.467±0.321) pg/mL,各组血清IL-12水平比较差异有统计学意义(F=3.797,P=0.008),TBI模型组血清IL-12水平高于对照组(P=0.004),TBI干细胞治疗组低于TBI模型组(P=0.007);TBI干细胞组高于对照组(P=0.010)。

SOD:超氧化物歧化酶;a:对照组;b:TBI模型组;c:TBI干细胞治疗组
3 讨 论
TBI居机体创伤发生率的第二位,在所有创伤疾病中,TBI致死人数居第一位,致死率和致残率均较高[1],因而受到人们的高度重视。据统计,我国2006—2013年TBI平均死亡率为14.97/10万[7]。TBI的急性期救治和后期康复的治疗费用较高,为患者家庭带来沉重负担。此外,TBI患者多伴有创伤相关的并发症,甚至出现精神后遗症,严重影响患者的治疗和生活质量的提高。
UC-MSCs是一类具有增殖和多向分化特征的细胞群,具有干细胞特性,易于分离、扩增简单、干性强、细胞原始、分化能力强[8-9]。有报道证实,体外扩增增殖的UC-MSCs可分泌多种细胞因子和可溶性生物活性的物质成分(纤维细胞生长因子、血管生成素、肝细胞生长因子、血管内皮生长因子以及外泌体等)[10-12]。MSCs具有强大的免疫调节功能。目前,MSCs主要用于临床抗移植排斥、风湿免疫性疾病的治疗、损伤后的组织修复、神经变性疾病的治疗、脑瘫的治疗及机体内环境稳态的维持[13-16]。
IL-12是重要的炎症因子,参与机体内炎症相关的免疫应答[17]。正常情况下,机体血清和脑组织中IL-12表达水平较低,而TBI后表达显著增加,参与机体炎症反应。Vonder Haar等[18]研究发现,IL-12在TBI发生后升高。本研究中,TBI模型组损伤侧脑组织中IL-12 mRNA和蛋白表达水平以及血清IL-12水平均较对照组明显升高,与上述研究结果一致。TBI干细胞治疗组脑组织IL-12 mRNA和蛋白表达水平以及血清IL-12水平均较TBI模型组明显下调。表明UC-MSCs可有效改变急性TBI模型大鼠血液和损伤脑组织中IL-12水平变化,可见UC-MSCs干预可在一定范围内改变炎症反应的进程,甚至可以扭转炎症反应,进而减轻TBI受损脑组织的损伤。
氧化应激是体内一系列病理生理反应引起的体内氧化与抗氧化失衡,导致中性粒细胞广泛浸润反应,蛋白酶分泌增加,使氧化中间产物产生过多。氧化应激是体内自由基产生的负面作用,是疾病产生和发展重要因素之一[19]。SOD是体内重要的抗氧化酶,可以清除体内过多的自由基,拮抗机体内氧化应激反应[20]。正常生理状态下,机体内SOD处于稳态;而TBI中,应激反应等导致SOD大量消耗。本研究中,TBI干细胞治疗组损伤脑组织中SOD mRNA和蛋白表达水平较TBI组明显上调,免疫组织化学结果亦显示,SOD阳性细胞数明显升高,表明UC-MSCs可有效上调损伤区域脑组织SOD水平,抑制体内自由基产生和氧化应激反应,为损伤区域组织修复和功能重建提供有益的再生微环境,从而减轻TBI受损伤脑组织进一步损伤。
综上所述,UC-MSCs移植可提高TBI大鼠脑损伤区域SOD的表达,并抑制氧化应激反应,降低IL-12 表达水平,有效控制炎症级联反应,有利于受损脑组织的恢复。
