新斯的明拮抗肌肉松弛对行腹腔镜手术全身麻醉患者术后恢复的影响
2020-08-21许坤陈燕君陆志俊周进
许坤,陈燕君,陆志俊,周进
(上海交通大学医学院附属瑞金医院卢湾分院麻醉科,上海 200020)
非去极化肌肉松弛药有益于全身麻醉气管插管和形成良好的手术条件,但是会产生肌肉松弛残余作用。越来越多的证据显示,肌肉松弛残余不仅增加了术后呼吸系统并发症发生率,还增加了住院医疗费用[1-3]。而新斯的明、嗅吡斯的明、安贝氯铵、加兰他敏等胆碱酯酶抑制剂可提高运动神经-骨骼肌终板部位的乙酰胆碱水平,竞争性抑制非去极化肌肉松弛药分子的作用,从而加快恢复肌力。手术结束时,用新斯的明拮抗肌肉松弛残余可以显著减少麻醉相关的并发症和降低死亡率[4-5]。然而,作为胆碱酯酶抑制剂,新斯的明会兴奋心脏、气管等器官的胆碱能受体,从而产生一系列不良反应,如心率减慢、平滑肌痉挛、分泌物增加等。有研究指出,新斯的明不但不能改善全身麻醉患者术后氧合,而且会增加住院时间和术后肺部并发症[6]。目前,新斯的明拮抗肌肉松弛是否对麻醉后监测治疗室(post-anesthesia care unit,PACU)中患者的整体恢复有利尚不清楚。因此,本研究拟以《最低PACU出室标准》为指标,旨在探索新斯的明拮抗肌肉松弛对患者术后恢复的影响。
1 资料与方法
1.1一般资料 选取2016年9月至2019年6月在上海交通大学医学院附属瑞金医院卢湾分院择期进行腹腔镜手术需全身麻醉的1 000例患者作为研究对象。入组标准:①手术中注射罗库溴铵和顺苯磺酸顺式阿曲库铵对患者进行肌肉松弛;②年龄<70岁;③美国麻醉医师协会分级Ⅰ~Ⅱ级;④手术时间在2 h以内;⑤未患重度神经肌肉系统病变;⑥未患重度肝肾功能病变。上述患者按照随机数字法分为拮抗组和安慰剂组,每组500例。本研究经上海交通大学医学院附属瑞金医院卢湾分院医学伦理委员会批准(批号:2014年伦审053号),患者均签署了知情同意书。
1.2方法 所有患者术前均不用药,送入手术室后进行常规监护,借助18号静脉导管完成外周静脉通路的构建。待患者进入手术室,先给予2 mg咪达唑仑。然后通过以下药物行麻醉诱导:芬太尼(2 μg/kg)(国药集团工业有限公司廊坊分公司生产,批号:160218,170914)、丙泊酚(2.5 mg/kg)(北京费森尤斯卡比医药有限公司生产,批号:160322,170526)以及罗库溴铵(也可为顺苯磺酸顺式阿曲库铵,应用剂量方面根据按3倍95%的有效药物剂量的计量方式用药)(荷兰欧加农公司生产,批号:160525,170115)。术中的维持麻醉用药为七氟烷,对患者血流动力学指标进行动态观察,依此增加或降低维持麻醉用药的浓度,并根据患者实际情况决定是否追加芬太尼。术中静脉滴注乳酸林格液,患者60 min输注剂量<10 mL/kg。控制体表温度不低于36 ℃。手术结束前,所有患者均接受0.3 mg的盐酸雷莫斯琼及0.04 g的派瑞昔布注射治疗。
腹腔镜术后,将所有已建立气管导管的患者转移至PACU,其中拮抗组患者在PACU中使用新斯的明40 μg/kg(江苏浦金药业有限公司生产,批号:160315)进行拮抗;安慰剂组患者在PACU中注射5 mL 0.9%氯化钠溶液。监测其体征和肌肉松弛程度,监测过程中将刺激电极置于被监测对象手腕尺神经径路上,以四个成串刺激(train of four stimulation,TOF刺激)(每次间隔0.5 min,电流强度为30 mA)监测拇内收肌抽搐反应。待TOF刺激见2次抽搐反应时,对患者予以0.9%NaCl注射液或新斯的明进行干预。气管导管拔除时机由PACU麻醉医师决定。拔管后,患者的监测状态改为无创血压、血氧饱和度监测和心电监护。给予患者鼻吸氧(5 L/min)。当患者状态达到《最低PACU出室标准》时,再次给予TOF刺激,直到TOF刺激比值(train-of-four stimulation ratio,TOFR)>0.9时,将患者送回病房,继续给予无创血压、血氧饱和度监测和心电监护。术后24 h进行随访,根据护理记录判定患者在术后24 h内是否出现低氧血症(血氧饱和度<90%)。
1.3观察指标 主要指标:患者被移至PACU,至其符合《最低PACU出室标准》的时间。次要指标:①患者被移至PACU时的TOFR,以及符合《最低PACU出室标准》时的TOFR;②患者拔管后24 h发生低氧血症(血氧饱和度<90%)与否;③术后因恶心呕吐、疼痛需治疗的患者数量;④患者术后30 d内因呼吸系统不良反应而就医;⑤术后住院时间;⑥住院总费用。

2 结 果
2.1两组患者的一般资料比较 本研究拟纳入1 000 例患者(两组例数均等)。其中,拮抗组手术时间在2 h以上或术式有所调整的患者29例,失访患者49例,最终纳入422例。安慰剂组手术时间在2 h 以上或术式有所调整的患者19例,失访患者81例,最终纳入400例。两组患者的性别、年龄等一般资料比较差异无统计学意义(P>0.05),见表1。
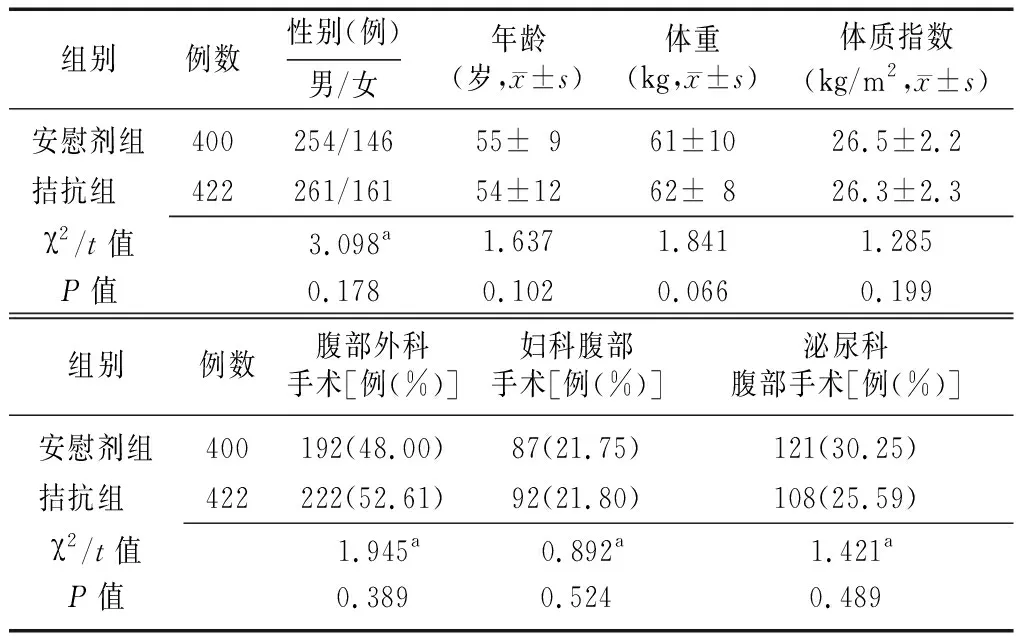
表1 两组行腹腔镜手术需全身麻醉患者的一般资料比较
2.2两组患者的手术时间与术中用药情况比较 两组患者的手术时间、使用顺式阿曲库铵和使用罗库溴铵的比例、肌肉松弛药用量、芬太尼用量比较差异无统计学意义(P>0.05)。见表2。
2.3两组患者达到《最低PACU出室标准》时的时间和TOFR、入PACU时TOFR比较 拮抗组达到《最低PACU出室标准》的时间短于安慰剂组,达到《最低PACU出室标准》TOFR高于安慰剂组(P<0.01);两组入PACU时的TOFR比较差异无统计学意义(P>0.05)。见表3。

表2 两组行腹腔镜手术需全身麻醉患者的手术时间与术中用药情况比较
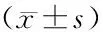
表3 两组行腹腔镜手术需全身麻醉患者达到《最低PACU出室标准》时的时间和TOFR、入PACU时TOFR比较
2.4两组患者术后不良反应发生率比较 两组术后24 h低氧血症、恶心呕吐、疼痛、术后30 d内因呼吸系统不良反应就医的发生率比较差异无统计学意义(P>0.05)。转入病房后,无一例患者发生低氧血症。见表4。

表4 两组行腹腔镜手术需全身麻醉患者的术后不良反应发生率比较 [例(%)]
2.5两组患者术后住院时间和住院总费用比较 两组患者术后住院时间和住院总费用比较差异无统计学意义(P>0.05)。见表5。
3 讨 论
术后肌肉松弛残余一直是全身麻醉的主要并发症之一[7]。虽然中时效肌肉松弛药已广泛使用,但肌肉松弛残余的发生比例仍较高[8-10]。在国内常用的中时效肌肉松弛药中,顺式阿曲库铵出现肌肉松弛残余的比例为57%,罗库溴铵出现肌肉松弛残余的比例为44%[11]。目前,对患者肌力评价主要是通过肌肉松弛监测仪进行,测定TOFR。有学者对健康受试者进行研究发现,当TOFR处于0.4~0.9时,受试者会出现睁眼困难、复视、咽水呛咳、自觉乏力等肌力减弱症状;但当TOFR恢复至≥0.9时,这些不适症状全部消除[12]。因此,TOFR恢复至0.9被认为是肌力完全恢复的金标准。本研究中主要观察患者的整体恢复情况,并未将TOFR恢复至0.9作为主要研究指标,但实际患者离开PACU时TOFR均恢复至0.9。
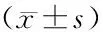
表5 两组行腹腔镜手术需全身麻醉患者的术后住院时间和住院总费用比较
新斯的明是一种胆碱酯酶抑制剂,它能抑制胆碱酯酶对乙酰胆碱的降解,使更多的乙酰胆碱与骨骼肌终板板处的乙酰胆碱受体结合,加快肌力的恢复。手术结束时使用新斯的明拮抗肌肉松弛药,能显著降低术后肌肉松弛残余的发生率,减少麻醉相关的不良反应[13]。因此,欧美国家麻醉医师术后普遍将新斯的明作为拮抗药物,其在美国麻醉患者术后的应用率达70%以上[14-15]。《肌肉松弛药合理使用专家共识》(中国麻醉学会制订)也将新斯的明列入拮抗肌肉松弛残余药物[16]。其拮抗肌肉松弛残余的效果与肌肉松弛程度有关。对于轻至中度的肌肉松弛,新斯的明能显著加快肌力恢复。但对于重度肌肉松弛,新斯的明拮抗不仅使肌力恢复时间显著延长,而且使肌力恢复时间的变异性明显增加[17]。肌肉松弛监测指标可以用于判断肌肉松弛程度,一般认为TOF刺激产生1~2个反应时,肌力已有中度恢复。本研究中,患者进入PACU后立即行肌肉松弛监测,所实施的TOF刺激相隔时间为30 s,待TOF刺激产生2次抽搐反应时,进行新斯的明或安慰剂注射治疗,以达到最佳的拮抗效果。
新斯的明抑制胆碱酯酶功能后产生的过量乙酰胆碱,除了能增加与骨骼肌终板处受体的作用外,也会产生其他不良反应,乙酰胆碱还可以与心肌、气管平滑肌等其他器官的M样受体结合,引起心率减慢、气管平滑肌痉挛、分泌物增加等不良反应,患者在苏醒后会产生术后恶心、呕吐等症状。但在某些情况下,新斯的明拮抗后仍会出现肌肉松弛残余:①当患者肌力已自发恢复至接近正常水平时,如继续给予新斯的明拮抗,可能会重新使肌力减弱,这主要是因为新斯的明增加了骨骼肌终板处乙酰胆碱含量,乙酰胆碱对乙酰胆碱受体持续激活,会引起去极化阻滞,影响离子通道的继续开放,从而使肌力减弱;②当患者处于深度肌肉松弛状态下时,非去极化肌肉松弛药分子大量与乙酰胆碱受体结合,干扰了乙酰胆碱的作用,从而使肌肉松弛恢复时间明显延长;③在某些病理情况或有其他药物的作用下,肌肉松弛药代谢受到抑制,作用时间明显延长,肌肉松弛药半衰期超过新斯的明的半衰期,故当新斯的明作用消退后,可能使患者再次出现肌肉松弛的症状。因此,新斯的明拮抗非去极化肌肉松弛药的利弊需进一步评价。Grosse-Sundrup等[18]开展的一项包含38 000例患者的回顾性研究发现,新斯的明拮抗肌肉松弛增加了患者术后低氧血症的发生(血氧饱和度<90%)和再次气管插管的风险。Sasaki等[6]测定了患者PACU中氧合状态、术后肺不张发生和术后住院时间发现,新斯的明拮抗并不能改善患者在PACU中的氧合状态,且当大剂量(>60 μg/kg)使用新斯的明时,患者的术后住院时间和发生肺不张的风险均明显增加[6]。但本研究中,使用新斯的明拮抗后,患者恢复至达到《最低PACU出室标准》的时间明显缩短,且当达到该标准时,TOFR明显高于安慰剂组。本研究结果还显示,新斯的明拮抗(辅以阿托品)未增加患者术后并发症(低氧血症、恶心呕吐、术后疼痛和术后呼吸系统并发症)的发生率,未增加术后住院时间和总住院费用,说明新斯的明拮抗可以加快患者术后恢复,不会增加不良反应的发生率,也不会增加医疗费用。本研究与上述两个研究的不同之处为:①Sasaki等[6]的研究患者是在手术室中拔出气管导管后再送入PACU,而本研究中患者是送入PACU中再进行拔管,两个研究患者进入PACU时的肌肉松弛程度存在差异,故对试验结果产生一定影响;② Sasaki 等[6]的研究使用新斯的明剂量为60 μg/kg,这一剂量不但不会加快患者恢复反而会引起较高的不良反应率,而本研究采用40 μg/kg的剂量,证实低剂量新斯的明可以加快患者恢复,故剂量因素产生结果差异。以往有研究表明,新斯的明高于40 μg/kg时,患者肌力恢复不再进一步加速[19],故本研究应用低剂量(40 μg/kg)新斯的明。Sasaki等[6]研究发现,仅大剂量(>60 μg/kg)新斯的明才能延长患者术后住院时间,增加肺不张的发生率。
以往研究只纳入肌肉松弛监测指标来判定肌肉松弛恢复的情况,而患者麻醉恢复应是系统性的,不仅仅是肌力恢复。本研究首次采用《最低PACU出室标准》作为患者麻醉恢复的主要指标。该指标不仅评价了肌力恢复,还评价了心血管、呼吸等各主要器官功能的恢复[7]。新斯的明的作用不局限于神经肌肉突触,还对心、肺、胃肠道等均有药理作用,所以《最低PACU出室标准》较单纯TOFR更适合于本试验的研究目的,结果也更适合用于指导临床工作。本研究结果支持使用新斯的明拮抗肌肉松弛残余。新斯的明不会增加术后肺部并发症。一项临床研究显示,新斯的明拮抗对患者恢复无不良影响[20]。其拮抗效果、不良反应受剂量影响,但本研究只对40 μg/kg的剂量展开探讨,调低剂量是否仍具备有效性,尚待进一步研究。
综上可知,低剂量(40 μg/kg)新斯的明可帮助患者于PACU内尽快恢复,且不会延长患者术后住院时间、增加总住院费用以及术后呼吸系统不良的发生率。
