裂壶藻突变株S1的细胞生长及其油脂合成的超微结构
2020-08-17喻书诚
郑 操,喻书诚,陈 涛
(1.湖北工程学院生命科学技术学院,湖北孝感 432000;2.中国科学院武汉病毒研究所,湖北武汉 430071)
二十二碳六烯酸(docosahexenoic acid,DHA)是一种对人体具有极高营养价值的多不饱和脂肪酸,对婴幼儿的智力发育和视力形成起着至关重要的作用[1-2],同时也可降低人们患心血管疾病、关节炎、哮喘等慢性疾病的概率[3-5]。DHA生物功效的多样性,使其已成为食品科学乃至跨学科领域持续的研究热点,并且已经作为食品添加剂和营养强化剂得到广泛的应用[6-8]。
裂壶藻(Schizochytriumsp.)是属于真菌门、网粘菌纲、破囊壶菌目、破囊壶菌科的一类海洋真菌[9]。其在生长过程中可在胞内积累富含DHA的油脂,由于其具有生长速度快、易于培养、胞内DHA含量高等优点,并且使用安全、无任何毒副作用,成为商业化生产DHA的重要藻株之一[10-12]。近年来,人们围绕裂壶藻中DHA产量的提高开展了大量的研究[13-15]。一方面,从改变裂壶藻自身的遗传性状出发,通过物理诱变、化学诱变等诱变技术筛选得到高产DHA藻株[10,16-17];另一方面,从改变裂壶藻发酵培养过程的外部条件出发,通过优化发酵培养基组成[18-20]、改善发酵培养条件[21-23]等方面提高裂壶藻的DHA产量。
虽然人们在如何提高裂壶藻油脂产量和DHA产量等方面进行了较为深入的研究[22-23],但这些往往是从宏观水平反映油脂总量的变化,无法从显微水平直接分析和比较裂壶藻胞内油脂合成的规律。我们前期以野生型裂壶藻株ATCC20888为出发藻株,利用低能离子注入诱变技术,筛选获得一株高产DHA的突变株S1[10]。为从微观水平上探索该突变株与出发株ATCC20888在细胞生长发育和胞内油脂的形成过程,本实验将不同培养时间的藻株细胞制成超薄切片,通过透射电子显微镜观察、拍片,对所拍摄的图片进行比较和分析,以期实现不同藻株中的油脂产量在宏观和微观上的统一,为进一步诱导突变藻类、筛选高产DHA微藻提供参考,也为裂壶藻细胞生长发育过程和油脂合成机理的研究提供一定指导。
1 材料和方法
1.1 材料与仪器
裂壶藻野生株ATCC20888 广东微生物菌种保藏中心提供;裂壶藻突变株S1 本实验室保藏[10]。
HZ150L恒温摇床 武汉瑞华仪器设备有限公司;H/T12MM离心机 湖南赫西仪器装备有限公司;BJ-2CD超净工作台 上海博迅医疗生物仪器股份有限公司;EM UC7切片机 德国Leica公司;Tecnai G20 TWIN透射电子显微镜 美国FEI公司。
1.2 实验方法
1.2.1 藻株培养 将本实验室保存的裂壶藻野生株ATCC20888和裂壶藻突变株S1活化后转接于液体培养基中。培养基成分为:葡萄糖75 g/L,谷氨酸钠15 g/L,酵母膏6 g/L,NaCl 2.4 g/L,MgSO46 g/L,以及金属离子混合液和维生素混合液各2 mL/L[10]。将接种的液体在26~28 ℃,180~200 r/min条件下,连续培养7 d。其中,裂壶藻突变株S1需收集其培养第1、2、3、4、5、6和7 d的藻体;裂壶藻野生株ATCC20888为对照藻株,其生长周期为4 d,收集其培养第1、4和7 d的藻体。
1.2.2 藻体细胞的收集 达到上述所需培养时间点后,取10 mL培养液低速500~1000 r/min离心10 min,除去大分子杂质,再经3500~4000 r/min离心30 min,收集藻体,再将藻体经PBS制成悬浮液,4000 r/min离心30 min收集藻体,洗涤2~3次,经光学显微镜检查,样品纯,无杂质,冰箱保存备用。
1.2.3 样品超薄切片及电子显微镜观察 将上述收集的不同天数的所有样品用2.5%戊二醛和1%锇酸双固定后,脱水,用丙酮、环氯树脂混合液渗透后包埋,在切片机上完成切片,用铅-钠双染色后干燥,利用透射电子显微镜观察并拍片[24]。
1.2.4 藻体细胞的测定及分析 将电子显微镜所拍摄的样品图片,在电脑中进行比对并测量,计算出藻细胞和油滴的形状、大小,分析藻体细胞生长发育和油脂合成过程的变化。
1.3 数据处理
所有数据采用SPSS 22.0软件进行显著性分析。
2 结果与分析
2.1 裂壶藻野生株ATCC20888的生长发育和油脂合成的过程
裂壶藻野生株ATCC20888生长第1 d时,初始细胞呈单个稍椭圆形;在生长过程中细胞逐渐分裂,形成多个细胞包含于一个囊膜中的多个藻细胞整体(图1A);在光学显微镜下也可以看到藻体有裂缝的多个细胞,这是裂壶藻的典型特征。第1 d藻体已经合成了较小颗粒的油滴(图1A)。第4 d藻体囊膜溶解,但是也可以明显看到单个藻细胞尚未完成分离(图1B)。藻体细胞内形成了单个较大的油滴,油体以透明状、深色状和隆脊状并存,说明胞内油脂合成的时间不同,获得的油滴状况也不一样。第7 d藻体细胞仍聚集在一起(图1C)。胞内油滴单个可见,但油脂呈隆脊状且颜色明显加深。
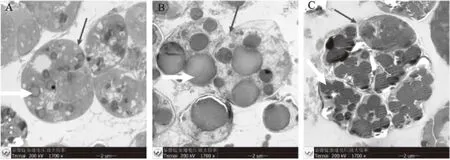
图1 裂壶藻野生株ATCC20888细胞生长发育和油脂合成过程(1700×)Fig.1 The processes of cellular growth and lipid synthesis of Schizochytrium sp.ATCC20888(1700×)注:图1中A、B、C分别为裂壶藻野生株ATCC20888生长第1、4、7 d的细胞超微结构图;其中细箭头指示囊膜,粗箭头指示油滴。
从野生型藻株生长发育、超微结构中看出,生长第1、7 d的裂壶藻是囊膜包裹着的多个细胞的整体,其表面似裂痕,呈壶状,这就是裂壶藻得名的主要原因。但随着生长至4 d时,包裹着的囊膜自溶游离出单个的藻细胞,因而推测裂壶藻生长周期约4 d。裂壶藻野生株ATCC20888的胞内油脂形成中,生长第1 d油滴较少而且体积较小(图1A);生长第4 d和第7 d时,胞内油滴多为单个,无成块或连成片的状况出现(图1B和1C)。
2.2 裂壶藻突变株S1生长发育和油脂合成的过程
裂壶藻突变株S1生长第1 d,可见囊膜内存在多个细胞,胞内有多个甚至几十个油滴,从而使仅一个囊膜内油滴总数可达几十个,但油滴较小,颜色深浅不一(图2A)。生长第2 d仍可见囊膜内的多个细胞,但大部分囊膜已自溶,仅存些许痕迹,胞内油滴总数减少但体积变大,油滴颜色深浅不一(图2B)。生长第3 d,虽然仍可见囊膜内有多个细胞存在,但已经出现了囊膜自溶后,细胞游离成单个个体的情况,胞体内油滴数进一步减少,油滴体积变大,有的连成块状,油滴颜色深浅不一且存在隆脊状(图2C)。生长第4 d,大多数藻体囊膜自溶,细胞游离成单个个体,胞内油脂体积进一步变大,连成片状且可见隆脊状油滴(图2D)。生长第5 d,绝大多数藻体囊膜自溶,囊内细胞游离出来,胞内油滴多为大块状,少数已连成片状,其油滴颜色较深且隆脊状明显(图2E)。生长第6 d藻体大多数囊膜自溶,细胞游离出来,胞内油滴连成块状或片状,甚至充满整个细胞,可见明显隆脊状油滴(图2F)。生长第7 d,藻体囊膜基本自溶,单个细胞游离出来,胞内油滴连成片状,多数细胞内充满了油脂(图2G)。
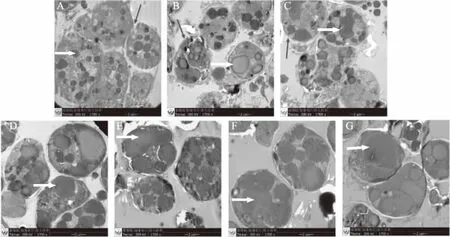
图2 裂壶藻突变株S1细胞生长发育和油脂合成过程(1700×)Fig.2 The processes of cellular growth and lipid synthesis of the mutant strain S1 of Schizochytrium sp.(1700×)注:图2中A~G分别为裂壶藻突变株S1生长第1、2、3、4、5、6和7 d的细胞超微结构。其中细箭头指示囊膜,粗箭头指示油滴。
可以看出,经低能离子注入技术诱变获得的突变株S1,其生长发育与野生株ATCC20888则完全不同。从生长第1 d开始直至第7 d结束都可见单个藻细胞生长。生长时间越长,基本上看不到囊膜包裹的多个藻细胞整体。这与野生型藻株的细胞生长发育有着很大差异,其原因仍待研究。与野生株相比,裂壶藻突变株S1在生长第1 d就可见一个细胞内有多个小油滴存在(图2A),随着生长时间的延长,胞内油滴越来越多(图2C),直至第4 d出现油滴成块状现象(图2D),生长第5、6和第7 d时,胞内油滴明显变大,连成块状或片状,且基本充满整个藻细胞(图2E~图2G)。通过超微结构观察到突变株胞内油脂合成过程,与野生藻株有明显区别,从显微水平上揭示了裂壶藻突变株S1株油脂含量高、DHA产量高的奥秘。
2.3 裂壶藻细胞大小
在各组照片中选取典型的藻体细胞进行细胞大小测量,其结果见表1。从表1看出,Y1、Y7两组野生株组细胞大小与所有突变株组(T1~T7)均有极显著差别(P<0.01),这两个野生株组(Y1、Y7)的藻细胞极显著大于突变株组(T1~T7),究其原因是原始藻株囊膜包裹着多个细胞,囊膜未自溶,细胞无法游离,导致体积更大。而突变株组(T1~T7)的藻细胞从培养第1 d起就有许多单个游离的藻细胞,只见少数囊膜包裹着多个藻细胞的藻体。野生株培养生长第4 d(Y4)时,单个藻细胞体积减小,而突变株(T1~T7)在培养过程中细胞大小基本无显著差异(P>0.05),只有在第5 d(T5)和第6 d(T6)稍大些,这时,藻细胞内已充满油脂。
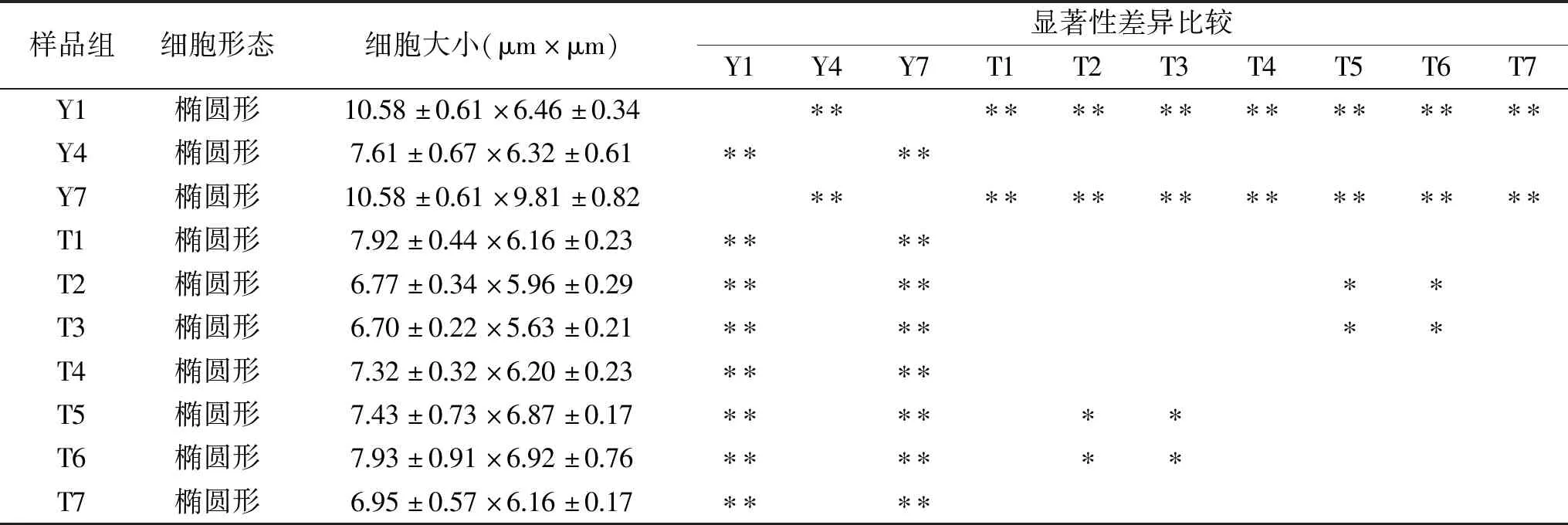
表1 裂壶藻细胞的大小Table 1 The cell size of Schizochytrium sp.
其中Y1、Y4、Y7分别代表裂壶藻野生株ATCC20888培养第1、4 d和第7 d的样本;T1、T2、T3、T4、T5、T6、T7分别代表裂壶藻突变株S1培养第1~7 d的样本;*表示差异显著(P<0.05),**表示差异极显著(P<0.01),其余为不显著;表2同。
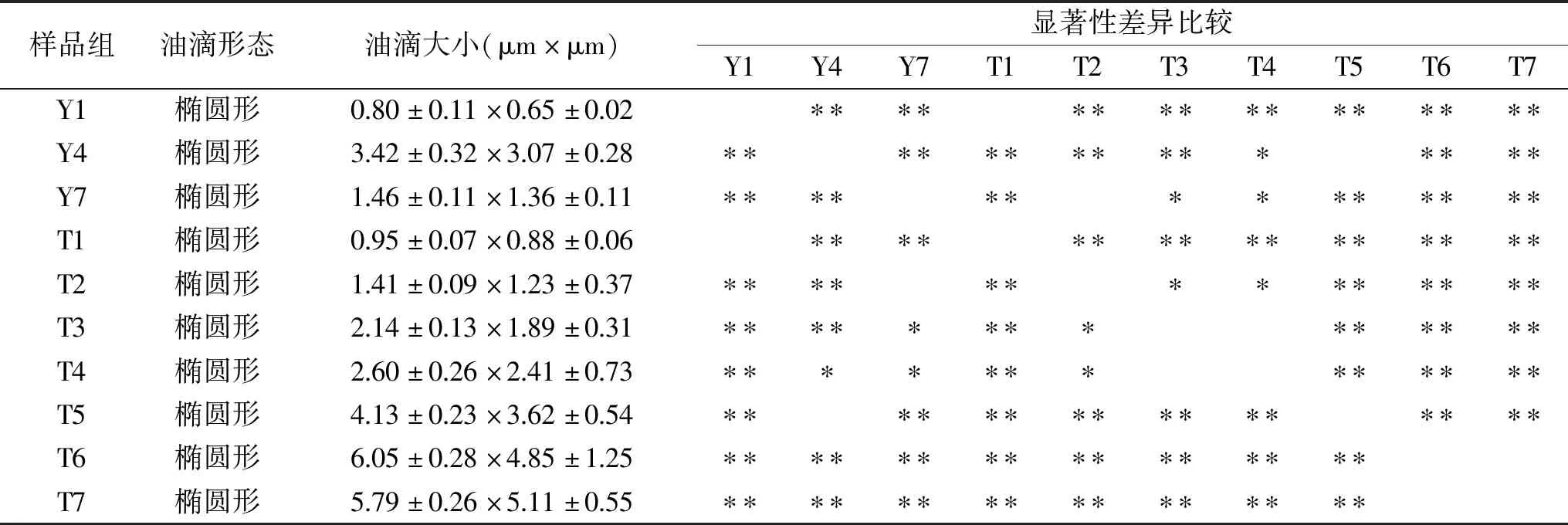
表2 裂壶藻胞内油滴的大小Table 2 The size of intracellular oil droplets of Schizochytrium sp.
2.4 裂壶藻胞内油滴大小
在各组照片中选取典型的藻体细胞进行胞内油滴大小测量,其结果见表2。从表2可以看出,Y4的油滴大小与Y1和Y7均有极显著差异(P<0.01),Y4油滴较大。这与表1中所述Y1、Y4、Y7组的藻细胞生长发育一致,从而可以推测,裂壶藻的生长周期约为4 d。通过对比各生长时期胞内油滴大小及形态,发现突变株胞内油滴随着发酵培养时间的延长而变大。尤其是第4 d(T4)后,变大非常明显,第6 d(T6)达到最大,这时,藻细胞内基本充满油滴,且油滴呈块状或片状分布。
2.5 裂壶藻突变株S1胞内油脂合成的形态变化过程
综上所述,裂壶藻突变株S1胞内油脂形成过程可细分为三个阶段:第一阶段,在生长第1~2 d时,油脂成滴状,颜色较浅;第二阶段,在生长3~4 d时,油脂连成块状,油滴颜色加深,可观察到呈波浪形的山峰状油滴,峰脊清晰可见;第三阶段,在生长5~7 d时,油脂形成的峰脊和峰谷非常明显,其结果与Ashford等[25]的研究结果研究基本一致。但他们采用的冷冻蚀刻技术,而本文利用超薄切片技术,看到的胞内油滴的超微结构更清晰,峰脊与峰谷清晰可见,这可能就形成了甘油三酯骨架进而组成多不饱和脂肪酸和DHA的油滴。
3 结论
本实验通过透射电镜对裂壶藻突变株S1和野生株ATCC20888的生长发育及胞内油脂形成过程进行了对比分析。结果表明突变株生长发育速度、胞内油脂合成速度以及油脂含量均优于野生株,并初步阐释了突变株S1油脂含量高、DHA产量高的奥秘,从微观水平上探索细胞发育和油脂形成过程提供了研究思路,为今后藻类诱导突变、藻株筛选及突变株性能鉴定提供了参考。
