乳铁蛋白对幼年大鼠骨健康影响
2020-08-17赵添玉邹丹阳谢银丹商佳琦
赵添玉,邹丹阳,谢银丹,许 岩,商佳琦,刘 宁
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
骨是一种高活性结缔组织,可以通过骨代谢及骨重塑来修复自身微损伤,保持骨结构、荷载及钙含量的内稳态平衡[1],同时骨也作为内分泌器官调控代谢过程[2],是维持人体生命的重要器官。从新生儿时期开始,骨量随年龄的增长而增加,直到青年时期骨发育成熟,骨量达到峰值[3]。研究发现,青少年时期注意提高骨量,能够在青年时期获得个体峰值骨量[4]。因而青少年时期骨的生长发育对骨的成熟至关重要。有研究指出,青少年时期的骨密度(Bone mineral density,BMD)决定了成年后的骨量峰值和随后的骨丢失速率[5]。BMD降低会导致骨量不足,从而引发佝偻病、软骨病等一系列骨疾病[6],严重影响青少年的骨健康。在这一时期,营养的补充是影响骨量峰值的重要因素[5],摄入营养物质能够提高骨量峰值,促进骨的形成。因此寻求一种天然的功能性营养物质来提高青少年BMD,增加骨形成,对提高骨量、预防青少年骨折与中老年骨质疏松症等骨疾病以及维持骨健康有着重要意义。
乳铁蛋白(Lactoferrin,LF)是一种骨调节效应物[7],它是一种80 kDa的铁结合糖蛋白[8],存在于母乳、炎性反应高发区以及嗜中粒细胞的次级颗粒中,属于转铁蛋白家族成员之一[9],其具有抗炎、抗肿瘤[10]、抗癌[11]、抗病毒[12]、抗微生物活性[13]、抑菌[14]、免疫调节[15]、促进神经发育和认知[16]、促进铁吸收[17]以及成骨活性[18-19]等多重作用。随着对LF研究的深入,越来越多的学者将注意力转移到了LF抑制破骨、促进成骨作用的研究。在体外细胞实验中证实,LF可以作为有效促进骨生长的合成因子[20],促进骨形成细胞——成骨细胞(Osteoblast,OB)的增殖和分化[21],并有效地抑制骨吸收细胞——破骨细胞(Osteoclast,OC)的形成[22],从而在OB和OC的相互作用下调节骨量平衡。而在体内实验中,国内外对LF的研究多集中于治疗骨质疏松、骨关节炎等骨疾病以及新生儿的免疫等领域[23-24],但是对青少年摄入LF后骨形成及骨量的影响目前还没有报道。因此研究青少年时期摄入LF对骨的影响机制,对开发LF应用于青少年的营养食品具有重要意义。
本研究以4 周龄幼年大鼠骨生长的模型为研究对象,通过研究补充LF对幼年大鼠体重、脏体比、BMD、骨微观结构以及血清和股骨骨髓组织中骨吸收标志物TRACP、MMP-9、CTSK及骨代谢过程中RANKL、OPG和OPG/RANKL的影响,探究LF对大鼠幼年时期骨健康的作用,为其应用于开发青少年骨健康食品提供参考依据。
1 材料与方法
1.1 材料与仪器
LF 纯度为96.3%,新西兰霍基蒂卡韦斯特兰乳制品有限公司;大鼠TRACP酶联免疫吸附测定试剂盒、大鼠MMP-9酶联免疫吸附测定试剂盒、大鼠CTSK酶联免疫吸附测定试剂盒、大鼠RANKL酶联免疫吸附测定试剂盒、大鼠OPG酶联免疫吸附测定试剂盒 上海江莱生物科技有限公司;Trizol 美国Invitrogen公司;红细胞裂解液 江苏凯基生物技术股份有限公司;PBS 美国Gibco公司;Prime ScriptTMRT reagent Kit with gDNA Eraser 大连宝生物工程有限公司;GoTaq® qPCR Master Mix 美国Promega公司;40 只幼年雄性Sprague-Dawley(SD)大鼠,4 周龄(鼠的周龄参考了Sengupta[25]的研究,研究发现,大鼠在4~5 周龄时(约35 d)进入青春期,由于大鼠生长期发育迅速,根据青春期前后计算大鼠在4~8 周龄相当于人9~18 岁青少年时期。因此选择4 周龄大鼠喂养30 d作为幼年大鼠骨生长的研究模型进行研究) 北京维通利华实验动物技术有限公司,合格证号scxk(京)2016-0006,。
TE 601-1电子天平 北京赛多利斯仪器系统有限公司;Skyscan1276Micro-CT 美国bruker公司;DYY-8C型电泳仪 北京六一仪器厂;高压灭菌锅 上海申安医疗器械厂;WIGGENS Vortes3000涡旋振荡器 北京桑翌实验仪器研究所;GL-21M离心机 上海市离心机械研究所;DHP-9082型电热恒温培养箱 上海一恒科技有限公司;Step One Plus TM荧光定量PCR仪 Life Technologies/美国;UV-2401PC紫外可见分光光度计 日本岛津仪器有限公司。
1.2 实验方法
1.2.1 动物实验设计 将大鼠安置在(24±2) ℃温度和50%±10%相对湿度的动物房间内,改变12/12 h的光/暗周期。动物实验在东北农业大学动物伦理学的认可下进行,动物护理和实验按照东北农业大学实验室动物护理和使用指南进行。大鼠饲喂标准大鼠饲料7 d后,随机分为对照组(0 mg/kg bw/d)、LF低剂量组(100 mg/kg bw/d)、LF中剂量组(500 mg/kg bw/d)和LF高剂量组(1000 mg/kg bw/d),每组10只,对照组灌胃等量的蒸馏水。每天测量大鼠固体饮食的摄入量。实验第30 d,大鼠禁食12 h,腹腔注射戊巴比妥钠(40 mg/kg bw)麻醉,腹主动脉采血后将大鼠处死,全血3000 r/min、15 min离心分离获得血清,-80 ℃保存。解剖分离各组大鼠左侧股骨,4%多聚甲醛固定;取大鼠右侧股骨提取骨髓[26],将骨髓放置液氮中速冻后迅速放入-80 ℃保存。
灌胃LF的剂量参考Shumake等[27]文献,假设婴儿平均每天摄入母乳为780 mL,按照母乳中LF浓度为1.0 g/L,婴儿体重为3.5 kg,婴儿平均每天LF摄入量为223 mg/kg。根据人和大鼠的等效计量,体表面积转换[28-29],换算成大鼠等效剂量为743~750 mg/kg。此外,参考了Cerven等[28]的LF大鼠急性毒性实验,1000 mg/kg bw/d为最大安全剂量。因此设置了500 mg/kg bw/d为中剂量组,100和1000 mg/kg bw/d分别为低和高剂量组。
1.2.2 大鼠的体重测量 灌胃前称量大鼠体重,之后每隔10 d称量各组大鼠体重,记录体重数据并分析。
1.2.3 大鼠脏体比值计算 取大鼠肝、脾和肾称重,计算出各组内脏的比值:



1.2.4 大鼠股骨显微CT检测 取多聚甲醛固定好的各组大鼠左侧股骨,采用Micro-CT对股骨的显微结构进行评价。分别将待测股骨放入Micro-CT仪的样本杯中,进行扫描。扫描条件为:电压75 kV,电流200 μA,180 °旋转扫描,扫描时间为17 min,曝光时间460 ms,帧平均1 帧,角度增益0.4 °,分辨率6 μm。对同一样品扫描获得1027 张不同角度的4032×2688像素的图片。通过NRECON程序对扫描得到的样品信息在相同条件下进行三维CT重建,而后选取股骨远端距生长板(骨骺)0.77~3.85 mm的骨组织为兴趣区域(Region of interest,ROI)进行分析,如图1。定量分析使用CTAn软件,分析参数包括BMD、骨小梁数量(Trabecular bone number,Tb.N)、骨小梁厚度(Trabecular bone thickness,Tb.Th)和骨小梁分离度(Trabecular bone space,Tb.Sp)。

表1 引物序列Table 1 The primer sequences

图1 骨小梁的垂直范围(参照标准生长版参考水平定义)Fig.1 The vertical extent of the trabecular ROIs(defined withreference to a standard growth plate reference level)注:ROI区域参考Method for ex-vivo micro-CTanalysis of rat bone(proximal tibia,distal femur)中图1区域分析。
1.2.5 大鼠血清中骨代谢生化指标检测 取-80 ℃保存的大鼠血清,采用酶联免疫吸附实验(ELISA)法检测大鼠血清中骨吸收指标TRACP、MMP-9、CTSK和RANKL和骨形成指标OPG水平,操作步骤严格按照说明书进行。应用Bio-RAD酶标仪测量450 nm处吸光度(A)值,并将其在标准曲线下换算成浓度值。
1.2.6 实时荧光定量PCR技术检测大鼠骨髓中骨代谢相关基因的表达 取-80 ℃保存的股骨骨髓,液氮处理骨髓组织,用Trizol法提取骨髓总RNA。具体操作如下:首先取50~100 mg右腿股骨骨髓组织(新鲜或-80 ℃及液氮中保存的组织均可)置1.5 mL离心管中,加入适量红细胞裂解液充分裂解,PBS洗涤后,加入1 mL Trizol充分匀浆,室温静置5 min;加入0.2 mL氯仿,振荡15 s,静置2 min;4 ℃,12000×g离心15 min,取上清;加入0.5 mL异丙醇,将管中液体轻轻混匀,室温静置10 min;4 ℃,12000×g离心10 min,弃上清;加入1 mL 75%乙醇,轻轻洗涤沉淀;4 ℃,7500×g离心5 min,弃上清;晾干,加入适量的DEPC H2O溶解(65 ℃促溶10~15 min)。
采用RT-PCR法检测,使用Prime ScriptTMRT reagent Kit with gDNA Eraser试剂盒,按说明书操作将RNA反转录成cDNA(混合后的反应体系立即在37 ℃水浴中反应15 min,然后85 ℃,5 s灭酶,逆转录的cDNA 4 ℃存放)。按照GoTaq® qPCR Master Mix说明书的方法配制PCR荧光定量反应液,使用Step One PlusTMSystem系统进行各基因PCR扩增,反应条件为:预变性:95 ℃,2 min(1个循环);PCR:变性:95 ℃,15 s,延伸60 ℃,60 s(40 个循环);融解曲线:95 ℃,15 s;60 ℃,15 s;95 ℃,15 s(1个循环)。以GAPDH为内参,引物序列由上海生工生物工程股份有限公司合成,扩增条件:95 ℃,2 min;95 ℃,30 s;60 ℃,30 s(40 个循环)。基因引物序列表见表1。
1.3 数据处理

2 结果与分析
2.1 补充LF对幼年大鼠体重的影响
对幼年大鼠灌胃LF后的体重变化结果见表2。由表2可知,LF低剂量组、LF中剂量组和LF高剂量组幼年大鼠的体重与对照组生长趋势相近,并无显著差异(P>0.05),由此说明,补充LF对幼年大鼠的体重无显著影响,这与陈科等[30]研究结果一致。

表2 LF对幼年大鼠体重的影响Table 2 Effect of LF on body weight of juvenile rats
2.2 补充LF对幼年大鼠脏体比的影响
由表3可知,LF低剂量组、LF中剂量组和LF高剂量组幼年大鼠与对照组相比,其肝体比、脾体比和肾体比均无显著性差异(P>0.05),这与Cerven等[28]的急性毒性试验研究结果一致,说明LF对幼年大鼠主要脏器的重量无明显影响,摄入LF是安全的。

表3 LF对幼年大鼠脏体比的影响Table 3 Effect of LF on the ratio of viscera in juvenile rats
2.3 补充LF对幼年大鼠股骨BMD和骨微观结构的影响
BMD是反映骨健康的重要标志[31];Tb.N、Tb.Th和Tb.Sp等静力学指标反映单位面积内骨小梁的连接状况和骨微观结构特征,骨的结构越优化,抗骨折能力就越强,这几个指标之间相互联系,密不可分。为了研究补充LF对幼年大鼠BMD和骨微观结构的影响,选取大鼠股骨远端距生长板(骨骺)0.77~3.85 mm的骨组织Mirco-CT扫描分析,如图2(A、B)所示。
根据图2(C)可知,LF低剂量组幼年大鼠BMD与对照组相比无显著差异(P>0.05),而LF中、高剂量组幼年大鼠BMD与对照组相比显著升高(P<0.05),说明中、高剂量LF能够显著增加幼年大鼠BMD,从而增加大鼠骨量。根据图2(D~F)可知,LF低剂量组幼年大鼠Tb.N、Tb.Th和Tb.Sp与对照组相比无显著差异(P>0.05),而LF中、高剂量组Tb.N和Tb.Th与对照组相比显著升高(P<0.05),Th.Sp显著降低(P<0.05),这是因为骨重塑是一种动态平衡过程,补充LF之后,骨吸收减少,骨形成增加,促使骨小梁数量增加,厚度变厚,间距减小,进而达到稳定其平衡的作用[32]。由此说明LF可增加幼年大鼠骨形成,改善骨小梁的微体系结构,减少幼年大鼠的骨吸收。Guo等[33]也证实,饲喂去卵巢大鼠LF可增加骨量,改善骨微结构,防止BMD降低,并增加骨骼机械强度,从而增加骨形成,减少骨吸收。
本研究LF中、高剂量组与对照组相比出现明显的微结构体系差别,LF诱导的BMD增加证实骨重塑空间的下降,说明LF可以促进骨形成和减少骨吸收,推测其作用机制是骨形成大于骨吸收。而本研究中LF低剂量组对骨密度及骨微观结果影响不显著(P>0.05),可能是由于LF需要达到一定的生理浓度才能显著发挥其抑制骨吸收促进骨形成的作用。薛英等[34]也发现,剂量较低的LF对去卵巢大鼠骨形成无显著影响,证实了LF在一定浓度下呈剂量依赖性。
2.4 补充LF对幼年大鼠血清和股骨骨髓组织中TRACP、MMP-9和CTSK水平的影响
骨代谢过程包括骨吸收和骨形成,通过调节OC和OB的数量来维持骨代谢平衡[35],即维持骨吸收和骨形成平衡[36-37]。本研究通过测定幼年大鼠血清和股骨骨髓组织中OC标志物TRACP[38]、MMP-9[39]和CTSK[40]的水平,探究补充LF对幼年大鼠骨代谢的作用。
从图3(A~C)血清结果可以看出,与对照组相比,LF低剂量组、LF中剂量组和LF高剂量组幼年大鼠的TRACP血清水平分别降低11%(P<0.05)、56%(P<0.05)和65%(P<0.05)(图3A),MMP-9分别降低2%(P>0.05)、19%(P<0.05)和23%(P<0.05)(图3B),CTSK分别降低48%(P<0.05)、60%(P<0.05)和67%(P<0.05)(图3C)。
从表4结果可以看出,与对照组比较,LF低剂量组、LF中剂量组和LF高剂量组幼年大鼠股骨骨髓组织中TRACP mRNA相对表达量分别降低14%(P>0.05)、50%(P<0.05)和50%(P<0.05),MMP-9 mRNA相对表达量分别降低23%(P<0.05)、46%(P<0.05)和48%(P<0.05),CTSK mRNA相对表达量分别降低50%(P<0.05)、50%(P<0.05)和50%(P<0.05)。mRNA实验结果与血清结果实验一致,以上结果均表明,中、高剂量LF能显著降低TRACP、MMP-9和CTSK的表达水平。

表4 LF对幼年大鼠股骨骨髓组织中TRACP、MMP-9、CTSK mRNA相对表达量的影响Table 4 Effects of LF on the relative expression of TRACP,MMP-9,CTSK mRNA in the bone marrow tissue of juvenile rats

图2 LF改善后骨微观结构图Fig.2 The micro-architecture of bone after LF supplement注:(A)大鼠股骨远端骨组织;(B)骨小梁三维重建;(C)BMD;(D)Tb.N;(E)Tb.Th;(F)Tb.Sp;不同字母代表组间差异显著(P<0.05);图3~图4、表4~表5同。
TRACP和MMP-9是OC骨吸收过程中重要的骨基质降解酶,显示骨组织代谢中的骨吸收状况[41],且MMP-9能够特异性降解非矿化软骨以及释放细胞外基质结合的血管内皮生长因子,进而直接趋化、活化OC[42],促进OC增殖分化[43],而CTSK是一种降解Ⅰ型胶原蛋白的半胱氨酸蛋白酶,与骨量的调节密切相关[40]。以上三者均在OC中特异性高表达,能客观且准确反映出OC的功能活性,它们的变化直观表明了OC活性。
本研究结果表明,中、高剂量LF能够显著降低幼年大鼠血清和股骨骨髓组织中TRACP、MMP-9、CTSK的水平(P<0.05)。先前的研究指出[34],LF能够抑制OC的增殖分化,说明LF能够降低OC活性,减弱骨吸收水平。在骨吸收过程中,OC特异性高表达TRACP、MMP-9和CTSK[44],进一步证明了补充LF能够降低骨吸收水平,而这一结果可能是通过减少OC增殖分化进而减少OC形成而实现的。
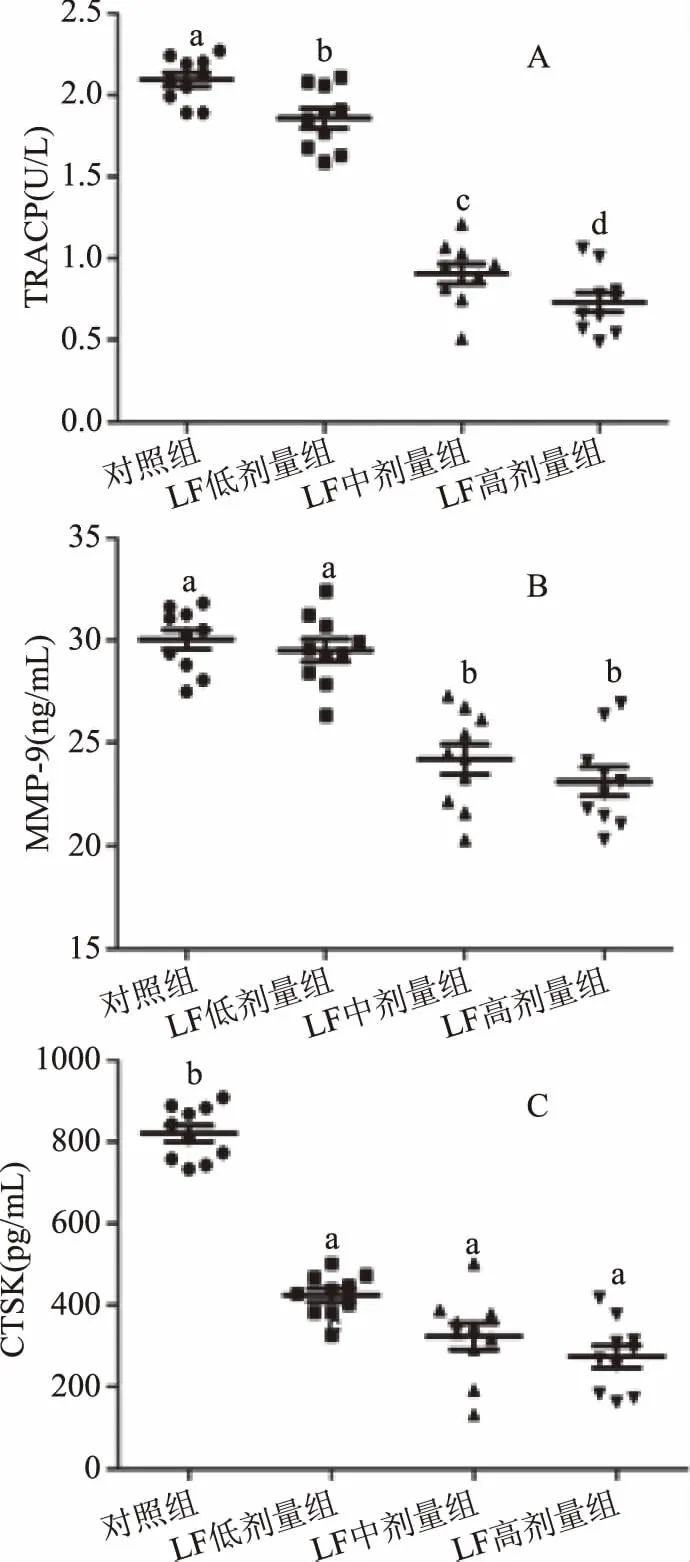
图3 LF对幼年大鼠血清中TRACP、MMP-9、CTSK水平的影响Fig.3 Effects of LF on the levels of TRACP,MMP-9,CTSK in serum of juvenile rats注:(A)LF对幼年大鼠血清中TRACP水平的影响;(B)LF对幼年大鼠血清中MMP-9水平的影响;(C)LF对幼年大鼠血清中CTSK水平的影响。
2.5 补充LF对幼年大鼠血清和股骨骨髓组织中RANKL、OPG和OPG/RANKL水平的影响
RANK/RANKL是参与OC生成的重要信号通路[45-46],OB分泌的OC激活因子RANKL与OC前体细胞表面的RANK结合,促进OC的分化及活性。OPG[47]是一种分泌型糖蛋白,通过与RANKL结合抑制OC产生。当OPG与RANKL竞争性结合时,阻断了RANK与RANKL的结合,减少了OC的形成、分化、存活、活化并诱导OC凋亡,使骨量增加。因此,OPG、RANKL水平与OC的生成密切相关,并最终影响骨代谢平衡。本研究通过测定幼年大鼠血清和股骨骨髓组织中RANKL、OPG和OPG/RANKL的水平,探究补充LF对幼年大鼠骨代谢的作用。
从图4(A~C)结果可以看出,与对照组相比,LF低剂量组、LF中剂量组和LF高剂量组幼年大鼠RANKL血清水平分别降低2%(P>0.05)、22%(P<0.05)和26%(P<0.05)(图4A),OPG分别增加了9%(P>0.05)、23%(P<0.05)和27%(P<0.05)(图4B),OPG/RANKL比值分别增加11%(P>0.05)、58%(P<0.05)和74%(P<0.05)(图4C)。
由表5可知,与对照组比较,LF低剂量组、LF中剂量组和LF高剂量组幼年大鼠股骨骨髓组织RANKL mRNA相对表达量分别降低0%(P>0.05)、50%(P<0.05)和50%(P<0.05),OPG mRNA相对表达量分别增加8%(P>0.05)、83%(P<0.05)和88%(P<0.05)。进一步研究发现,LF低、中、高剂量组幼年大鼠股骨骨髓组织中OPG/RANKL mRNA相对表达量分别增加9%(P>0.05)、151%(P<0.05)和152%(P<0.05)。由本研究结果可知,mRNA实验结果与血清结果实验一致,均表明了补充中、高剂量LF能够显著减少幼年大鼠RANKL表达水平,增加OPG和OPG/RANKL表达水平。
OPG和RANKL的平衡是调节骨形成和骨吸收的重要因素,OPG/RANKL的比值更是评价骨形成与骨吸收动态平衡以及衡量骨量与骨健康的重要标志[31]。本研究结果表明,LF对幼年大鼠血清及股骨骨髓组织中RANKL的表达有抑制作用,对OPG的表达具有促进作用,同时增加OPG/RANKL比值。Fan、肖晖等[48-49]的报道指出,LF可以抑制大鼠RANKL表达,促进OPG的表达,使OPG/RANKL mRNA比率增加。由此推测LF可能通过增加OPG/RANKL比值促进幼年大鼠骨形成,通过OPG/RANKL通路来抑制OC引起的骨吸收,这可能是补充LF对幼年大鼠骨健康促进和防治骨吸收的一个重要机制。除此之外,LF抑制OC的机制还需要进一步的研究和探讨。

图4 LF对幼年大鼠血清中RANKL、OPG和OPG/RANKL水平的影响Fig.4 Effects of LF on the levels of RANKL,OPG and OPG/RANKL in serum of juvenile rats注:(A)LF对幼年大鼠血清中RANKL水平的影响;(B)LF对幼年大鼠血清中OPG水平的影响;(C)LF对幼年大鼠血清中OPG/RANKL水平的影响。
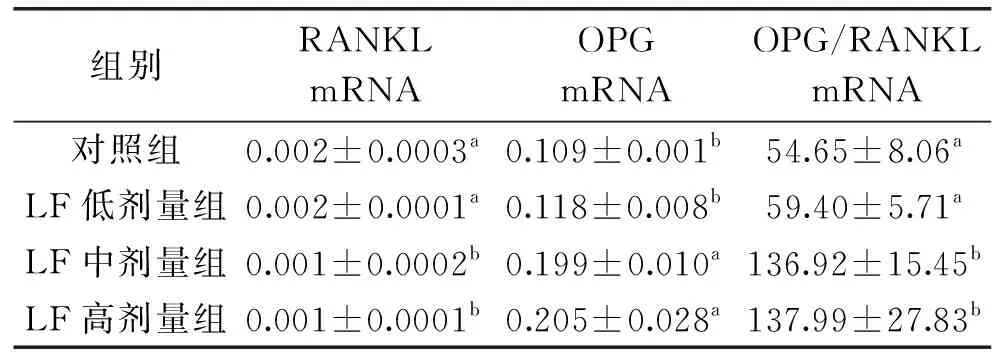
表5 LF对幼年大鼠股骨骨髓组织中RANKL、OPG和OPG/RANKL mRNA相对表达量的影响Table 5 Effects of LF on the relative expression of RANKL,OPG and OPG/RANKL mRNA in the bone marrow tissue of juvenile rats
3 结论
本研究研究结果表明,补充LF后,对幼年大鼠体重及脏体比无显著影响(P>0.05),说明摄入LF不会影响幼年大鼠体重及其重要器官。补充LF后的幼年大鼠BMD、Tb.N和Tb.Th增加,Tb.Sp减少,大鼠血清和股骨骨髓组织中骨吸收标志物TRACP、MMP-9、CTSK的表达水平减少,RANKL的表达水平降低,同时增加了OPG和OPG/RANKL的水平。说明LF可降低幼年大鼠骨吸收,增加骨形成,改善小梁骨的微体系结构,进一步表明LF可能通过提高OPG/RANKL比值增加骨量和减少骨损失,促进骨形成,从而维持骨代谢平衡。本研究中,各组骨吸收与骨形成情况与血清及股骨骨髓组织中相关因子表达水平结果相一致,说明各项指标之间具有良好的相互关联性。本研究为日后在青少年时期提高骨量、促进骨形成,减少佝偻病、骨折等疾病,维护骨健康提供实验基础,为开发青少年骨健康食品提供理论依据。
