不同苦荞茶中芦丁和槲皮素含量测定及二者冲泡溶出率比较研究
2020-08-17,*,2
,*,2
(1.山西振东制药股份有限公司,山西长治 046000;2.山西中医药大学中药与食品工程学院,山西晋中 030600)
苦荞麦(Fagopyrumtataricum(L.)Gaertn)为荞麦属(蓼科)植物,是我国的重要小宗杂粮作物。其蛋白质、脂肪以及多种维生素和矿物质含量普遍高于其他禾谷类作物,营养价值较高,且富含芦丁、槲皮素等黄酮类活性成分[1-3],具有降血糖、降血脂、抗氧化、抗肿瘤等作用[4-9]。利用苦荞麦开发的食品越来越受到消费者喜爱,苦荞茶因食用方便、风味独特,更是倍受青睐。李红梅等[10]将苦荞茶分为米茶型和造粒型两类,分别测定其总黄酮含量,并按照分类进行比较分析。黄艳菲等[11]采用HPLC法测定不同商品苦荞茶中芦丁的含量,结果表明全胚茶中芦丁含量最高。苦荞中的黄酮成分主要是芦丁和槲皮素,同时测定苦荞茶中芦丁和槲皮素的含量更能体现苦荞茶质量[12]。同时,苦荞茶主要被用来冲泡并饮用茶汤,进一步研究苦荞茶经热水冲泡后,其芦丁、槲皮素的溶出率能更加直观反映出消费者通过饮用苦荞茶所摄入芦丁、槲皮素的量[10]。
本文按照四川省地方标准《凉山苦荞茶》将市售14款苦荞茶分为:全麦(胚)苦荞茶和造粒成型苦荞茶两类[13]。全麦(胚)苦荞茶是以苦荞麦为原料,经蒸煮、干燥、碾成米粒状,再烘焙、包装而成的苦荞茶;造粒成型苦荞茶以苦荞麦、苦荞植株全株或不同部分为基本原料,辅以天然食用配料,经筛选、研磨、混合、定型、烘焙、包装而成的苦荞茶[13]。采用HPLC法测定上述14款苦荞茶中芦丁、槲皮素含量[14],并对两类苦荞茶及其冲泡液中芦丁、槲皮素的含量进行研究,以期为消费者选购苦荞茶提供科学依据。
1 材料与方法
1.1 材料与仪器
芦丁 批号100080-201409,纯度91.9%,中国食品药品检定研究院;槲皮素 批号100081-201610,纯度99.1%,中国食品药品检定研究院;甲醇 色谱纯,OCEANPAK;纯水 娃哈哈纯净水;其余试剂均为分析纯;苦荞茶样品 均购于网络旗舰店,见表1。
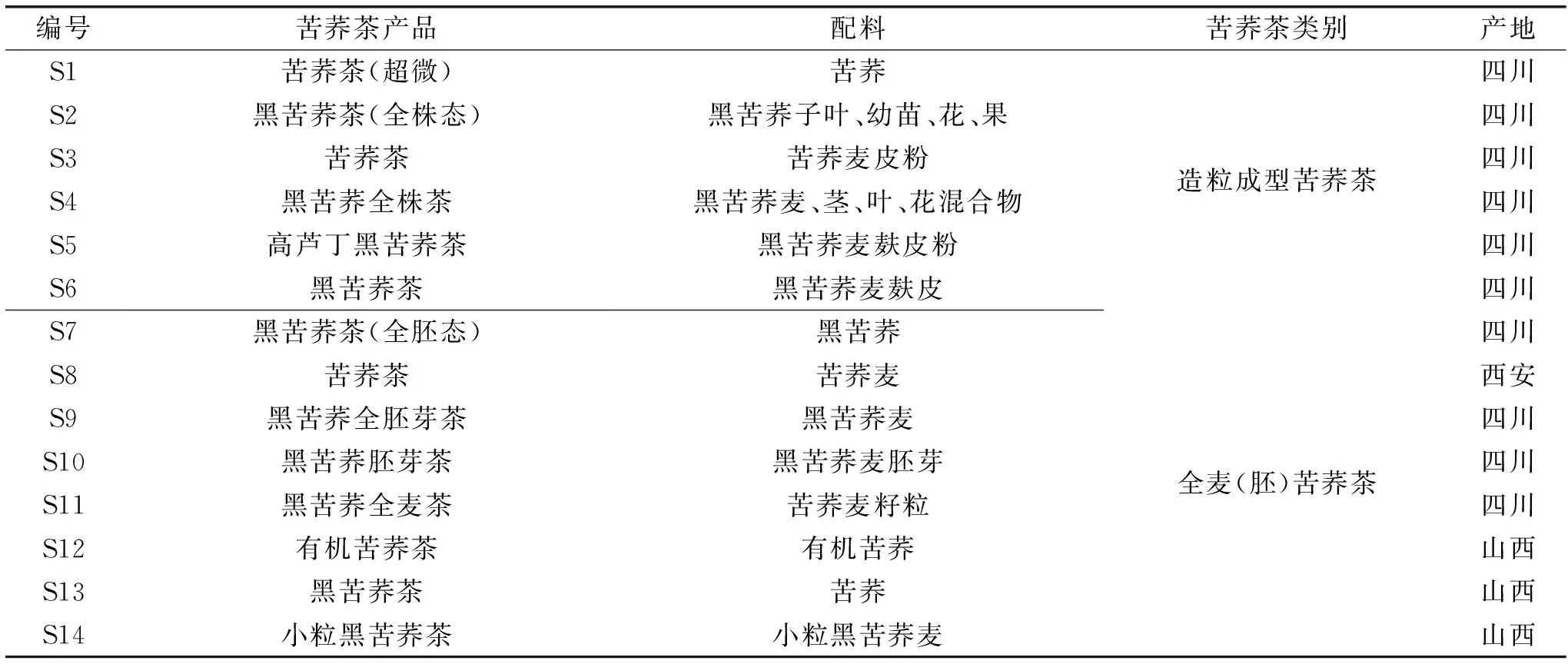
表1 苦荞茶样品Table 1 Tartary buckwheat tea sample
UltiMate 3000高效液相色谱仪 赛默飞世尔科技;CP124C电子天平 奥豪斯仪器(上海)有限公司;EX125ZH电子天平 奥豪斯仪器(常州)有限公司;KQ5200E型超声波清洗机 昆山市超声仪器有限公司;Phenomenex C18色谱柱(250 mm×4.60 mm,5 μm) 天津博纳艾杰尔科技有限公司。
1.2 芦丁、槲皮素含量的测定
1.2.1 溶液的制备 对照品溶液的制备:取芦丁对照品、槲皮素对照品适量,精密称定,加甲醇分别制成每1 mL含芦丁0.1 mg、槲皮素0.02 mg的混合溶液。
供试品溶液的制备:苦荞茶,粉碎(过50目筛)取约1 g,精密称定,置具塞锥形瓶中,加热回流2次,每次精密加入70%甲醇50 mL,回流30 min,摇匀,滤过,合并滤液,置100 mL量瓶中,加70%甲醇至刻度,摇匀,即得。
1.2.2 色谱条件 Phenomenex C18色谱柱(250 mm×4.60 mm,5 μm);以甲醇为流动相A,以0.1%冰醋酸溶液为流动相B,按表2中的条件进行梯度洗脱;流速为1.0 mL·min-1;柱温为30 ℃;检测波长为257 nm。混合对照品溶液、供试品溶液、甲醇溶液各取10 μL注入高效液相色谱仪,记录色谱图。

表2 梯度洗脱条件Table 2 Gradient elution conditions
1.3 方法学考察
1.3.1 线性关系 精密称取芦丁、槲皮素对照品适量,加甲醇溶解,逐级稀释,使其质量浓度芦丁(以芦丁质量浓度计)分别为0.00362、0.00906、0.01812、0.03625、0.18122、0.45307、0.90613 mg·mL-1,槲皮素(以槲皮素浓度计)分别为0.01439、0.02878、0.05756、0.28779、0.71947 mg·mL-1。分别精密吸取10 μL注入高效液相色谱仪,按1.2.2项下色谱条件测定峰面积。
1.3.2 精密度实验 取样品S11,按1.2.1项制备供试品溶液并精密吸取10 μL,连续进样6次,测定峰面积,计算RSD值。
1.3.3 稳定性实验 1.3.2项所制备供试品溶液在0、2、4、6、8、10、12 h分别进样10 μL,测定峰面积,计算RSD值。
1.3.4 重复性实验 取样品S11,按1.2.1项制备供试品溶液5份,分别精密吸取10 μL注入高效液相色谱仪,测定峰面积,并计算样品中芦丁、槲皮素含量的RSD。
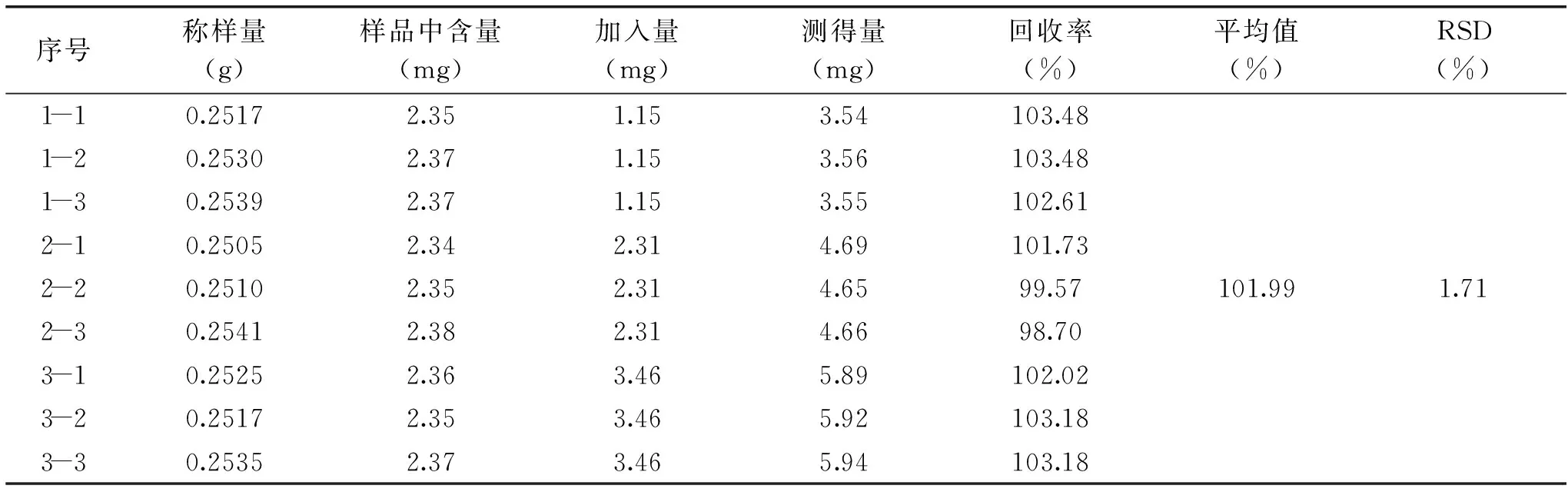
表3 芦丁加样回收率实验结果Table 3 Test result of the rate of rutin recovery
1.3.5 加样回收率实验 称取已知含量的样品S11粉末9份,每份0.25 g,分别精密加入对照品溶液(芦丁质量浓度为1.15 mg·mL-1,槲皮素质量浓度为0.36 mg·mL-1)各1 mL,2 mL,3 mL,每个梯度平行3份,定容到25 mL,按供试品溶液的制备方法制备得供试品溶液。按1.2.2项下色谱条件测定,计算回收率。
1.4 芦丁、槲皮素含量测定
1.4.1 不同苦荞茶中芦丁、槲皮素含量测定 将市售14款苦荞茶按1.2.1中方法制备供试品溶液,按1.2.2项下色谱条件测定。
1.4.2 不同苦荞茶冲泡液中芦丁、槲皮素含量测定 将市售14款苦荞茶分别准确称取2 g,置于烧杯中,向杯中注入100 mL沸水,冲泡5 min,过滤,连续冲泡6次,收集茶汤,合并后计量茶汤体积,作为待测样品,测定其芦丁、槲皮素含量。根据测定结果计算苦荞茶冲泡后芦丁(槲皮素)溶出率及总溶出率。计算公式为:
芦丁(槲皮素)溶出率(%)=冲泡液中芦丁(槲皮素)含量/苦荞茶中芦丁(槲皮素)含量×100
总溶出率(%)=(冲泡液中芦丁含量+冲泡液中槲皮素含量)/(苦荞茶中芦丁含量+苦荞茶中槲皮素含量)×100
1.5 数据处理
实验平行3次,实验数据用平均值±标准差表示。采用SPSS Statistics 22进行数据统计分析和图形绘制,色谱图的叠加和处理,采用中药色谱指纹图谱相似度评价系统(2.0版)。
2 结果与分析
2.1 芦丁、槲皮素含量测定方法学考察
2.1.1 系统适用性试验 按1.2.2色谱条件,取对照品溶液、供试品溶液和溶剂分别进样记录色谱图,见图1。由图1可知,芦丁和槲皮素与杂质峰达到了较好的基线分离,溶剂对其含量测定无影响。供试品溶液中芦丁、槲皮素保留时间分别为6.273、8.820 min,理论塔板数分别为13584、16637,分离度大于10。

图1 对照品溶液(A)、样品溶液(B)及溶剂(C)HPLC色谱图Fig.1 HPLC chromatogram of reference solution(A),sample solution(B)and solvent(C)注:1:芦丁,2:槲皮素。
2.1.2 线性关系 以对照品溶液质量浓度(mg·mL-1)为横坐标,峰面积为纵坐标,绘制标准曲线,得芦丁线性线回归方程:Y=332.91X+0.45(X浓度、Y峰面积,r=0.9996),在0.00362~0.90613 mg·mL-1范围内呈良好线性关系;槲皮素线性线回归方程:y=626.25x+0.51,(x浓度、y峰面积,r=0.9998),在0.01439~0.71947 mg·mL-1范围内呈良好线性关系。
2.1.3 精密度实验 连续进样6次,芦丁峰面积RSD为0.12%,槲皮素峰面积RSD为0.13%,表明仪器精密度良好。
2.1.4 稳定性实验 在0、2、4、6、8、10、12 h分别进样10 μL,芦丁峰面积的RSD为0.69%,槲皮素峰面积的RSD为1.10%,表明供试品溶液在12 h内稳定性良好。

表4 槲皮素加样回收率试验结果Table 4 Test results of the rate of quercetin recovery
2.1.5 重复性实验 精密吸取5份供试品溶液10 μL,进样,测定峰面积,芦丁的质量浓度为9.17 mg·g-1,RSD为1.71%;槲皮素的质量浓度为3.17 mg·g-1,RSD为2.13%。表明方法重复性良好。
2.1.6 加样回收率实验 9份供试品按1.2.2项下色谱条件测定,计算回收率,见表3、表4,芦丁、槲皮素的回收率分别为101.99%、98.37%,RSD分别为1.71%、2.03%。表明建立的方法准确度良好。
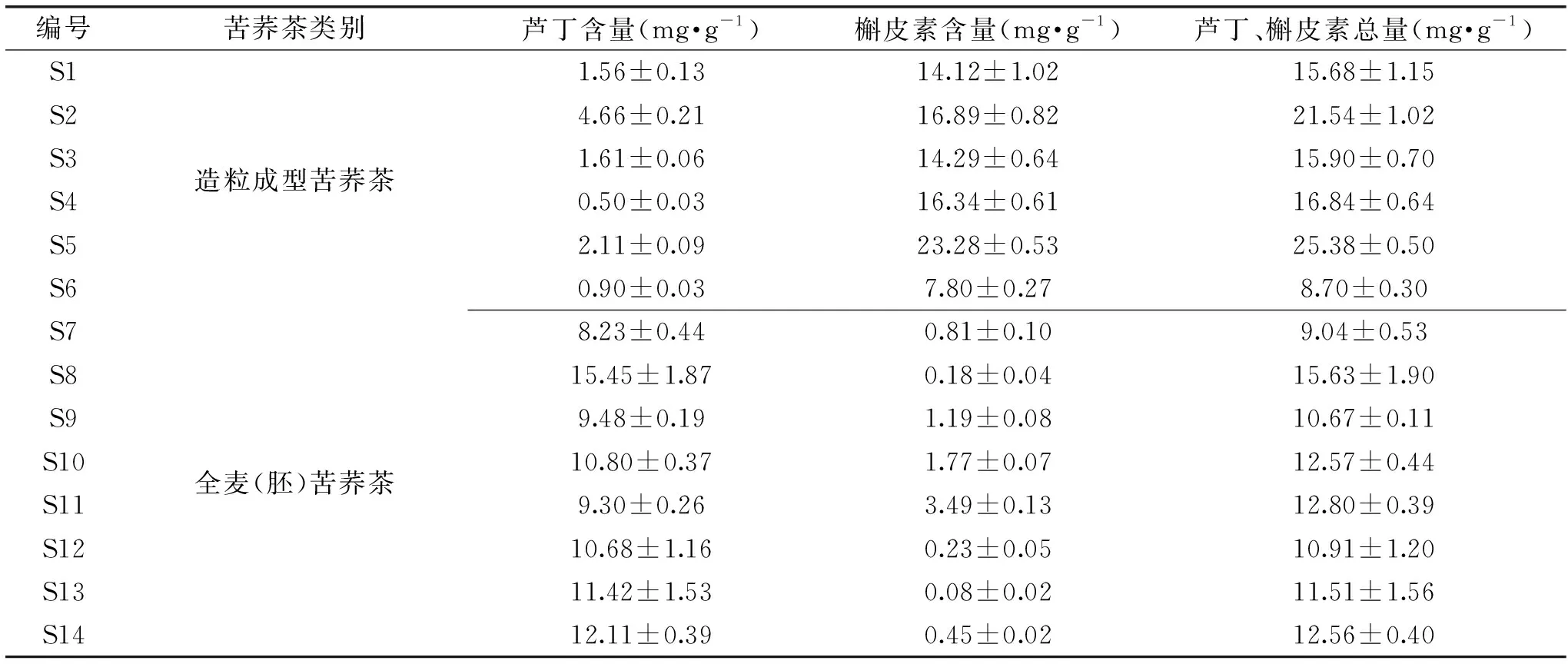
表5 不同苦荞茶样品中芦丁和槲皮素含量测定Table 5 Content of rutin and quercetin in different tartary buckwheat tea
2.2 不同苦荞茶中芦丁、槲皮素含量测定
市售14款苦荞茶中芦丁、槲皮素含量测定结果如表5所示。造粒成型苦荞茶中槲皮素含量较高;而全麦(胚)苦荞茶中芦丁含量较高。造粒成型苦荞茶中芦丁含量较全麦(胚)苦荞茶低,样品S4、S6中芦丁含量不足1.0 mg·g-1,而槲皮素含量和芦丁、槲皮素总量除样品S6外均高于全麦(胚)苦荞茶。全麦(胚)苦荞茶样品S8、S12~S14中,槲皮素含量不足0.5 mg·g-1。
Germ、孙晓静等[15-16]研究发现,苦荞中槲皮素常以苷(即芦丁)的形式存在,造粒成型苦荞茶在制粒的过程中加入水,使芦丁在酶的作用下发生水解生成槲皮素。因此,造粒成型苦荞茶中槲皮素含量较高,而芦丁含量较少。全麦(胚)苦荞茶通过蒸煮工序使酶迅速失活,芦丁水解成槲皮素的量较少,槲皮素含量也较少[17-18]。邵美红等[19-21]研究表明,苦荞叶、花中的总黄酮含量较高,而根、茎、麸皮、种子中的含量较低。造粒成型苦荞茶在制作中,加入了黄酮含量较高的叶、花,故造粒成型苦荞茶产品中的芦丁和槲皮素总量较高。本研究结果与前人研究结果一致。
2.3 不同苦荞茶冲泡液中芦丁、槲皮素含量测定
不同苦荞茶冲泡液中芦丁、槲皮素含量测定结果如表6所示,并结合表5中对应苦荞茶中芦丁、槲皮素含量计算其溶出率。芦丁溶出率可高达102.38%,槲皮素溶出率最高仅27.43%。造粒成型苦荞茶S4冲泡液中未检出芦丁,全麦(胚)苦荞茶S8、S13、S14中槲皮素含量较低,其冲泡液中未检出槲皮素。造粒成型苦荞茶冲泡液中以槲皮素为主,而全麦(胚)苦荞茶冲泡液中以芦丁为主,除S10、S11外,槲皮素含量均不足0.1 mg·g-1。冲泡液中芦丁、槲皮素总量和总溶出率除S11外,全麦(胚)苦荞茶>造粒成型苦荞茶。

表6 不同苦荞茶冲泡液中芦丁和槲皮素含量测定Table 6 Content of rutin and quercetin in brewing solution of different tartary buckwheat tea
由表7结果可知,造粒成型苦荞茶中芦丁、槲皮素总量17.34 mg·g-1,且槲皮素占比达89.10%,其冲泡液中芦丁、槲皮素溶出量分别为0.46、2.83 mg·g-1,总溶出率19.41%。全麦(胚)苦荞茶中芦丁、槲皮素总量11.96 mg·g-1,芦丁占91.39%,其冲泡液中芦丁、槲皮素溶出量分别为7.85、0.09 mg·g-1,总溶出率67.86%。苦荞茶中芦丁、槲皮素总量:造粒成型苦荞茶>全麦(胚)苦荞茶,且差异显著(P<0.05);苦荞茶冲泡液中芦丁、槲皮素总量及总溶出率:造粒成型苦荞茶<全麦(胚)苦荞茶,且差异极显著(P<0.01)。
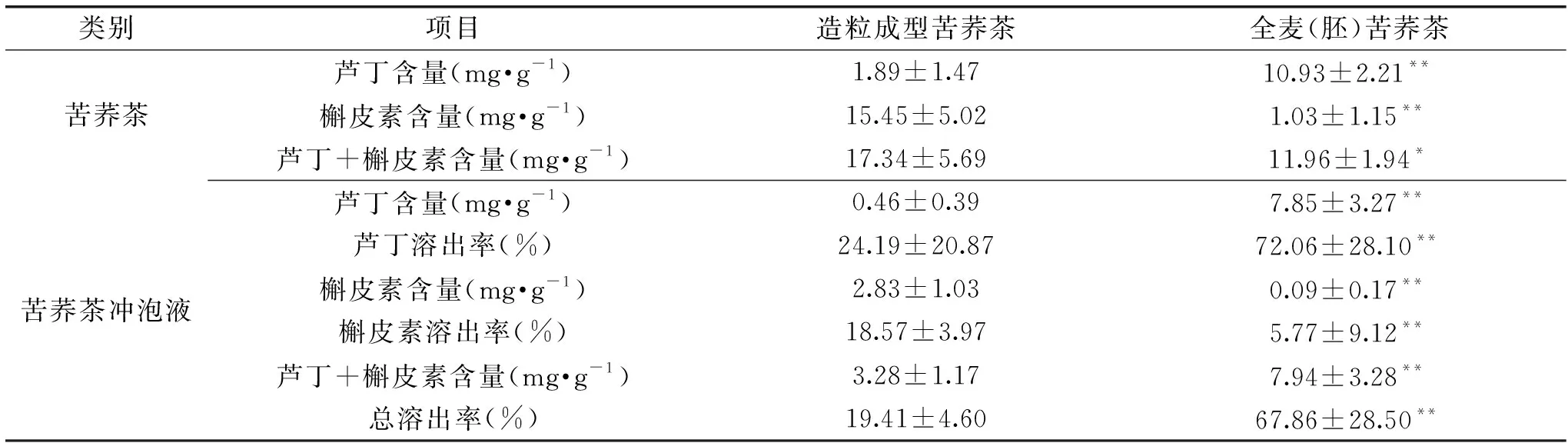
表7 造粒成型苦荞茶和全麦(胚)苦荞茶芦丁、槲皮素含量及溶出率比较Table 7 Comparison of rutin and quercetin contents and dissolution ratein granulated tartary buckwheat tea and whole wheat(embryo)tartary buckwheat tea
不同类型苦荞茶冲泡液中,芦丁、槲皮素的溶出率呈现不同的规律。造粒成型苦荞茶经挤压成型,颗粒较紧实,成分较难溶出,且其含量较高的槲皮素水溶性较差(小于0.1 g/100 mL)[22],故总溶出率较低。而全麦(胚)苦荞茶在加工中会进行膨化处理,籽粒较疏松,且其含量较高的芦丁水溶性优于槲皮素[23-24],故总溶出率较高,结合表6可知,部分产品经多次冲泡后,其芦丁能够完全溶出。
2.4 不同苦荞茶及其冲泡液中芦丁、槲皮素含量的聚类分析
聚类分析是将样品按照品质特性相似程度逐渐聚合在一起,最终按照类别的综合性质多个品种聚合,从而完成聚类分析的过程[25-26]。本文以不同苦荞茶芦丁、槲皮素含量及其冲泡液中芦丁、槲皮素溶出率为指标,采用组间平均数联结法,结合平方Euclidean 距离,对14款苦荞茶进行聚类分析结果见图2。

图2 苦荞茶样品聚类分析树状图Fig.2 Dendrogram of cluster analysis oftartary buckwheat tea samples
由图2可知,14款苦荞茶可分成2类,第一类包括样品S1~S6,为造粒成型苦荞茶,该类样品特征为苦荞茶中芦丁、槲皮素之和较高(平均含量17.34 mg·g-1),其中槲皮素占89.10%;冲泡液中芦丁、槲皮素之和(平均含量3.28 mg·g-1)较低,总溶出率较低(平均溶出率19.41%)。第二类包括样品S7~S14,为全麦(胚)苦荞茶,该类样品特征为苦荞茶中芦丁、槲皮素之和较低(平均含量11.96 mg·g-1),其中芦丁占91.39%;冲泡液中芦丁、槲皮素之和(平均含量7.94 mg·g-1)较高,总溶出率较高(平均溶出率67.86%)。聚类结果将不同苦荞茶按照其芦丁、槲皮素含量和冲泡液中芦丁、槲皮素溶出率的差异性区分开,反映了造粒成型苦荞茶和全麦(胚)苦荞茶之间的差异性。
3 结论
本实验建立HPLC法同时测定苦荞茶及其冲泡液中芦丁和槲皮素的含量,该方法简便快捷,检测结果准确。通过对不同苦荞茶及其冲泡液中芦丁、槲皮素含量的比较得出:造粒成型苦荞茶中芦丁、槲皮素总量显著高于全麦(胚)苦荞茶(P<0.05);但由于造粒成型苦荞茶中芦丁、槲皮素较难溶出,其冲泡液中芦丁、槲皮素总量极显著低于全麦(胚)苦荞茶(P<0.01)。消费者在选择苦荞茶产品时,如仅饮用其冲泡液(即茶汤),选全麦(胚)苦荞茶能够获取更多的芦丁、槲皮素;如在饮用茶汤的同时将茶渣一起食用,选造粒成型苦荞茶能够获取更多的芦丁、槲皮素。
