基于胆酸盐吸附作用的藜麦蛋白质酶解工艺研究
2020-08-17,*,2,*
,*,2,*
(1.成都大学农业农村部杂粮加工重点实验室,四川成都 610106;2.成都大学医学院,四川成都 610106)
藜麦(ChenopodiumquinoaWilld.),又名南美藜、藜谷等,为苋科藜属植物,营养价值高,被誉为“超级谷物”[1]。研究表明藜麦蛋白质平均含量高达15%,高于水稻、大麦和玉米等大多数谷类[2],藜麦蛋白质中氨基酸组成和比例均衡,其蛋白质生物学价值和牛奶相当[3],具有降低胆固醇[4-5]、抑制脂质过氧化[6]和抗氧化[7]等生物活性,近年来作为保健食品被广泛推荐。体内胆固醇含量的升高是引发高脂血症(hyperlipidemia,HLP)的重要原因。胆固醇在体内分解形成胆酸盐,胆酸盐可以被吸附并排出体外,从而促进胆固醇的降解代谢,达到降血脂的目的,大量研究表明对胆酸盐的吸附作用可以有效地反映降血脂活性,大量学者用其作为研究降血脂活性的一个重要指标[8-9]。
藜麦作为一种优质的高蛋白杂粮,目前研究者对藜麦蛋白质的提取方法和基本功能特性等方面进行了大量研究[10-12],对其具有生物活性的多肽研究较少,主要集中在抗氧化肽的制备和分离方面[13-14]。和继刚等[15]采用酸性蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶酶解藜麦蛋白提取液,结果表明木瓜蛋白酶酶解制得抗氧化肽对DPPH自由基清除率高达95.66%。Alice B等[16]采用两种蛋白酶酶解藜麦蛋白质,并研究酶解物体外抑制DPP-IV和抗氧化能力,结果发现,藜麦蛋白质酶解物抑制DPP-IV的能力较好,可能存在潜在的降血糖成分。但是,对具有其他生物活性的藜麦活性肽的酶解工艺、酶解条件优化等研究较少。
有研究发现,酶解法由于其效率高、反应条件温和、处理量大、成本低是制备活性肽最常用的方法[17]。因此,本文以藜麦蛋白质为研究对象,采用不同种类的蛋白酶将其酶解制备藜麦活性肽,以水解度(DH)和体外胆酸盐吸附作用为指标综合评价,筛选出酶解产物水解度(DH)高、胆酸盐吸附作用较好的反应蛋白酶,然后以酶添加量、酶解温度、酶解pH、酶解时间和底物浓度为因素,设计单因素实验和正交试验,优化并得到最佳酶解工艺,制备水解度(DH)较高、胆酸盐吸附作用较好的藜麦活性肽,为藜麦活性肽的深入研究奠定基础,为进一步研究藜麦蛋白质的生物活性功能提供一定的理论基础,以期为藜麦蛋白质及其生物活性肽的产品开发提供参考。
1 材料与方法
1.1 材料与仪器
藜麦种子 成都大学农业农村部杂粮加工重点实验室提供,品种为农藜3号;木瓜蛋白酶(2000 U/mg) 批号MO501A,美仑生物技术有限公司;碱性蛋白酶(10万U/g) 批号M0316A,美仑生物技术有限公司;中性蛋白酶(20万U/g) 批号M0301A,美仑生物技术有限公司;风味酶(20 U/mg) 批号P13D9B77250,源叶生物科技有限公司;牛血清白蛋白 批号170615,如吉生物科技有限公司;G-250考马斯亮蓝 批号2016050101,成都市科龙化工试剂厂;胆酸钠 批号F1112A,美仑生物技术有限公司;牛磺胆酸钠 批号J0421A,美仑生物技术有限公司;正己烷、甲醛、30%过氧化氢、氢氧化钠、盐酸、磷酸、磷酸二氢钾、硫酸、糠醛 以上试剂均为国产分析纯。
SynergyHTX型酶标仪 美国Bio Tek公司;TDL-4A型高速离心机 上海菲恰尔分析仪器有限公司;HH-S型恒温水浴锅 江苏正基仪器有限公司;DF-101S型磁力搅拌器 郑州汇成科工贸有限公司;SCIENTZ-18N型多歧管普通型冷冻干燥机 宁波新芝冻干设备股份有限公司;FE20型PH计 梅特勒-托利多;TGL-16C型离心机 上海安亭科学仪器厂;CHA-S型恒温振荡器 常州澳华仪器有限公司;CPA2250型分析天平 Sartorius。
1.2 实验方法
1.2.1 藜麦蛋白质的提取 采用碱溶酸沉法提取藜麦蛋白质。参照文献[12]的方法,略有改动。

藜麦用温水洗涤3次以除去皂苷,45 ℃烘干至水分含量(10%±1%)。将烘干后的藜麦粉碎过80目筛,用正己烷脱脂(藜麦粉:正己烷=1∶5 (v/v)),室温下搅拌1 h后抽滤,重复2次,抽滤后的藜麦粉挥发12 h以去除残留的正己烷。脱脂藜麦粉按料水比1∶12,pH=11.0(用0.1 mol/L氢氧化钠溶液调节)、温度45 ℃的条件下搅拌提取3 h,提取过程隔30 min检测一次提取液pH,若pH不为11.0,则用氢氧化钠溶液调节pH至11.0。浸提后的产物4000 r/min离心30 min,收集上清液,之后在相同条件下进行第2次浸提,合并2次上清液并用稀盐酸调节pH至4.5,静置30 min后3000 r/min离心20 min,收集沉淀,用去离子水洗涤2次除去可溶性盐后调节pH至7.0,沉淀冷冻干燥得到藜麦粗蛋白质。
1.2.2 藜麦蛋白质酶解工艺 分别按照风味蛋白酶、木瓜蛋白酶、中性蛋白酶和碱性蛋白酶的常见酶解条件对藜麦蛋白质进行酶解,不同蛋白酶酶解的用量及反应条件见表1,以酶解度(DH)和胆酸盐吸附作用为指标,筛选出对藜麦蛋白质酶解效果较好的蛋白酶作为后续试验的蛋白酶。精密称取藜麦蛋白质400.00 mg于100 mL锥形瓶中,加蒸馏水配制成2%的藜麦蛋白质溶液,用0.1 mol/L NaOH或稀盐酸溶液调节至添加酶的酶解反应pH,放入预先设定好蛋白酶反应温度的水浴锅中孵育,加入蛋白酶,每隔30 min测定酶解液的pH,并用0.1 mol/L NaOH或稀盐酸溶液调节pH,使酶解液的pH始终基本保持在蛋白酶的酶解反应pH。酶解反应完成后放入95 ℃水浴锅中灭活10 min,取出放冷,调节pH至7.0,8000 r/min离心10 min除去尚未溶解的酶及沉淀物,收集上清液置4 ℃冰箱保存备用。

表1 不同蛋白酶酶解的用量及反应条件Table 1 Dosage and reaction conditions ofenzymatic hydrolysis of different kinds of proteases
1.2.3 酶解单因素实验 根据1.2.2的实验结果,选择酶解效果较好的风味蛋白酶,以水解度(DH)和体外胆酸盐吸附作用为评价指标,在其他条件固定为pH6.0,酶添加量5000 U/g,酶解时间2 h,底物浓度2%,酶解温度50 ℃的条件下,按1.2.2操作分别考察pH(5.0、6.0、7.0、8.0、9.0)、酶添加量(1000、2000、3000、4000、5000、6000 U/g)、酶解时间(1、1.5、2、2.5、3 h)、底物浓度(1%、2%、3%、4%、5%)和酶解温度(40、45、50、55、60 ℃)对藜麦蛋白质酶解效果的影响。
1.2.4 正交试验 由1.2.3单因素实验所得结果,选取对水解度(DH)和胆酸盐吸附作用影响较大的4个因素:酶解pH、酶添加量、底物浓度、酶解温度,以胆酸盐吸附作用为指标,设计L9(34)正交试验,优化酶解工艺,正交试验因素水平见表2。
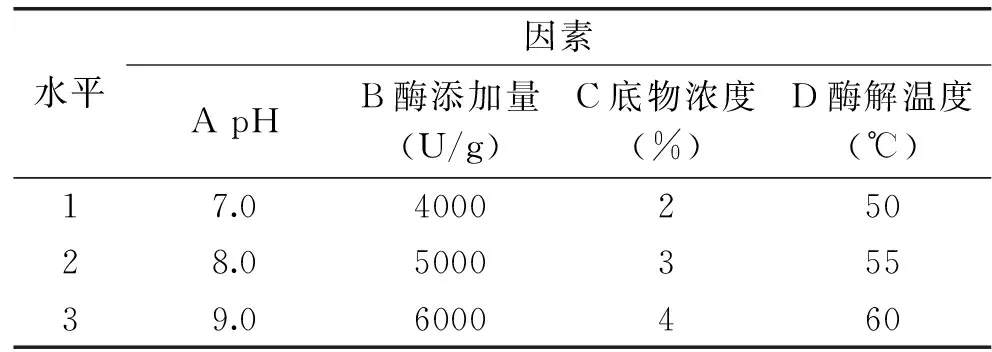
表2 L9(34)正交试验因素与水平Table 2 Factors and levels of L9(34)orthogonal experiment
1.2.5 验证实验 根据正交试验结果分析得到的最佳酶解条件做三次平行验证实验,验证正交试验结果的准确性,同时与未酶解的藜麦蛋白质吸附胆酸盐的作用做对比研究,验证使用蛋白酶酶解藜麦蛋白质制备具有胆酸盐吸附作用的生物活性肽的科学性。
1.2.6 指标检测方法
1.2.6.1 蛋白质含量和水解度的测定 藜麦蛋白质含量测定:考马斯亮蓝法[18-19];水解度的测定:甲醛滴定法[20]。
1.2.6.2 胆酸盐标准曲线的制作 体外胆酸盐吸附作用测定:糠醛比色法。参照文献[21]的方法,略有改动。
精密称取牛磺胆酸钠、胆酸钠各200 mg置于50 mL容量瓶中,以蒸馏水溶解并定容至刻度分别配制成4 mg/mL的牛磺胆酸钠、胆酸钠溶液。分别移取4 mg/mL的牛磺胆酸钠、胆酸钠溶液0、0.1、0.2、0.4、0.8、1.0 mL于具塞试管中,用蒸馏水补足体积为1.0 mL。分别加入45%的硫酸6 mL,混匀,再加入0.3%的糠醛1 mL,混匀,置于65 ℃恒温水浴锅中反应30 min,取出冷却至室温,于620 nm波长处测吸光度值,以胆酸盐浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
1.2.6.3 胆酸盐吸附作用的测定 分别移取4 mg/mL的牛磺胆酸钠、胆酸钠溶液各8 mL于100 mL锥形瓶中,分别加入藜麦蛋白质酶解液2 mL,于37 ℃恒温下振荡反应60 min,再5000 r/min离心10 min。分别取离心后的样液和胆酸盐空白溶液各1 mL,加入45%的硫酸6 mL,混匀,再加入0.3%的糠醛1 mL,混匀,置65 ℃恒温水浴锅中反应30 min,取出冷却至室温,测定在620 nm波长处的吸光度值,由标准曲线求得样液中胆酸盐的浓度,以所加入胆酸盐的浓度减去样液中胆酸盐的浓度即为被藜麦蛋白质酶解物结合了的胆酸盐的浓度,从而计算藜麦蛋白质酶解物对胆酸盐的吸附作用。
1.3 数据处理
2 结果与分析
2.1 藜麦粗蛋白质粉蛋白质含量测定
根据1.2.6.1所述的蛋白质含量测定方法,以牛血清白蛋白浓度(μg/mL)为横坐标,于595 nm处测定OD值为纵坐标,绘制标准曲线,得出回归方程为y=0.003x-0.0066,R2=0.9995。提取得到的藜麦粗蛋白粉蛋白质含量为68.22%±3.19%,n=5。
2.2 胆酸钠、牛磺胆酸钠标准曲线的制作
根据1.2.6.2所述的胆酸钠、牛磺胆酸钠标准曲线制作方法,分别以胆酸钠、牛磺胆酸钠浓度(mg/mL)为横坐标,于620 nm处测定吸光度A值为纵坐标,绘制标准曲线,胆酸钠回归方程为:y=2.7907x+0.0214,R2=0.9951;牛磺胆酸钠回归方程为:y=2.752x-0.015,R2=0.9974,结果表明在0~0.5 mg/mL浓度范围内,胆酸钠、牛磺胆酸钠线性关系良好。
2.3 酶解工艺优化试验结果
2.3.1 不同蛋白酶酶解效果的比较 由图1可以看出,风味蛋白酶酶解藜麦蛋白质的水解度(DH)最高,显著高于其他3种蛋白酶(P<0.05),达到28.04%±0.99%;除木瓜蛋白酶外,其他3种蛋白酶酶解获得的活性肽对牛磺胆酸钠均显示出较好的吸附作用,风味蛋白酶酶解获得的活性肽对胆酸钠的吸附作用显著高于其他蛋白酶(P<0.05)。蛋白酶具有底物专一性,不同蛋白酶的作用位点不同,其酶解产物的组成和特性也有所差别[22],所以不同蛋白酶酶解获得的活性肽吸附胆酸盐的作用也不同。其中,风味蛋白酶酶解获得的活性肽吸附胆酸盐的量最高,达(3.10±0.36) mg/mL。因此选用风味蛋白酶进行后续酶解工艺优化试验。

图1 各蛋白酶酶解效果比较Fig.1 The comparison of enzymatic hydrolysiseffects of various proteases注:相同指标标有不同小写字母为差异显著(P<0.05);图2~图6同。
2.3.2 不同pH对酶解效果的影响 由图2可以看出,水解度(DH)先随pH的上升而逐渐升高,在pH=6.0时到达到峰值为30.60%±0.74%,之后随着pH的升高有所下降。吸附牛磺胆酸钠的量随着pH的升高而逐渐升高,吸附胆酸钠的量在pH=7.0时达到最大值,说明在不同pH条件下酶解获得的活性肽吸附不同胆酸盐的能力不同;当pH=8.0时,酶解获得的活性肽吸附胆酸盐的总量最高,达到(4.41±0.32) mg/mL。因此选择pH范围为7.0~9.0进行正交试验作进一步优化。
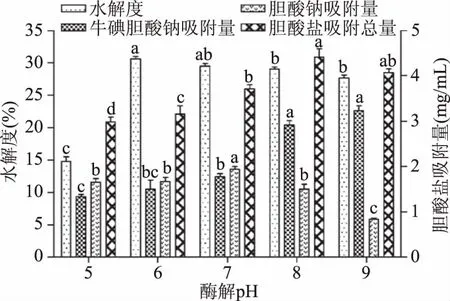
图2 不同初始pH对DH和胆酸盐吸附作用的影响Fig.2 Effect of different initial pHon DH and cholate adsorption
2.3.3 酶添加量对酶解效果的影响 由图3可以看出,水解度(DH)随着酶添加量的升高而不断升高,其中在酶添加量为1000~3000 U/g时增长速率较快,至3000 U/g后增长速率减缓并趋于平稳。胆酸盐吸附作用和DH变化趋势基本一致,随着酶添加量的升高而不断增加,至6000 U/g时吸附胆酸盐总量达到最大值(5.05±0.76) mg/mL。由此可知,底物浓度充分的情况下,酶添加量的增加可使蛋白酶分子与底物碰撞的几率增大,提升与底物结合的效率[23],酶解的效果更好,进而使底物变为具有胆酸盐吸附作用的活性肽的几率增加。当酶添加量增加到一定程度,超过酶的最适浓度时,酶添加量的增加反而会使酶与底物的接触困难,此时若再添加蛋白酶对溶液的反应速率及DH的提升不大,导致成本的上升[24]。因此选择酶添加量范围为4000~6000 U/g作正交试验进一步优化。

图3 酶添加量对DH和胆酸盐吸附作用的影响Fig.3 Effect of enzyme additionon DH and cholate adsorption
2.3.4 酶解时间对酶解效果的影响 由图4可以看出,水解度(DH)随着酶解时间的延长表现出不同的增长趋势,在1.5 h前增速较快,1.5 h后增速较慢,在2.5 h后基本趋于平稳。随着酶解时间的不断延长,胆酸盐吸附作用和DH表现出一致的增长速率,在2 h前,酶解获得的活性肽吸附胆酸盐的作用不断增强,2 h后趋于平稳。可能是由于刚开始酶解时蛋白酶的活力很好,随着酶解时间的延长,酶的活力逐渐降低[25],且随着酶解时间的延长,酶解反应基本达到饱和,使得水解度(DH)变化趋于稳定,同时酶解液中的短肽的数量及组成不再迅速改变,吸附胆酸盐的量也就趋于稳定。但总体来看,酶解时间对DH和胆酸盐的吸附作用影响没有其他4个因素大,故直接选择酶解时间为2 h,未再进行优化。

图4 酶解时间对DH和胆酸盐吸附作用的影响Fig.4 Effect of enzymatic hydrolysis timeon DH and cholate adsorption
2.3.5 底物浓度对酶解效果的影响 由图5可以看出,水解度(DH)随着底物浓度的增加而不断降低,在该酶添加量条件下,加入的酶与底物全部结合发生酶解反应,随着底物浓度的增加,能和底物结合的酶却没有增加,酶解物的水解度(DH)降低;还可能是当底物浓度过高时,底物与蛋白酶之间发生了竞争性抑制[26],导致水解度(DH)反而下降。随着底物浓度的增加,藜麦蛋白质酶解获得的活性肽吸附牛磺胆酸钠和胆酸钠的作用均先增加后降低,在底物浓度为3%时对胆酸盐的吸附作用达到最大值(4.83±0.13) mg/mL。可能是藜麦蛋白质本身对于胆酸盐也有吸附作用,未酶解的藜麦蛋白质吸附了部分胆酸盐;当底物浓度过大,未酶解的蛋白质对胆酸盐的吸附达到最大值,同时随着底物浓度的增大,酶浓度降低,使得酶促反应速度下降,酶解产生活性肽的速度减慢,对胆酸盐的吸附作用降低[27]。因此选择底物浓度范围为2%~4%作正交试验进一步优化。
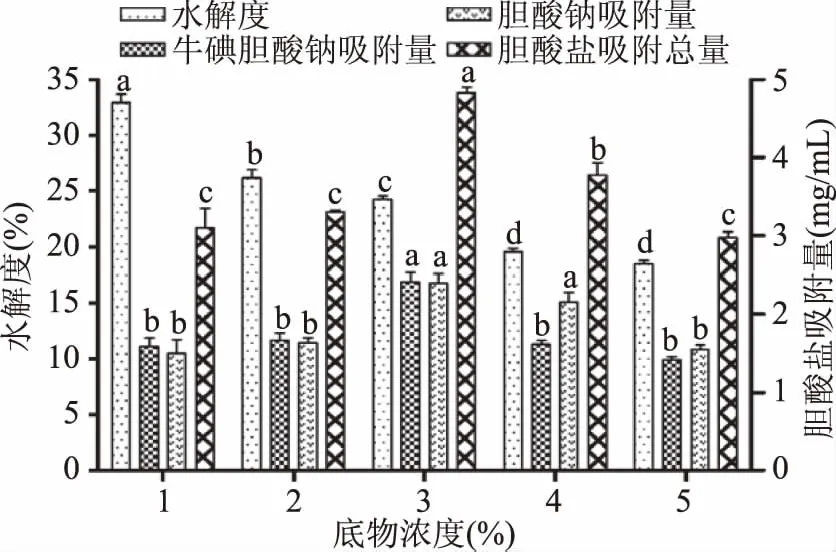
图5 底物浓度对DH和胆酸盐吸附作用的影响Fig.5 Effect of substrate concentrationon DH and cholate adsorption
2.3.6 酶解温度对酶解效果的影响 由图6可以看出,随着酶解温度的增加,水解度(DH)、胆酸盐吸附量均表现先缓慢增加后降低的趋势,温度为55 ℃时,DH出现最大值为27.31%±0.37%,胆酸盐吸附量出现最大值(4.81±0.37) mg/mL,当酶解温度升高至60 ℃时,水解度(DH)和胆酸盐吸附量均开始下降。可能是当温度超过蛋白酶的最适温度时,酶的空间结构被改变,蛋白酶逐渐变性而丧失催化活性使得酶解反应变缓,酶解产生的活性肽减少,从而水解度(DH)和胆酸盐吸附量降低。因此选择温度范围为50~60 ℃进行正交试验作进一步优化。
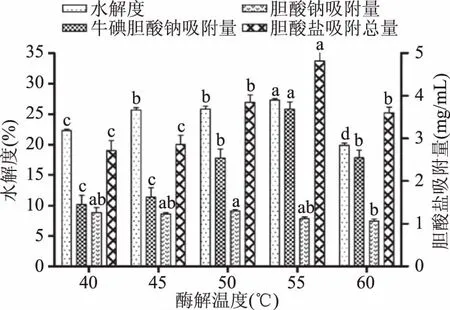
图6 酶解温度对DH和胆酸盐吸附作用的影响Fig.6 Effect of hydrolysis temperatureon DH and cholate adsorption
2.3.7 正交试验结果 由单因素实验结果分析,选取对水解度(DH)和胆酸盐吸附作用影响较大的4个因素:酶解pH、酶添加量、底物浓度、酶解温度,以胆酸盐吸附作用为指标,设计L9(34)正交试验,优化酶解工艺,正交试验结果见表3。
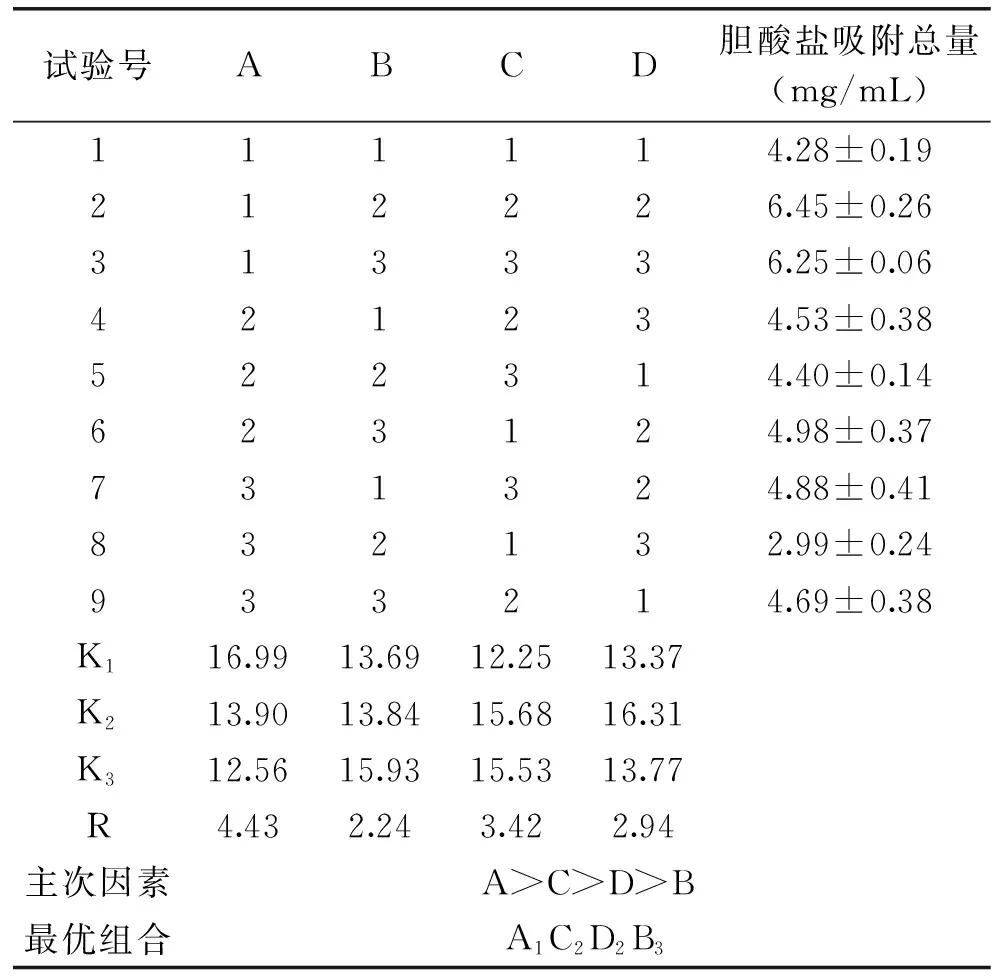
表3 正交试验结果Table 3 Results of orthogonal experiment
由表3、表4可知,各因素对藜麦蛋白质酶解获得的活性肽吸附胆酸盐作用的影响程度为A>C>D>B,即pH>底物浓度>酶解温度>加酶量,其中pH对活性肽吸附胆酸盐作用的影响最为显著,因此酶解最优工艺为A1C2D2B3,即酶解pH7.0,底物浓度3%,酶解温度55 ℃、酶添加量为6000 U/g。
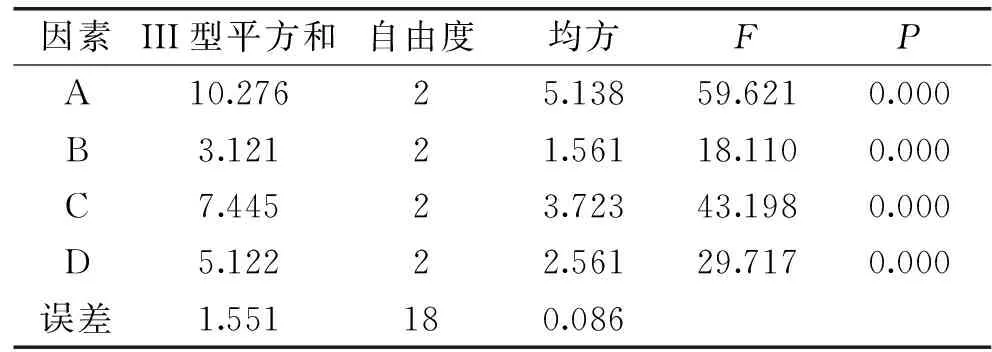
表4 正交实验方差分析Table 4 Orthogonal experimental analysis of variance
2.3.8 验证实验结果 根据正交试验结果分析得到的最佳酶解条件做三次平行验证实验,同时与未酶解的藜麦蛋白质吸附胆酸盐的作用做对比研究,结果表明,最优组合A1C2D2B3酶解获得的活性肽,水解度(DH)为38.22%±0.65%,吸附胆酸钠的量为(3.01±0.16) mg/mL,吸附牛磺胆酸钠的量为(4.55±0.20) mg/mL,吸附胆酸盐的总量为(7.56±0.11) mg/mL,高于正交试验最优值(6.45±0.26) mg/mL,表明该酶解工艺合理可行;与未酶解的藜麦蛋白质吸附胆酸盐的总量(4.63±0.36) mg/mL相比提高了63.28%,差异极显著(P<0.01)。由此,表明此酶解工艺科学合理,使用蛋白酶酶解藜麦蛋白质制备具有胆酸盐吸附作用的生物活性肽具有一定的研究价值。结合单因素实验所得最佳酶解时间2 h,故风味酶酶解藜麦蛋白质制备活性肽的最佳酶解工艺为:酶解pH7.0,底物浓度3%,酶解温度55 ℃、酶添加量为6000 U/g,酶解时间2 h。
3 结论
风味蛋白酶对藜麦蛋白质的酶解效果较好,最佳酶解工艺为酶解pH7.0,酶解温度55 ℃,酶添加量6000 U/g,底物浓度3%,酶解时间2 h。在最优酶解条件下,水解度(DH)为38.22%±0.65%,活性肽吸附胆酸盐的总量达到(7.56±0.11) mg/mL,比未酶解的藜麦蛋白质吸附胆酸盐的总量提高了63.28%,这一结果显示,风味蛋白酶酶解藜麦蛋白质获得的活性肽具有较好的胆酸盐吸附作用,为藜麦蛋白质及其活性肽的研究提供了思路,也为藜麦蛋白质及其活性肽产品的开发提供了参考。同时有关藜麦降血脂活性肽的分离纯化、结构解析和其他药理学活性等还需进一步研究。
