添加红枣汁对植物乳杆菌发酵胡萝卜品质的影响
2020-08-17,*
,*
(1.郑州轻工业大学食品与生物工程学院,河南郑州 450002;2.食品生产与安全河南省协同创新中心,河南郑州 450002;3.河南省冷链食品质量安全控制重点实验室,河南郑州 450002)
胡萝卜,又称红萝卜或甘荀。胡萝卜中含有丰富的功能性活性物质,如β-胡萝卜素不仅有维生素A源之称,而且具有很强的抗氧化作用,还能起到抗炎、协调免疫因子、改善呼吸功能的作用[1-4];多糖作为胡萝卜中主要的活性成分之一,已被证实具有多种生理功能包括抗氧化、抗炎活性、降血糖、预防酒精肝损伤[5-7]等。红枣是中国特有的药食两用果品,是养胃健脾、养血生津和滋补强身的首选食材。
植物乳杆菌是一种被广泛用于果蔬发酵中的乳酸菌[8-9],其发酵可以改善果蔬的风味,降解蔬菜发酵过程中产生的亚硝酸盐[10],释放果蔬中的酚类物质提高生物利用率,增强抗氧化能力;乳酸菌发酵可以合成多种维生素,调节新陈代谢[11]。卢沿钢[12]以胭脂萝卜为原料,以最佳菌株配比植物乳杆菌∶短乳杆菌∶肠膜明串珠菌=2∶1∶1 (v/v)为发酵剂,确定了胭脂萝卜泡菜的最佳工艺为接种量5%,发酵温度32 ℃,食盐浓度4.5%,糖添加量2%。Alanl[13]研究了植物乳杆菌、戊糖乳杆菌等发酵剂对传统腌制小黄瓜发酵过程的影响,结果表明,用植物乳杆菌发酵的泡菜效果较好。随着果蔬深加工技术的进一步发展,以及人们对益生菌发酵果蔬产品认识的不断深入,关于益生菌发酵果蔬汁饮料和果蔬酱料的研究报道也不断增多。Costa等[14]研究了添加低聚果糖或抗坏血酸对副干酪乳杆菌活力的影响,结果表明低聚果糖含量保持在1.65~1.68 g/100 mL时,可研发一款富含低聚果糖的益生橙汁。Xu等[15]用富硒的益生菌发酵橙、胡萝卜、苹果和红枣的混合汁,通过研究化学成分和风味物质的变化,研发出一款富硒发酵饮料。Zhao等[16]通过乳酸菌混合发酵提高了酸枣汁的品质,同时也表明了枣汁是一种很适合乳酸菌生长的基质。张丽华等[17]的研究表明乳酸菌发酵对红枣汁贮藏品质会有一定的改善,这表明枣将成为一种未来新型益生菌食品的配方成分。
目前,胡萝卜的发酵主要集中在泡菜[18-19]、胡萝卜汁[20-22]、胡萝卜粉[23]等产品而添加红枣汁来改善发酵胡萝卜品质的研究鲜少报道。本文研究了添加红枣汁对益生菌发酵胡萝卜片的理化特性和营养成分的影响,旨在为生产功能性发酵蔬菜提供理论参考。
1 材料与方法
1.1 材料与仪器
胡萝卜 市售;红枣品种为“灰枣” 好想你枣业股份有限公司;植物乳杆菌(Lactobacillusplantarum)(GIM1.191) 广东省微生物菌种保藏中心;MRS琼脂培养基、MRS肉汤培养基 北京奥博星生物技术有限责任公司;没食子酸、红菲咯啉(BP) 上海晶纯生化科技股份有限公司;福林-酚试剂 北京索莱宝科技有限公司;氢氧化钠、无水碳酸钠、三氯乙酸(TCA)、三氯化铁 天津大茂化学试剂厂;无水乙醇、磷酸、石油醚 天津市富宇精细化工有限公司;浓硫酸 洛阳昊华化学试剂有限公司;葡萄糖、抗坏血酸 天津市瑞金特化学品有限公司。
SW-CJ-IBV型超净工作台 上海浦东荣丰科学仪器有限公司;SC-80C型全自动色彩色差计 北京康光光学仪器有限公司;AL204型电子天平 瑞士梅特勒-托利多仪器有限公司;BC/BD-429H型冰柜 青岛海尔股份有限公司;HC-3618R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;PAL-1数显折光糖度仪 日本Atago公司;FE28型pH计 瑞士梅特勒-托利多仪器有限公司;BPH-9272型精密恒温培养箱 上海一恒科学仪器有限公司;HH-S4型恒温水浴锅 金坛市医疗仪器厂;LDZX-50KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司;GDYQ-100M多参数食品安全快速分析仪 长春吉大·小天鹅仪器有限公司;TA-XT Plus型物性分析仪 英国Stable Micro Systems公司。
1.2 实验方法
1.2.1 样品前处理 将胡萝卜清洗后,切成厚度为0.4 cm的扇形,90 ℃热烫15 s,捞出沥水后,备用。红枣经清洗、去核后,切成小块,按照料液比1∶8 (g/mL)进行打浆,双层纱布过滤3次得到枣汁,备用。
1.2.2 植物乳杆菌发酵胡萝卜的工艺
1.2.2.1 植物乳杆菌的活化与扩大培养 将甘油中保藏的植物乳杆菌接种到灭菌后的MRS液体培养基中,在37 ℃条件下进行活化培养48 h,连续活化2次,将所得菌液离心(4 ℃,5000 r/min,10 min),倒掉上层培养基,用无菌水将沉淀洗2~3次后得到菌泥,再将其转入无菌水中振荡均匀,活菌数可达到1.7×109CFU/mL,备用。
1.2.2.2 胡萝卜的发酵处理 对照组:将配好的糖盐溶液(糖度为10%(m/v),盐1%(m/v))于121 ℃灭菌20 min后,冷却,在无菌条件下,按1∶1 (m/v)的比例加入处理好的胡萝卜片。在37 ℃条件下发酵时间7 d,每天取样进行各项指标的检测。
植物乳杆菌发酵组(LP组):将配好的糖盐溶液(糖度为10%(m/v),盐1%(m/v))于121 ℃灭菌20 min后,冷却,在无菌条件下,接入4%(v/v)植物乳杆菌,然后再以1∶1 (m/v)的比例加入处理好的胡萝卜片。在37 ℃条件下发酵时间7 d,每天取样进行各项指标的检测。
红枣汁+植物乳杆菌发酵组(LP+Z组):调整枣汁的糖和盐含量与上述两组相同,80 ℃灭菌30 min,冷却,在无菌条件下,接入4%(v/v)植物乳杆菌,然后再以1∶1 (m/v)的比例加入处理好的胡萝卜片。在37 ℃条件下发酵时间7 d,每天取样进行各项指标的检测。
1.2.3 质构的测定 采用TA-XT Plus型物性分析仪测定。取发酵后胡萝卜片的外围部分进行测量,TPA测试用P/36探头,设定触发力(target force)5 g,压缩时下压样品变形量(strain)50%,测试前探头下降速度(pre-test speed)为1.00 mm/sec,测试速度(test speed)为1.00 mm/sec,测试后探头回程速度(post-test speed)为5 mm/sec,两次压缩之间时间间隔(time)为5.00 sec,由质构特征曲线得到的硬度、粘附性、弹性、内聚性和咀嚼性等指标值。
1.2.4 色差的测定 采用全自动色彩色差计测定胡萝卜片的明亮度(L*值)和绿/黄值(a*正值表示红色,a*负值表示绿色;b*正值表示黄色,b*负值表示蓝色)。取发酵后胡萝卜片的外围部分进行测量。
1.2.5 pH的测定 移取50 mL发酵液,采用pH计直接测定。
1.2.6 总酸的测定 参照GB/T 12456-2008《食品中总酸的测定》[24]的方法测定总酸含量。取大于10 g发酵后的胡萝卜片研碎,备用。称取研碎的10 g试样于烧杯,用约80 ℃煮沸过的水将内容物转移到250 mL容量瓶中,置于沸水浴煮沸30 min,取出,冷却至室温,用煮沸过的水定容到250 mL,滤纸过滤得到试液体,用于测定。称取25 g过滤后的试液,置于250 mL三角瓶中加50 mL水,用0.05 mol/L氢氧化钠滴定。
总酸含量以X计,数值以克每100克(g/100 g)按下式计算:
式中:C为氢氧化钠浓度/(mol/L);V1为滴定时所消耗的NaOH标准溶液体积/mL;V0为空白消耗氢氧化钠的体积/mL;K为乳酸换算系数,0.09;F为试液稀释倍数;m为试样的质量/g。
1.2.7 亚硝酸盐含量的测定 采用GDYQ-100M多参数食品安全快速分析仪和附带的亚硝酸盐试剂盒测定亚硝酸盐的含量。取发酵后的胡萝卜片匀浆,准确称取1.00 g至100 mL提取瓶,按试剂盒提供的方法进行测定,单位以(mg/kg)表示,每个样品重复三次。
1.2.8 总酚含量的测定 采用福林-酚比色法测定[25]稍加修改。标准曲线的绘制:配制浓度为0.1 mg/mL没食子酸标准溶液,依次吸取0,0.05,0.1,0.15,0.2,0.25,0.3,0.35,0.4,0.45,0.5 mL的没食子酸标准溶液到10 mL试管中加去离子水定容至5 mL,先加1 mL的福林酚试剂,摇匀放置1 min,再加入1.5 mL的20% NaCO3溶液,摇匀后室温下避光放置2 h,在760 nm处测吸光度,绘制标准曲线Y=19.549X-0.00005(R2=0.9993)。
样品的测定:取10 g发酵后的胡萝卜片,60 ℃下用无水乙醇提取30 min后用蒸馏水定容到50 mL容量瓶,过滤取上清液0.8 mL,然后按照标准曲线方法加入试剂测定吸光度,每个样品重复三次。带入标准曲线,计算总酚含量,以每克胡萝卜中含有相当于没食子酸的毫克数来表示(mg/g)。
1.2.9 乳酸菌活菌数测定 量取发酵液1 mL,采用稀释涂布平板法进行菌落计数。具体原理和步骤参考GB 4789.35-2016 《食品安全国家标准 食品微生物学检验 乳酸菌检验》[26]。
1.2.10 多糖含量的测定 参照SN/T4260-2015《出口植物源食品中粗多糖的测定 苯酚-硫酸法》[27]的方法稍加修改测定多糖含量。单位以(g/100 g)表示。
样品处理:取发酵后的胡萝卜片,干燥粉碎后称取0.3 g,精确到0.001 g,于50 mL具塞离心管,用5 mL水浸润样品,缓慢加入20 mL无水乙醇,同时使用涡旋振荡器振摇,使混合均匀,超声提取30 min。弃去上清液,不溶物用10 mL 80%乙醇洗涤。用水将上述不溶物转移到圆底烧瓶,加50 mL水,于120 W超声提取30 min,重复2次。冷却至室温,过滤,将上清液转移到100 mL容量瓶定容。
绘制标准曲线:分别吸取0,0.2,0.4,0.6,0.8,1.0 mL的0.1 g/L的标准葡萄糖工作溶液于20 mL具塞试管,用蒸馏水补至1.0 mL,向试液中加入1.0 mL的5%苯酚,然后快速加入5.0 mL浓硫酸,静置10 min。使用涡旋振荡器使反应充分,然后于30 ℃水浴反应20 min,490 nm测吸光度。以葡萄糖质量浓度为横坐标,吸光度值为纵坐标,制定标准曲线Y=14.817X+0.0105(R2=0.9990)。
样品测定:吸取1.00 mL样品于试管中,按标准曲线的方法加入试剂。每个样品重复三次,按以下公式计算。
式中:m1为标准曲线上查得样品中含糖量,μg;V1为样品定容体积,mL;V2为测定时所取测定液体积,mL;m2为样品质量,g;0.9为葡萄糖换算成葡聚糖的校正系数。
1.2.11 胡萝卜素含量的测定 参照周新丽等[28]的方法稍加修改。取发酵后的胡萝卜片,干燥,粉碎,用石油醚浸提1.0 g 干制胡萝卜样品数次,随后将浸提液合并用石油醚定容至50 mL。每个样品重复三次,用以下公式计算各组样品中胡萝卜素的含量。
式中:E为浸提液在 451 nm 处的吸光值;E1为胡萝卜素451 nm 处平均吸收系数,2500;V为石油醚浸提液定容体积,mL;W为被浸提的样品质量,g。
1.2.12 抗坏血酸含量的测定 采用分光光度计法测定抗坏血酸含量[29]。
标准曲线的制备:称取10.0 mg抗坏血酸,用50 g/L TCA溶液配制100 μg/mL标准抗坏血酸溶液。分别取标准抗坏血酸溶液0,0.1,0.2,0.3,0.4,0.5,0.6 mL,用50 g/L TCA补齐2.0 mL,加无水乙醇1.0 mL,0.4%磷酸-乙醇溶液0.5 mL,5 g/L BP-乙醇溶液1.0 mL,0.3 g/L FeCl3-乙醇溶液0.5 mL,534 nm测定吸光值,绘制标准曲线Y=0.0229X+0.0003(R2=0.9985)。
称取10 g发酵后的胡萝卜片置于研钵中,加入20 mL 50 g/L TCA溶液,在冰浴条件下研磨成浆状,转入到50 mL容量瓶中,并用50 g/L TCA溶液定容至刻度,混合、提取10 min后,过滤,收集滤液备用。取1 mL样品提取液于试管,按制作标准曲线的方法添加其它成分,进行反应、测定,每个样品重复三次。
抗坏血酸含量以Y表示,按照以下公式计算:
V为样品提取液总体积,mL;m为标准曲线求得的抗坏血酸的质量,μg;VS为滴定时所用样品提取液体积,mL;M为样品质量,g。
1.3 数据处理与分析
实验数据采用Origin 8.5和SPSS Statistics 32软件进行处理并制图。
2 结果与分析
2.1 质构特性
由表1得出,胡萝卜的硬度在发酵过程中逐渐降低;粘附性总体趋势是先降低再升高;弹性大致呈先降低再升高然后再降低的趋势;内聚性会在发酵第1 d出现显著地降低,之后,变化幅度很小基本趋于稳定;咀嚼性也是随着发酵天数的增加而降低。方差分析结果表明:相较于其它两组,添加红枣汁的植物乳杆菌发酵胡萝卜在硬度、粘附性、弹性、内聚性和咀嚼性方面没有显著性差异(P>0.05)。
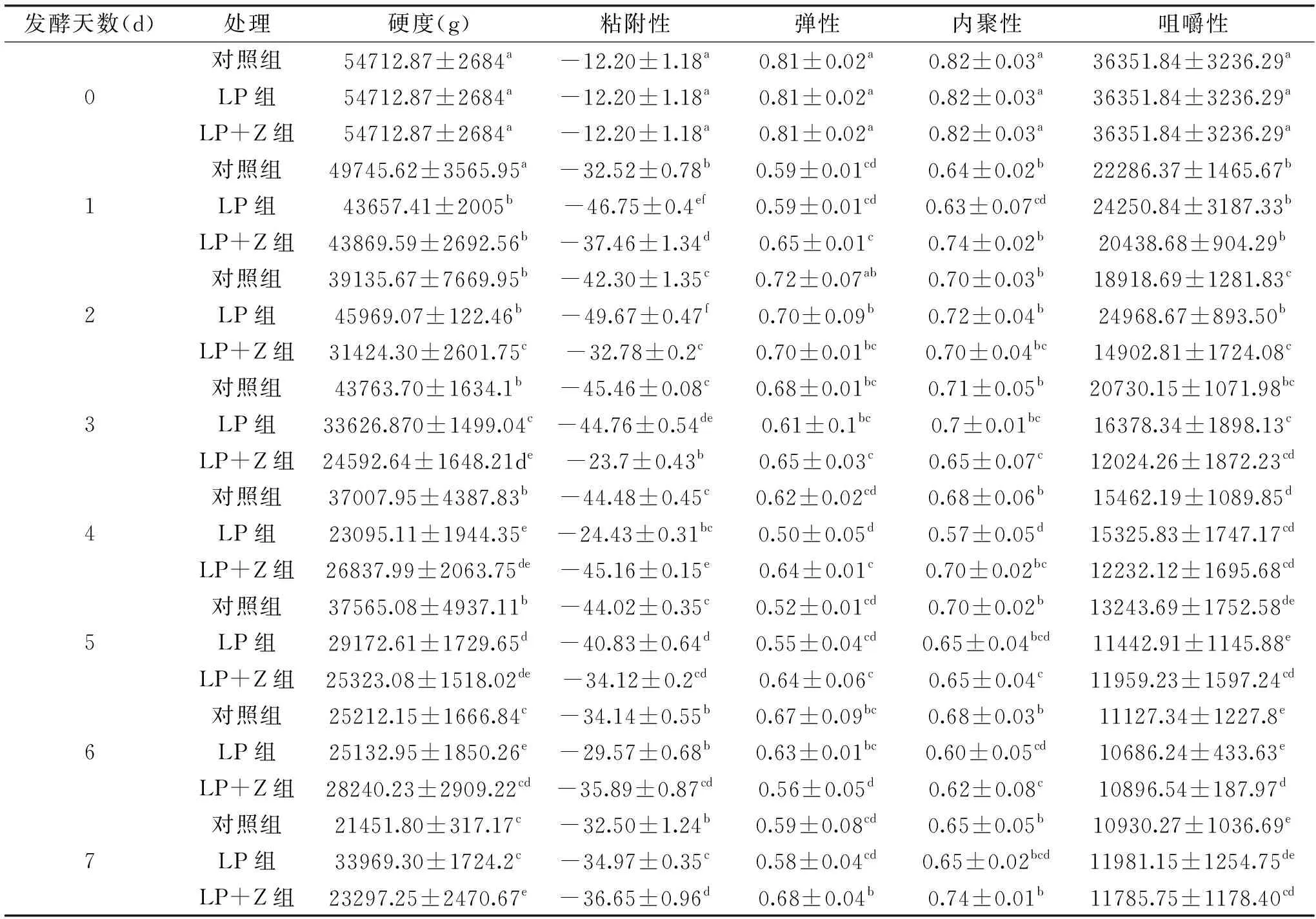
表1 3组发酵胡萝卜的质构差异Table 1 Texture difference of 3 groups fermented carrots
2.2 色差
由表2得出,与未发酵的胡萝卜相比,3个组的亮度(L*)显著降低,且在发酵初期的亮度(L*)下降幅度大于发酵后期,这可能与发酵过程中水分变化有关[18];红色值a*和黄色值b*在发酵第1 d都显著升高,然后趋于稳定。乳酸菌发酵对保持胡萝卜的红色和黄色有一定的的促进作用,可能是乳酸菌的代谢活动有助于胡萝卜色素的溶解。方差分析结果表明:相较于其它两组,添加红枣汁的植物乳杆菌发酵胡萝卜在L*、a*和b*的色差值上没有显著性差异(P>0.05)。
2.3 pH、总酸、亚硝酸盐和总酚含量
由图1A可知,pH总体变化趋势是先降低再升高;对照组是利用萝卜表面天然附着的微生物进行发酵,即使从发酵开始pH也在下降,但是速度低于LP组和LP+Z组。方差分析结果表明,相较于对照组和LP组,LP+Z组胡萝卜发酵液的pH没有显著差异(P>0.05)。
由图1B可得出,对照组的亚硝酸含量总体趋势是先上升再下降然后再上升,在发酵第1 d出现亚硝峰,可能是发酵初期酸度较低导致部分有害菌生长,将硝酸盐还原成亚硝酸盐;LP组和LP+Z组从第1 d开始就下降,第4 d出现显著升高,然后分别在第6 d和第5 d达到亚硝酸盐含量的最小值,可能是随着发酵进行总酸升高,pH不断降低,一方面抑制了有害菌的生长,另一方面亚硝酸盐在酸性条件下会发生酸降解[10]。
由图1C可知,对照组的总酸含量显著低于另外两组,方差分析结果表明,LP+Z组胡萝卜片总酸含量极显著地高于其它两组(P<0.01)。对照组的发酵第1 d总酸含量基本没有变化,这是由于萝卜表面附着的乳酸菌和其它微生物,在密闭厌氧的环境下生长缓慢,之后呈先升高后降低再升高的变化趋势;LP组和LP+Z组的总酸含量先升高后降低,在第6 d达到最大值。接入的植物乳杆菌可以更充分地利用胡萝卜中的糖分,而且枣汁可以促使发酵更加彻底,产生更多的乳酸[16]。
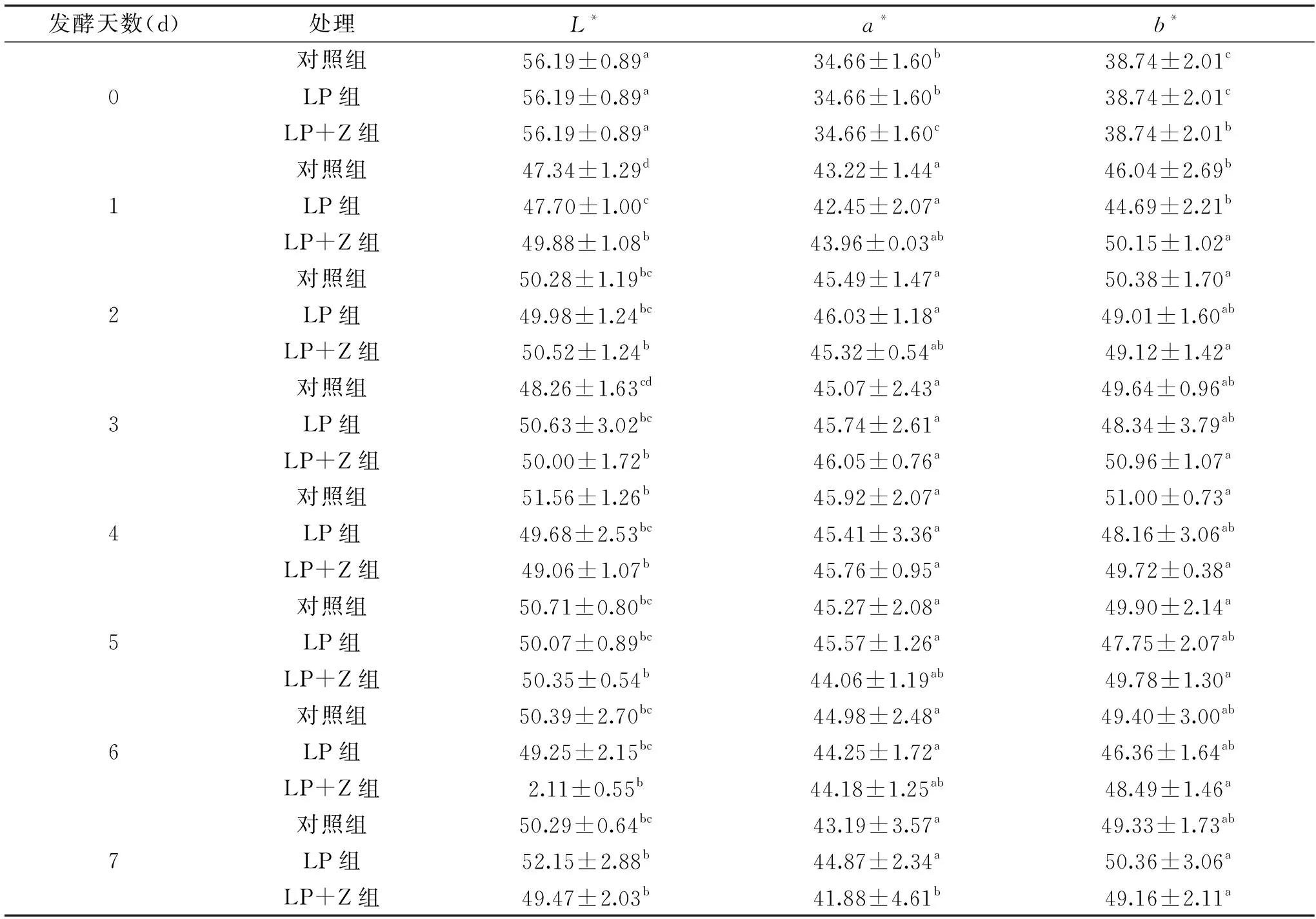
表2 3组发酵胡萝卜的色差比较Table 2 Comparison of color difference among 3 groups fermented carrots
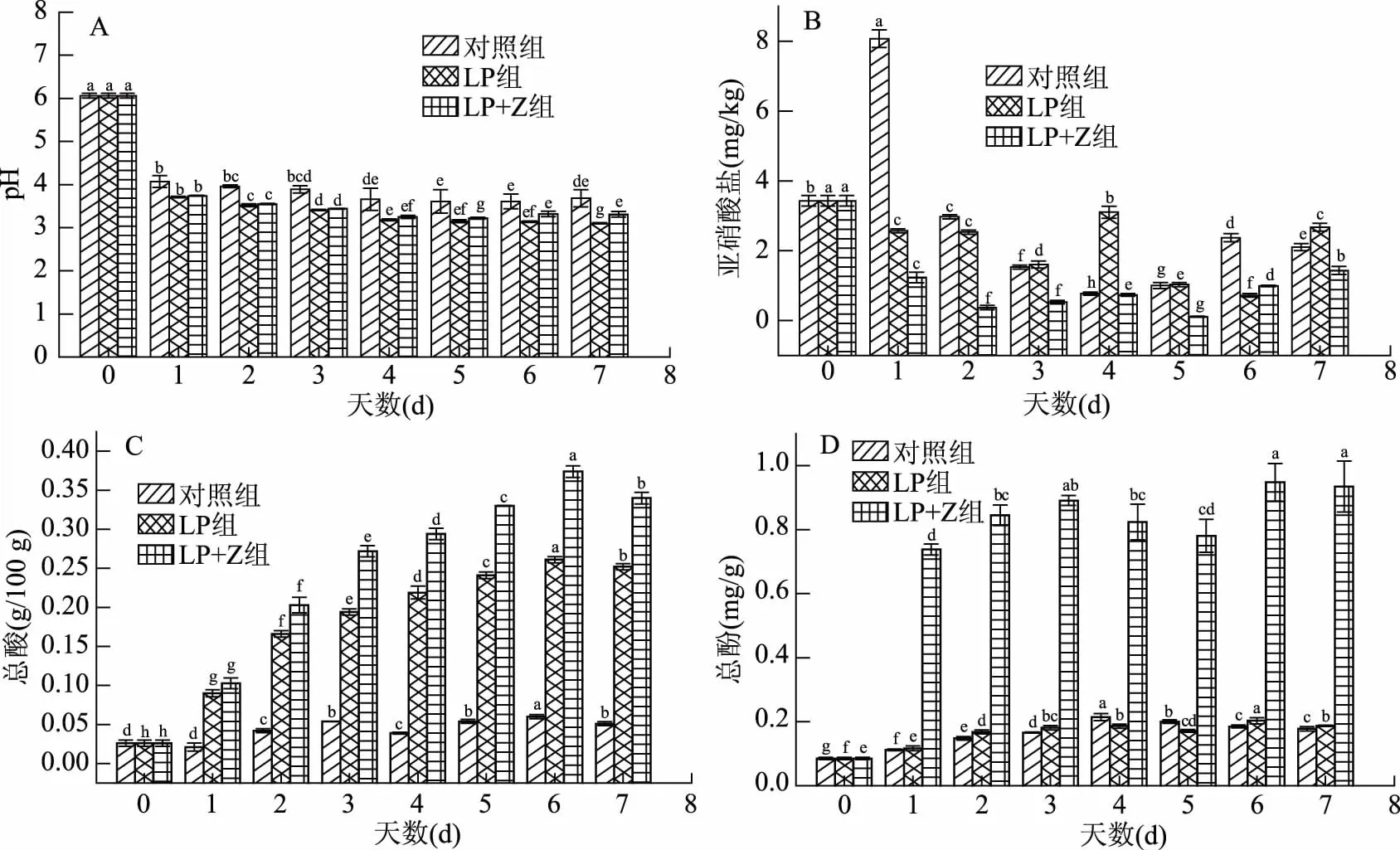
图1 3组发酵胡萝卜的pH(A)、亚硝酸盐含量(B)、总酸含量(C)和总酚含量(D)的比较Fig.1 Comparison of pH values,the content of nitrite,total acid and total phenol in 3 groups fermented carrots注:不同小写字母表示相同处理方式不同发酵天数之间的差异显著;LP组:植物乳杆菌发酵;LP+Z组:红枣汁+植物乳杆菌发酵,图2、图3同。
由图1D得出,对照组和LP组的总酚含量先升高后降低,分别在第4 d和第6 d达到最大值;LP+Z组的总酚含量先升高后降低然后再次升高,在第6 d达到最大值。方差分析结果表明,LP+Z组胡萝卜片总酚含量显著高于其它两组(P<0.01)。这可能是乳酸菌发酵时产生阿魏酸酯酶等酚酸酯酶水解果蔬中的部分结合酚,释放果蔬中的游离酚,并且释放大量的有机酸,防止酚类物质的降解,从而提高了抗氧化活性[30],而且红枣汁本身的结合酚含量比较高,所以LP+Z组的总酚含量显著高于其它两组。
2.4 活菌数差异
由图2可知,添加红枣汁的LP+Z组发酵液中的活菌数高于对照组和LP组。对照组的整体趋势是先升高后降低,最后稳定在105CFU/mL;LP组和LP+Z组的趋势是先降低后升高然后再降低,可能是人工接种的菌之前是在MSR培养基中活化,还不太适应发酵液中的环境所以出现了下降的现象,LP+Z组的活菌数略高于LP组,可能是枣汁含有更多供植物乳杆菌生存的营养物质[16]。
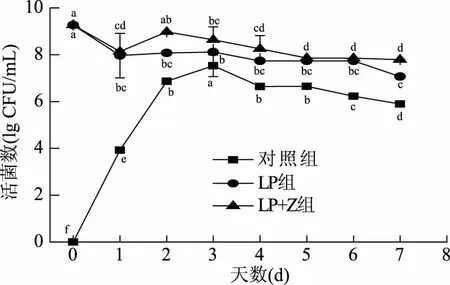
图2 3组发酵胡萝卜的活菌数比较Fig.2 Comparison of the viable bacterianumber in 3 groups fermented carrots
2.5 多糖、胡萝卜素和抗坏血酸含量
由图3A可知,LP+Z组胡萝卜片多糖含量低并且下降速度最快,可能是因为LP+Z组中的植物乳杆菌活力较高,对多糖的利用率高,但是与其它两组相比差异不显著(P>0.05)。3个组的多糖含量都是呈先下降后上升的趋势,这与移兰丽[31]研究结果相一致,可能是因为乳酸菌发酵能够产生一些糖苷酶和纤维素酶分解果蔬中结构较简单的植物多糖生成葡萄糖,D-半乳糖等单糖,并利用这些单糖合成胞外多糖,从而将植物多糖转化成胞外多糖[11],会增强果蔬的抗肿瘤能力和免疫调节能力[32]。
由图3B可知,3个组的胡萝卜素含量都是呈先增加再降低的趋势,这与刘晗璐[33]的研究一致。发酵结束后,对照组的胡萝卜素含量下降了0.74 mg/100 g,LP组和LP+Z组分别增加了0.57和1.293 mg/100 g,这可能与植物乳杆菌本身的代谢活动有关。方差分析表示,LP+Z组胡萝卜片的胡萝卜素含量显著升高(P<0.05)。
由图3C可知:3个组的抗坏血酸含量都是呈先增加再降低然后保持不变的趋势,与张菊华[34]和束文秀等[35]的研究一致,这可能是因为嗜酸乳杆菌具有合成多种维生素如烟酸、VC及VB2的能力。而且乳酸发酵过程产生的酸性环境和CO2造成的缺氧环境有利于胡萝卜中VC的保存[36]。方差分析表示,LP+Z组胡萝卜片的抗坏血酸含量与其它两组相比极显著地增加(P<0.01),LP+Z组胡萝卜片的抗坏血酸含量在发酵7 d后增加了8.48 mg/100 g,这可能因为红枣本身也含有丰富的抗坏血酸。

图3 3组发酵胡萝卜的多糖(A)、胡萝卜素(B)和抗坏血酸(C)含量的比较Fig.3 Comparison of the content of polysaccharides,beta carotene and ascorbic acid in 3 groups fermented carrots
3 结论
与对照组和LP组相比,LP+Z组的胡萝卜素含量显著升高(P<0.05),抗坏血酸含量、总酚含量极显著地升高(P<0.01),使胡萝卜片具有更高的营养价值和抗氧化活性;LP+Z组总酸含量极显著地升高(P<0.01),缩短了发酵进程,改善胡萝卜的口感;活菌数的保留率更高,使胡萝卜片具有一定的益生功效;LP+Z组胡萝卜片的多糖含量下降速度最快,可能合成了较高的胞外多糖;LP+Z组胡萝卜片亚硝酸含量低于其它两组;对照组、LP组和LP+Z组的胡萝卜片在质构特性、色差值和pH上没有显著性差异(P>0.05)。综上所述,添加红枣汁和植物乳杆菌复合发酵会对胡萝卜的品质有一定程度的改善,为之后开发更多益生菌发酵果蔬类的休闲食品提供方向。
