18F-FDG PET/CT和MRI评估颈动脉粥样硬化斑块炎症活动程度的价值分析
2020-08-17上海交通大学医学院附属第九人民医院核医学科上海200011
上海交通大学医学院附属第九人民医院核医学科 (上海 200011)
远 奇 马玉波
众所周知,脑卒中与颈动脉粥样硬化(carotid atherosclerosis,CAS)斑块密切相关,而炎症在斑块的形成及其稳定性中起关键性作用,因此,评价斑块的炎症活性程度有助于发现易损斑块,更准确地监测病情[1]。随着影像学技术的不断发展,CAS斑块监测的方法也多样化,单纯从斑块形态、大小等方面来评估斑块的稳定性往往存在一定偏差,单纯MRI检查并不能完全识别所有较高炎症活动程度的斑块[2]。单核/巨噬细胞是反映斑块炎症的生物学标志物,单核细胞黏附于动脉内皮细胞,逐渐向内膜移行,逐渐分化为富含脂质的泡沫细胞和巨噬细胞,构成斑块脂质核的主要成分,巨噬细胞能释放大量的炎性因子,增加斑块的不稳定性,大量研究证实,18F-FDG PET/CT能显示斑块内巨噬细胞吸收程度和代谢活动情况[3-4]。本研究对CAS斑块患者均行18F-FDG PET/CT和MRI检查,旨在分析两种影像学技术在评估斑块炎症活动程度方面的价值,现报告如下。
1 资料与方法
1.1 一般资料 选取2017年3月至2018年3月上海交通大学医学院附属第九人民医院收治的38例CAS斑块患者为研究对象,纳入标准:①经颈动脉超声检查发现CAS斑块,斑块厚度≥2mm;②2周内行18F-FDG PET/CT和MRI检查;③患者及家属均签署知情同意书。排除标准:①孕妇或哺乳期妇女;②近期感染或血管炎患者;③FDG注射前血糖不低于150mg/ml;④合并恶性肿瘤;⑤患有严重肝、肾疾病;⑥体内有人工瓣膜、心脏起搏器等金属物质者;⑦造影剂过敏;⑧病情不稳定,难以配合完成检查者。
1.2 检查方法
1.2.118F-FDG PET/CT检查:采用飞利浦Ingenuity TF PET/CT仪,受检者均至少禁食6h,给药前均常规检测血糖并控制在7.0mmol/L以下。取仰卧位,按5.55MBq/kg的剂量静脉注射18FFDG,静卧1h后显像,PET显像以3min/床位进行三维采集。CT扫描参数为:管电压120kV,管电流180mAs,层厚5mm,螺距1.0,进床速度5s/圈,旋转时间0.5s。
1.2.2 MRI检查:使用GE Signa 1.5T MRI仪和颈动脉专用相控阵线圈行MRI检查,先行2DTOF扫描,初步判定颈动脉及其分叉部、斑块位置和范围,然后对斑块行4个标准序列的轴位扫描,获得T1加权(T1WI)、T2加权(T2WI)、三维时间飞越(3D TOF)及质子密度加权(PDWI)序列图像,确定颈动脉狭窄程度及CAS斑块组成成分。
1.3 图像处理 采用CT扫描数据对PET图像进行衰减矫正,然后运用有序子集最大期望值迭代法(OSEM)进行图像重建,矩阵128×128,得到冠状位、横断位和矢状位的CT图像、PET图像及融合图像。图像分析由2名经验丰富的影像科医师分别独立完成。在颈动脉轮廓斑块周围勾画感兴趣区(ROI),测量斑块平均标准化摄取值(SUV),并对对侧颈静脉区SUV进行标准化,计算靶-本底比值(TBR)=局部感兴趣区SUV/对侧颈静脉区SUV。
1.4 统计学分析 运用SPSS 20.0统计软件进行数据分析,服从正态分布的计量数据以表示,组间比较行t检验,非正态分布数据以中位数(范围)表示,组间比较采用Wilcoxon秩和检验;计数数据以[n(%)]表示,组间比较行χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 38例患者基线资料 38例患者中,男性33例,女性5例;年龄45~80岁,平均(69.36±8.54)岁,脑梗死13例,高血压26例,糖尿病15例。见表1。
2.2 CAS斑块分布情况 38例患者中,CAS斑块仅累及左侧颈动脉6例,仅累及右侧颈动脉4例,累及双侧颈动脉28例。见表2。
2.3 不同成分CAS斑块的MRI影像学特点 影像学上主要通过斑块的成分进行鉴定,主要有纤维帽、钙化、脂质、出血,纤维帽在MRI中,T1WI序列上多表现为等信号,T2WI、PDWI序列上无特定信号,3D TOF序列上多表现为带状低信号。钙化斑块在所有序列上均表现为不规则低信号。脂质斑块和坏死核在T1WI、PDWI、3D TOF序列上多表现为等信号或稍高信号,二者难以区分。出血斑块在T1WI、T2WI、PDWI序列上多表现为明显高信号,3D TOF序列上表现为混杂信号或高信号。见图7-9。

表1 38例患者基线资料

表2 CAS斑块分布情况
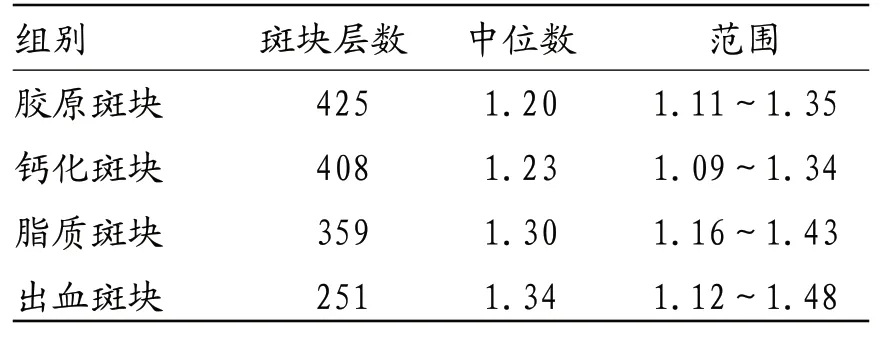
表3 不同成分CAS斑块的TBR值比较
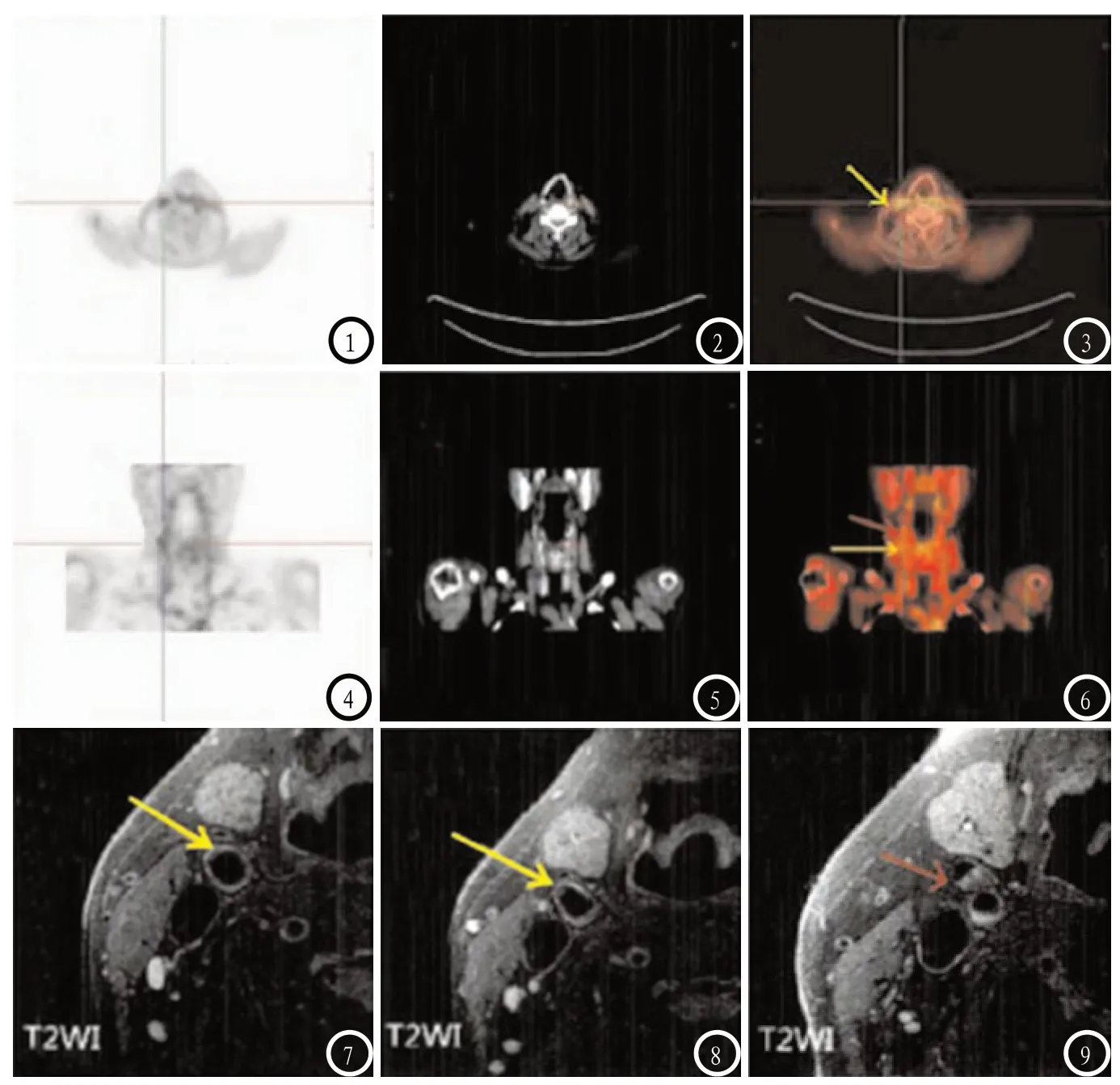
图1-6 为18F-FDG PET/CT图像。图7-9 为MRI图像。图7、8为颈动脉分叉前图像,可见斑块负荷较轻(黄色箭头),同样位置的PET图像可看到FDG摄取明显增加(图3、6中黄色箭头);图9为颈动脉分叉后图像,颈外动脉可见明显斑块(红色剪头),同样位置的PET图像可看到FDG聚集(图6中红色箭头)。
2.4 不同成分CAS斑块的TBR值比较 出血斑块、脂质斑块的TBR值明显大于钙化斑块、胶原斑块(P<0.05);出血斑块与脂质斑块的TBR值比较,差异无统计学意义(P>0.05);钙化斑块与胶原斑块的TBR值比较,差异无统计学意义(P>0.05)。见表3。见图1-6。
3 讨 论
据统计,平均每四分钟就会有一人死于脑卒中,而脑卒中与CAS关系密切,大部分脑卒中是由CAS斑块破裂形成血栓所致,能在斑块破裂前发现病灶,并采取积极有效的治疗方法,对挽救患者的生命有重要的临床意义[5]。斑块破裂的风险主要取决于斑块的组成成分而非斑块大小,斑块的炎症在决定斑块稳定性方面起主要作用,因此,分析CAS斑块的组成成分,提高影像学检查方法的灵敏度、准确度及安全性,确定斑块的性质、炎症活动程度和稳定性,成为预防缺血性脑血管疾病工作中重要的一部分[6]。
目前,临床用于评估CAS斑块性质的检查方法主要有超声、MRI、血管造影、CT血管造影等,数字减影动脉造影(DSA)一直以为被认为是诊断颈动脉狭窄的“金标准”,但因其有创性及可能引发动脉痉挛、CAS斑块脱落等并发症而有所限制,常被无创检查方法替代[7]。既往研究表明,随着MRI黑血技术、亮血技术的应用,诊断CAS斑块的精确性明显提高,黑血技术有助于显示斑块的形态和组成成分,亮血技术即TOF,采集时间段,在鉴别斑块内出血及纤维帽等低信号成分方面有优势[8]。本研究应用T1WI、T2WI、3D TOF及PDWI四个观察序列,医师结合临床经验进行图像分析,3D TOF序列对判定纤维帽的薄、厚及是否破裂最为有效,T1WI与3D TOF序列结合用于判断斑块内是否出血,并与脂质核区别开。
有炎症的斑块巨噬细胞的葡萄糖代谢非常活跃,而18F-FDG是斑块内活性炎性细胞显影的标记药物,Silvola J M U等[9]用实验兔发现,CAS病变部位FDG摄取量与血管炎症(巨噬细胞密度)有关,与平滑肌细胞密度、斑块厚度及血管壁厚度无关。本研究结果显示,出血斑块、脂质斑块的TBR值明显大于钙化斑块、胶原斑块;说明18F-FDG摄取量与CAS斑块炎症活动程度密切相关。纤维斑块是CAS较初级阶段,胶原斑块多为该类斑块,炎症活动程度较低,斑块相对较稳定;钙化是CAS斑块形成过程中较常见的并发症之一,多认为是由平滑肌细胞分化为软骨样细胞,最终形成CAS钙化所致[10]。本研究中,钙化斑块TBR值与胶原斑块的TBR值无明显差异,但钙化对于斑块破裂是一把“双刃剑”,不能一味地因钙化斑块炎症活动城较低而认定为稳定斑块。脂质核心是由大量游离的胆固醇及富含脂质的泡沫细胞堆积而成,当泡沫细胞过度吞噬胆固醇后脂质核心发生裂解形成胆固醇结晶,意味着斑块内出现坏死[11]。本研究中,脂质斑块的TBR值与出血斑块相当,可能与脂质斑块内出现坏死,存在较多炎症浸润的复杂成分有关。斑块内出血是多种因素共同作用的结果,是CAS斑块晚期严重的并发症,是斑块破裂、血栓形成重要的病理基础,是一个极危险的指征[12]。
综上所述,18F-FDG PET/CT和MRI检查可显示斑块形态、成分、信号特点等信息,以此来反映CAS斑块炎症活动程度,对预测CAS斑块患者斑块破裂、血栓形成事件具有潜在的应用价值。