18F-FDG PET/CT影像学特征对I期实性肺腺癌脉管侵犯的预测价值
2020-08-17段晓蓓陈相猛黄斌豪邹伟强秦贵磷孙丽霞
段晓蓓,陈相猛,黄斌豪,邹伟强,秦贵磷,孙丽霞
(中山大学附属江门医院1.核医学科,2.放射科,3.病理科,广东江门 529070)
肺癌发病率和死亡率均居我国恶性肿瘤的首位,80%~85%的肺癌患者的病理组织学类型为非小细胞肺癌(non-small cell cancer,NSCLC)。NSCLC 的预后与TNM 分期密切相关,I 期肺癌预后较好,IA 期和IB 期NSCLC 的5 年生存率分别约为86.8%和73.9%。临床首选的I 期NSCLC 治疗方案为根治性手术切除,然而,即使完整切除肿瘤,仍有15%的患者术后复发[1]。通常认为,早期肺癌完整切除术后需要进行规律的随访和监测,而不需要辅助性化疗,但是一些病理组织学表现相对较差的患者,如伴有脉管侵犯,则需要进行更为密切的随访和/或辅助性化疗[2]。近年来有研究认为病理性脉管侵犯是影响早期NSCLC 术后复发及总体生存率的预后不良的独立危险因素[3-4]。因此,术前通过无创性检查手段准确判断肺癌病灶有无脉管侵犯,对患者治疗方式选择和预后评估具有重要的临床价值。因此,本研究回顾性分析我院经手术根治切除和病理组织学证实的Ⅰ期肺腺癌患者,讨论18F-FDG PET/CT 影像学特征在Ⅰ期肺腺癌脉管侵犯中的预测价值。
1 材料与方法
1.1 研究对象
本研究经我院医学伦理委员会批准,经患者知情同意。回顾性收集2017 年1 月至2019 年9 月在我院行术前全身18F-FDG PET/CT 检查并行手术切除治疗的肺腺癌患者。纳入标准:①完整手术切除和病理组织学证实为Ⅰ期原发性肺腺癌(IAN0M0 和IBN0M0);②术前接受全身18F-FDG PET/CT 检查并且图像可以在PACS 系统阅读;③PET/CT 检查与手术间隔时间约2 周以内;④高分辨率CT(High resolution CT,HRCT)表现为孤立性实性肺部结节或肿块;⑤胸部HRCT 图像层厚为0.625 mm;⑥患者术前未接受过放疗或者化疗。排除标准:①亚实性(非实性和部分实性)肺结节患者;②支气管镜或穿刺活检确诊的肺腺癌患者;③既往恶性肿瘤病史患者;④图像质量达不到诊断要求的患者。共纳入143例肺腺癌患者,其中Ⅰ期肺癌患者112 例,影像学表现为孤立性实性结节和肿块的患者86 例,IA 期71 例,IB 期15 例;男43 例,女43 例;年龄范围28~81(59.9±10.3)岁。影像学表现为孤立性亚实性肺结节的患者26 例。
1.2 仪器与方法
采用美国GE公司Discovery VCT 64型PET/CT扫描设备,氟代脱氧葡萄糖(18F-FDG)由广州原子高科有限公司提供(放化纯度>95%)。检查前患者禁食至少6 h,空腹血糖水平控制在8.1 mmol/L以下,18F-FDG 注射剂量为3.70~5.55 MBq/kg(0.1~0.15 mCi/kg),注射后患者于暗室内安静平卧休息60 min,PET/CT 检查前排空小便。图像采集从颅底到股骨中段。CT 扫描参数:管电压120 kV,自动管电流跟踪技术,转速0.6 s,螺距0.516:1。PET 扫描参数:采用3D 方式采集5~7 个床位,每个床位3 min,层厚3.75 mm,采用标准迭代重建法重建,矩阵128×128,重建层厚1.25 mm;采集完成后利用CT 数据对PET 图像进行衰减校正,重建横断位、冠状位及矢状位图像。对于肺部病变区域采用HRCT 扫描,高分辨B70f 算法重建肺窗图像,层厚为0.625 mm。部分病例于注射显像剂2 h 后行胸部病灶局部延迟显像,检查条件同首次显像,早期显像和延迟显像的时间间隔为1 h。
1.3 图像分析
由两位核医学科高年资医师分别对PET/CT图像进行单独阅读,意见不一致时协商达成一致。在PET 图像上,根据病变位置勾画ROI 后由工作站软件自动计算肺部病灶的最大标准化摄取值(maximum of standard unit of value,SUVmax)。在HRCT 图像上,采用肺窗(窗宽1 500 HU,窗位-550 HU)、纵隔窗(窗宽350 HU,窗位40 HU)进行观察。病灶的特征包括:①径线(横断位最大层面长径和垂直短径的平均值);②位置(左肺上叶,下叶;右肺上叶,中叶,下叶);③形态(规则,不规则);④分叶征;⑤毛刺征;⑥空泡征;⑦空气支气管征;⑧胸膜牵拉征;⑨周围肺气肿等。分叶征表现为结节表面弧形凹陷;毛刺征表现为结节边缘向周围呈放射状的细小线条影;空泡征指结节内部<5 mm 类圆形透亮影;空气支气管征是指结节内管状透亮的细支气管影;胸膜牵拉征定义为结节与胸膜接触并局部胸膜向结节侧移位[5-6]。
1.4 病理组织学诊断
所有肺切除组织切片由两名高年资胸部病理学医生进行病理组织学复核,意见不一致协商达成最终诊断。根据IASLC/ATS/ERS 2011 年肺腺癌分类标准[7]。肺癌组织样本均进行HE 染色和免疫组化染色。脉管侵犯是指内皮细胞衬覆的脉管腔内见到癌细胞巢团,包括淋巴管和血管侵犯;淋巴管侵犯采用常规染色和D2-40 双重免疫组化检测,血管侵犯采用常规染色和CD31、CD34 免疫组化检测。依据病理组织学诊断结果将纳入患者分为脉管侵犯阳性组和阴性组。
1.5 统计学方法
采用SPSS 22.0 统计学软件分析,计量资料采用均数±标准差表示;符合正态分布且方差齐性的定量资料(SUVmax)采用两组独立样本t检验,方差不齐的资料采用校正t'检验;不符合正态分布的定量资料(年龄、径线)采用两组独立样本比较的Mann-WhitneyU秩和检验;定性资料(性别、位置、病灶分叶、毛刺、空气支气管征、胸膜牵拉)采用χ2检验,最小理论值T<1 的定性资料(病灶形态、空泡征、周围肺气肿)采用Fisher 确切概率法检验。将单因素分析评估的有统计学意义的指标纳入多因素Logistic 回归进行分析,建立回归模型,分析危险预测因素。使用受试者工作特征(ROC)曲线分析Ⅰ期实性肺腺癌脉管侵犯的最佳临界值,并计算该模型诊断的敏感度、特异度、准确度。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基本资料
86 例Ⅰ期肺腺癌患者中脉管侵犯组12 例,无脉管侵犯组74 例。脉管侵犯组男5 例,女7 例,年龄范围为43~71(59.0±8.3)岁;无脉管侵犯组男38 例,女36 例,年龄范围为28~81(60.1±10.6)岁。两组间性别、年龄差异均无统计学意义(χ2=0.387,P=0.534;Z=-0.624,P=0.533;表1)。26 例影像学表现为亚实性肺结节的肺癌患者均未发生脉管侵犯。
2.2 病灶径线、位置分布在两组中的对比分析
脉管侵犯组病灶径线范围为15.5~38.0(28.4±8.9)mm,大于无脉管侵犯组病灶径线范围为5.0~36.0(21.4±9.7)mm,两组间差异有统计学意义(Z=-2.505,P=0.012)。两组间病灶在各肺叶的位置分布差异无统计学意义(χ2=2.305,P=0.680;表1)。
2.3 HRCT 影像学特征
两组在病灶形态之间差异有统计学意义(P=0.048,Fisher 确切概率法);两组在分叶、毛刺、空泡征、空气支气管征、胸膜牵拉征、周围肺气肿表现之间差异均无统计学意义(χ2=1.150,P=0.284;χ2=0.008,P=0.931;P=0.284,Fisher 确切概率法);χ2=1.024,P=0.312;χ2=1.217,P=0.270;P=0.739,Fisher 确切概率法;表1)。
2.4 18F-FDG PET/CT 影像表现
脉管侵犯组肺腺癌病灶均不同程度摄取FDG,代谢增高,脉管侵犯组SUVmax 范围为3.0~23.3(11.05±5.58);无脉管侵犯组SUVmax 范围为0.5~12.6(5.08±3.01),见图1、2。脉管侵犯组SUVmax明显高于无脉管侵犯组,两组间差异有统计学意义(t=-3.625,P=0.003;表1)。26 例影像学表现为亚实性肺结节的肺癌患者SUVmax 范围为0.6~4.6(2.2±1.35)。
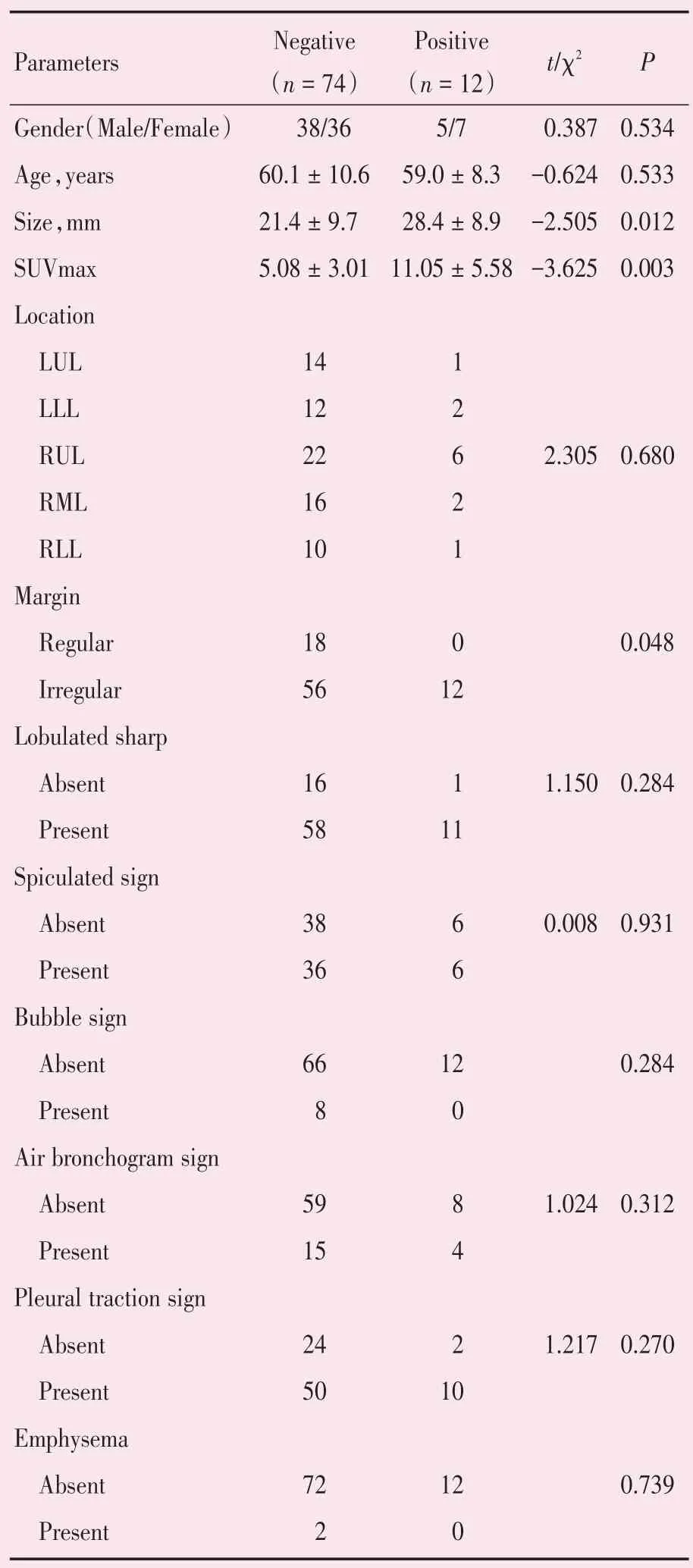
表1 Ⅰ期肺腺癌脉管侵犯组与无脉管侵犯组临床和PET/CT 参数比较Table 1 Comparison of the clinical and PET/CT parameters between lymphovascular positive and negative groups in stage Ⅰlung adenocarcinomas
2.5 多因素Logistic 回归及ROC 曲线分析
将单因素分析得出的有统计学意义的指标(包括病灶径线、形态、SUVmax)纳入多因素Logistic 回归进行分析,采用逐步回归,最终只有SUVmax 纳入回归方程,回归系数为0.395,Wald值为12.758,P=0.000,回归方程为

提示SUVmax 是预测Ⅰ期肺腺癌脉管侵犯的独立危险因素,OR 值为1.484(95%CI:1.195~1.843;P=0.000;表2)。以SUVmax 进行ROC 曲线分析,曲线下面积AUC 为0.840,最佳诊断临界值SUVmax 为7.75 时,敏感度为75.0%,特异度为79.7%,准确度为79.1%;图3)。
3 讨论
脉管侵犯指肿瘤的血管侵犯和淋巴管侵犯,肿瘤细胞通过血管或淋巴管最终转移至区域淋巴结和远处器官。肺癌发生脉管侵犯的患者容易发生局部复发与远处转移,且与肺癌的不良预后有关[8-9]。目前关于肺癌是否发生脉管侵犯的预测模型的相关报道较少,建立准确的脉管侵犯预测模型对Ⅰ期肺癌患者术后是否需要行辅助治疗及随访时间管理具有重要的参考价值[4,10]。18F-FDG PET/CT 是目前临床应用成熟的分子影像学技术,通过定量测量肿瘤组织FDG 摄取情况即SUV,能在分子水平提供肿瘤细胞的代谢活性信息[11-12]。目前国内外研究认为SUVmax 升高为Ⅰ期NSCLC 患者的不良预后因素,但SUVmax 预测Ⅰ期肺癌脉管侵犯的价值及最佳临界值尚需要进一步研究[13-15]。本研究基于18F-FDG PET/CT 影像学特征建立了Ⅰ期实性肺腺癌脉管侵犯的风险预测模型,结果显示SUVmax 在预测Ⅰ期实性肺腺癌发生脉管侵犯具有较高价值,可以为临床医生制订个性化治疗方案提供重要依据。
既往文献报道Ⅰ期NSCLC 脉管侵犯的发生率结果不一致,范围约为5%~40%[16-17]。Yip 等[18]研究小于30 mm NSCLC 的脉管侵犯和胸膜侵犯的生存情况,94 例非实性结节和63 例部分实性结节中,仅各有1 例发生脉管侵犯,发生率分别为1.06%(1/94)、1.58%(1/63),亚实性肺结节脉管侵犯的总体发生率为1.27%(2/157);243 例实性结节中,26 例发生脉管侵犯,发生率为10.7%(26/243)。其大样本结果说明亚实性肺癌病灶脉管侵犯发生率明显低于实性肺癌病灶,在研究肺癌脉管侵犯时应该考虑到病灶密度不同所带来的影响。本研究纳入112 例Ⅰ期肺腺癌患者中,26 例亚实性肺腺癌患者均未发生脉管侵犯,86 例实性肺腺癌患者中12 例(14.0%)发生脉管侵犯,与Yip 研究结果接近[18]。
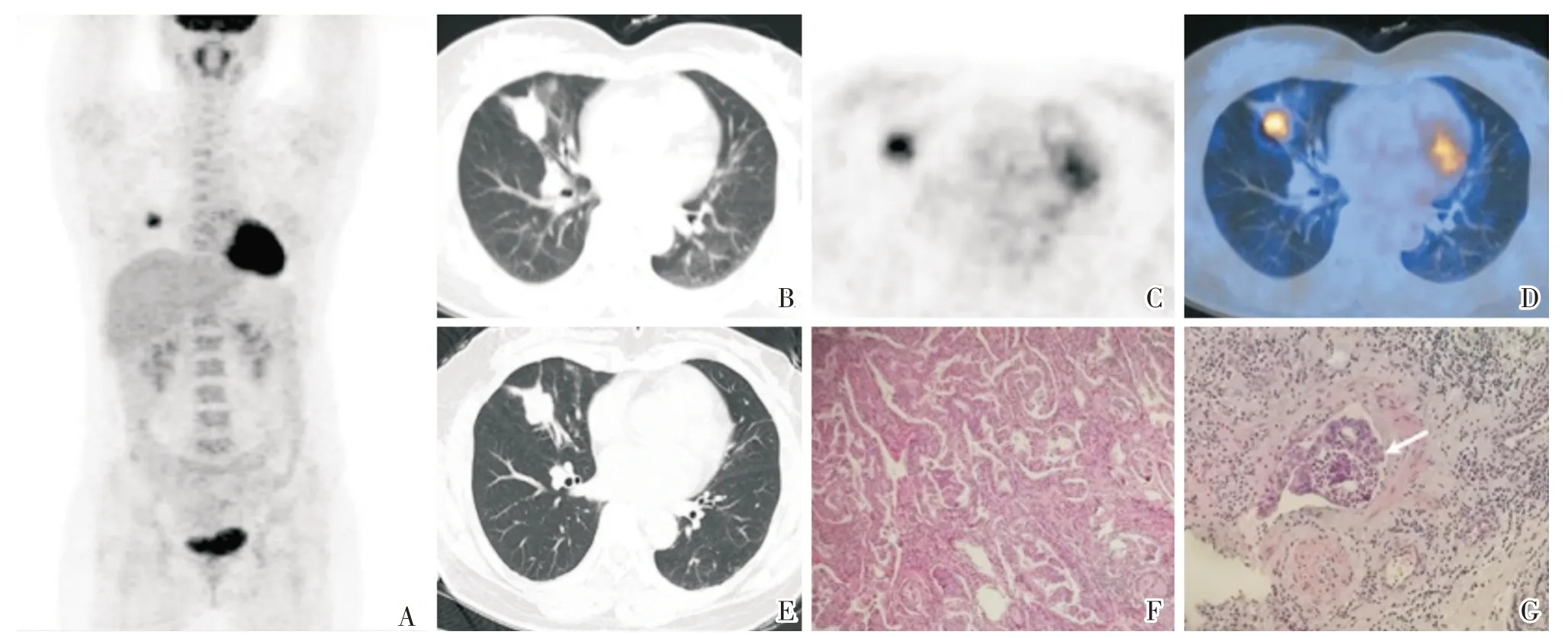
图1 脉管侵犯阳性患者PET/CT 表现及病理组织学图像Fig.1 PET/CT features and pathological images in one patient with positive lymphovascular infiltration
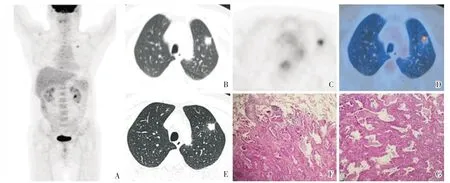
图2 脉管侵犯阴性患者PET/CT 表现及病理组织学图像Fig.2 PET/CT features and pathological images in one patient with negative lymphovascular infiltration

表2 Ⅰ期肺腺癌脉管侵犯组与无脉管侵犯组PET/CT 参数的Logistic 回归分析Table 2 Logistic analysis of PET/CT parameters of lymphovascular positive and negative groups in stage Ⅰlung adenocarcinomas
本研究单因素分析显示脉管侵犯组与无侵犯组之间在病灶径线、形态、SUVmax 之间差异均具有统计学意义(P均<0.05),而其余HRCT 影像特征包括分叶、毛刺、空泡征、空气支气管征、胸膜牵拉征、周围肺气肿表现之间差异均无统计学意义(P均>0.05)。脉管侵犯组病灶的平均径线为(28.4±8.9)mm,大于无脉管侵犯组,后者病灶平均径线为(21.4±9.7)mm,两组间差异有统计学意义(P=0.012)。其病理基础为肿瘤径线越大,所需供养血管越多,脱落的肿瘤细胞越容易侵入血管和淋巴管系统并发生脉管侵犯,并可能随脉管系统发生远处转移。脉管侵犯组病灶形态不规则的比例高于非脉管侵犯组,可能与病灶生长分化程度有关。肺腺癌早期肿瘤细胞生长速度缓慢且受到肺泡基底膜的阻挡,病灶形态较规则趋于圆形或椭圆形;病灶进展浸润成分增多,生长速度加快并且各个方向生长速度不一致,形态逐渐不规则并出现分叶和毛刺等影像学征象[19-20]。周莹等[21]发现CT 形态学特征包括结节直径、毛刺征和空气支气管征与肺腺癌脉管侵犯密切相关,以结节径线2.05 cm 为诊断阈值预测病理性脉管侵犯的敏感度为66.7%,特异度为78.8%。本研究显示结节径线在鉴别是否发生脉管侵犯上具有统计学差异,但毛刺征和空气支气管征在两组的差异无统计学意义,可能与本研究收集病例数据较少,脉管侵犯阳性组和阴性组样本量比例不均衡(12∶74)有关;同时,各种CT 征象在不同密度肺结节中出现的频率不同,空气支气管征多见于亚实性肺结节,而实性肺结节该征象相对少见[22]。周莹等[21]研究中纳入患者中包含亚实性结节,本研究全部以实性结节为研究对象。我们在今后的工作中应扩大样本量,进一步验证PET/CT 显像对肺腺癌脉管侵犯鉴别诊断的临床价值。
本研究对86 例不伴淋巴结转移的Ⅰ期肺腺癌按照有无脉管侵犯进行分组对比分析,结果显示18F-FDG PET/CT 显像中SUVmax 是预测Ⅰ期肺腺癌脉管侵犯的独立危险因素,OR 值为1.484(95%CI:1.195~1.843;P=0.000)。Noda 等[23]研究表明肺腺癌的SUVmax 与肿瘤脉管侵犯有显著的相关性,SUVmax 是预测肺腺癌肿瘤脉管侵犯的影像学生物标志物,无论是否以淋巴结转移进行分组,均提示SUVmax 是脉管侵犯的独立危险因素,在无淋巴结转移的70 个肺腺癌中,脉管侵犯的发生率为10%(7/70),研究得出SUVmax 为3.26 时为最佳诊断界值,AUC 为0.91,敏感度为86%,特异度为89%。本研究对SUVmax 进行ROC 曲线分析,最佳诊断临界值SUVmax 为7.75 时,敏感性为75.0%,特异性为79.7%,曲线下面积AUC为0.840。我们的研究结果与文献报道接近,但SUVmax 的最佳诊断界值不同,分析原因可能是选择的研究对象不同。本研究选择的是影像学表现为孤立性实性病变的Ⅰ期肺腺癌患者,前者纳入的为手术切除的肺腺癌患者,未进行影像学分类,包含影像学表现为亚实性肺癌结节患者,而亚实性肺结节在PET/CT 中的FDG 摄取通常不高[24]。虽然我们发现以SUVmax 值7.75 鉴别Ⅰ期实性肺腺癌发生脉管侵犯的准确度可以达到79.1%,但是在病理性脉管侵犯阳性组和阴性组SUVmax 分布仍存在着部分重叠,阳性组有3 例(25.0%)SUVmax 低于7.75,同时阴性组有15 例(20.3%)SUVmax 高于7.75,其原因可能与肺腺癌生物学异质性较高、肿瘤细胞分化程度复杂、肿瘤血管生成及坏死导致葡萄糖代谢分布不均匀所致。近年来肿瘤代谢体积(metabolic tumor volume,MTV)和病变总糖酵解值(total lesion glycolysis,TLG)作为3D测量参数逐步应用于PET/CT 检查,较SUVmax 能够反映肿瘤整体的代谢负荷[25]。PET/CT 检查参数SUVmax、MTV 和TLG 的联合使用对肿瘤的生物学特征及行为的描述和评估更加精准,可以提高预测肺癌脉管侵犯的诊断效能,也是我们下一步研究探索方向。
研究局限性:①本文为回顾性研究,在样本选择难免出现选择性偏倚,样本量较小,脉管侵犯阳性组的数量为12 例,需要进一步增加样本量和前瞻性验证。②我们排除了孤立性亚实性肺腺癌病灶患者,因为很多亚实性肺腺癌病灶在18FFDG PET/CT 摄取很低或者几乎没有摄取,同时亚实性肺腺癌病灶发生脉管侵犯的比率明显低于实性肺腺癌病灶,更倾向于临床实践。
综上,18F-FDG PET/CT影像学特征有助于预测Ⅰ期实性肺腺癌脉管侵犯。SUVmax 是诊断Ⅰ期实性腺癌病灶脉管侵犯的独立危险因素,SUVmax大于7.75 时病灶发生脉管侵犯的可能性增加,有助于指导临床选择辅助治疗方案。
