NLRP3炎症小体在甲型流感病毒H1N1预感染降低小鼠巨噬细胞抗MRSA免疫中的作用
2020-08-17师小函石云锋巴俊慧罗进梅胡佳佳吴本权
师小函,石云锋,巴俊慧,罗进梅,胡佳佳,吴本权
(中山大学附属第三医院MICU,呼吸与危重症医学科,广东广州 510630)
甲型流感病毒(甲流病毒)引起呼吸道感染,变异株易引起大范围流感爆发流行[1-2],如1918 年西班牙H1N1 大流感,导致将近5 000 万人死亡。人类感染甲流病毒后易继发耐甲氧西林金黄色葡萄球 菌(methicillin-resistant staphylococcus aureus,MRSA)感染,导致重症肺炎[3]。甲流病毒感染1 周是继发MRSA 肺炎的高峰期。国内外对甲流病毒继发MRSA 感染的机制研究多数关注上皮细胞粘附性的增加及局部免疫屏障的破坏等[4-5]。近年研究发现NLRP3(nucleotide oligomerization and bind⁃ing domain-like receptor P3,NLRP3)炎症小体在抗甲流病毒免疫中起重要作用[6-7]。研究发现MRSA感染亦能激活NLRP3 炎症小体[8]。甲流病毒联合MRSA 感染降低了NLRP3 炎症小体介导的IL-1β的释放,加剧MRSA 肺炎[9]。但在临床真实的病理生理状况,即甲流病毒感染后继发MRSA 感染,NL⁃RP3 炎症小体在其中的具体作用如何,未见相关研究。本研究以MRSA感染经甲流病毒H1N1预感染1 周的小鼠巨噬细胞,研究NLRP3 炎症小体在甲流病毒感染继发MRSA肺炎中活性及其作用。
1 材料与方法
1.1 实验细胞系、病毒株和菌株
小鼠巨噬细胞RAW264.7 购自于中国医学科学院基础医学院细胞中心。甲流病毒H1N1/FM1为鼠肺适应株,获赠于暨南大学医学院微生物学与免疫学教研室。MRSA 菌株为中山大学附属第三医院呼吸与危重症医学科实验室分离鉴定的临床菌株。实验均在实验室同意的情况下在生物安全柜中进行操作。
1.2 试剂和材料
MLV 第一链合成试剂盒、SYBR® select mas⁃ter mix 购 于美 国Life Technologies 公司。NLRP3 单克隆兔抗体购于美国Cell Signaling Technology 公司。NLRP3 免疫荧光羊抗兔二抗购于美国R&D 公司。Hoechst33342 购于中国谷歌生物科技公司。内参抗体GAPDH 兔抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗、凯基全蛋白提取试剂盒及凯基BCA 法蛋白浓度检测试剂盒购于广州杰特伟科技有限公司。ELISA检测试剂盒购于美国R&D公司。
1.3 细胞培养
以完全培养基在25 mL 培养瓶中培养RAW 264.7 细胞,置于37 ℃、体积分数5%CO2培养箱内,当细胞融合至约70%培养瓶底面积且状态良好时用胰酶消化传代。实验细胞均处于其对数生长期,MTT染色细胞活力>98%。
1.4 甲流病毒H1N1复苏和毒力测定
复苏液氮罐中冻存的H1N1/FM1 病毒株,于9日龄鸡胚尿囊腔连续传代2 次扩增,以鸡红细胞血凝试验测定扩增的病毒效价。以无血清DMEM 培养液对H1N1/FM1 病毒株行连续10 倍递次稀释至10-8。以RAW264.7 细胞检测计算病毒半数组织培养感染计量(median tissue culture infective dose,TCID50)[10]。
1.5 细菌培养
解冻-80 ℃冻存的MRSA 菌株,接种于血琼脂培养基并37 ℃温箱培养,挑取菌落溶于无菌PBS中,测定其在600 nm 处吸光度(optical density,OD600),OD600=0.6时细菌含量为1×109/mL。
1.6 甲流病毒H1N1、MRSA 感染小鼠巨噬细胞及分组
取对数生长期的RAW264.7 细胞按1×106/mL密度接种于6 孔板,每孔加入完全培养基2 mL,待细胞扩增至2×106时作为实验起点0 h,换液,H1N1预感染组加入病毒。根据病毒TC ID50的测定结果,每孔加入100 μL 的10 TCID50病毒稀释液。根据预实验结果,MRSA 按感染复数(multiplicity of infection,MOI)10:1 加入培养板中感染细胞。空白对照组无干预,MRSA 组在常规培养168 h(1 周)后加MRSA 感染24 h,H1N1+MRSA 组在H1N1 感染168 h(1 周)后加MRSA 序贯感染24 h。细胞分别于第0、48、96 和144 h 换培养液,实验终点统一收集细胞。
1.7 RT-qPCR 法检测NLRP3、Caspase-1 和IL-1β的mRNA表达水平
收集上述各组细胞,用Trizol 法提取细胞总RNA,检测RNA浓度。采用ABI7500系统进行PCR反应,反应条件为:50 ℃2 min,95 ℃2 min 预变性,95 ℃15 s变性、60 ℃1 min退火,共进行40个循环,95 ℃15 s,60 ℃1 min,95 ℃30 s,60 ℃15 s 延伸。记录目的基因与内参基因的Ct 值,用mRNA=2-ΔΔCT计算mRNA相对表达量。PCR反应引物见表1。
1.8 免疫荧光检测NLRP3蛋白强度
根据操作流程完成如下步骤:40 g/L 多聚甲醛固定细胞、0.5%TritonX-100 室温通透、5%牛血清白蛋白(bovine serum albumin,BSA)封闭、孵育NL⁃RP3 一抗、孵荧光二抗、Hoechest33342 复染、加防荧光淬灭剂,之后置于激光共聚焦显微镜下观察。期间注意磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤及后期避光操作。
1.9 Western Blot法检测NLRP3的蛋白表达水平
收集各组细胞后提取总蛋白。按凯基BCA 蛋白含量检测试剂盒说明书,测定蛋白浓度。按Western Blot 步骤,转膜,封闭,一抗孵育,二抗孵育,在Chemi Scope 化学发光成像系统显影,用Im⁃age J 软件分析NLRP3 的蛋白灰度值,计算其蛋白相对表达量。
1.10 ELISA检测血清中IL-1β的浓度
根据ELISA 检测试剂盒的操作流程,空白孔及每个标准品设3 个复孔,制作标准曲线,检测细胞上清液IL-1β的浓度。
1.11 统计学方法
采用SPSS Statistics 20.0 软件统计分析。数据均符合正态性分布,以±s表示。满足方差齐性的组间比较采用单因素方差分析,有统计学意义,两两比较采用LSD 法。不符合方差齐性的组间比较采用Kruskal-WallisH检验,有统计学意义时采用Bonferroni法进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 细胞生长状态
显微镜下观察实验细胞贴壁牢固,外形为类圆形,折光率均一,实验过程中细胞继续生长,至铺满孔板接触抑制。甲流病毒感染期间细胞形态未见明显变化。各组细胞培养至1 周时仍生长良好,实验组加入MRSA 感染24 h 后可见胞周折光率稍增高(图1)。各组细胞均完成实验。
2.2 各组巨噬细胞NLRP3、Caspase-1 及IL-1β的mRNA相对表达量
NLRP3 的mRNA 表达水平各组总体分布不完全相同(H=6.286,P=0.043),MRSA 组相对空白对照组基本未见升高(P=1.00;图2A),而在H1N1+MRSA 组表达明显升高,与空白对照组、MRSA 组比较差异均有统计学意义(P均=0.026;图2A)。Caspase-1 的mRNA 表达水平各组总体分布不完全相同(H=7.048,P=0.029),MRSA 组相对空白对照组也未见明显升高(P=0.383;图2B),但在H1N1+MRSA 组较空白对照组明显升高,差异有统计学意义(P=0.009;图2B)。IL-1β 的mRNA 表达水平各组总体分布不完全相同(H=8.535,P=0.014),MRSA组较空白对照组明显升高(P=0.004;图2C),较H1N1+MRSA 组也升高,但差异没有统计学意义(P=0.211;图2C)。IL-1β 的mRNA 表达水平在H1N1+MRSA 组较空白对照组也升高,但差异没有统计学意义(P=0.118;图2C)。
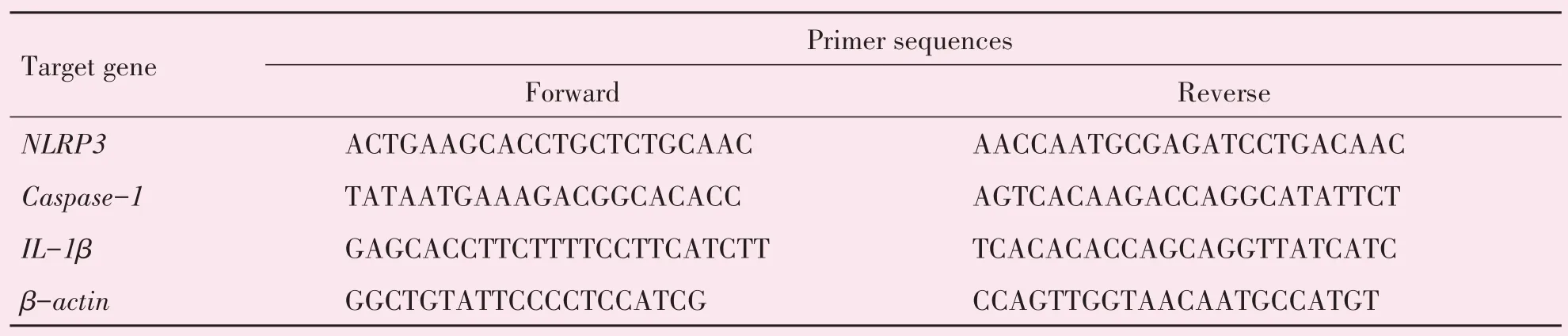
表1 NLRP3蛋白、Caspase-1和IL-1β mRNA的引物序列Table 1 Primer sequences of NLRP3,Caspase-1 and IL-1β mRNA
图1 光学显微镜下各组细胞生长状态Fig.1 Growth state of cells in each group under light microscope
2.3 各组巨噬细胞NLRP3蛋白免疫荧光强度
MRSA组巨噬细胞NLRP3蛋白免疫荧光稍增强,H1N1+MRSA组NLRP3蛋白免疫荧光强度明显高于空白对照组及MRSA组,表明H1N1+MRSA组NLRP3蛋白分布密度及范围高于空白对照组与MRSA 组,变化趋势与其mRNA表达水平相一致(图3)。
2.4 各组巨噬细胞NLRP3的蛋白相对表达量
NLRP3 的蛋白表达水平各组总体分布不完全相同(F=353.524,P=0.000),MRSA组比空白对照组未见升高(P=0.132;图4),而在H1N1+MRSA 组表达明显升高,与空白对照组、MRSA 组比较差异均有统计学意义(P均=0.000;图4)。
2.5 各组巨噬细胞上清液IL-1β浓度
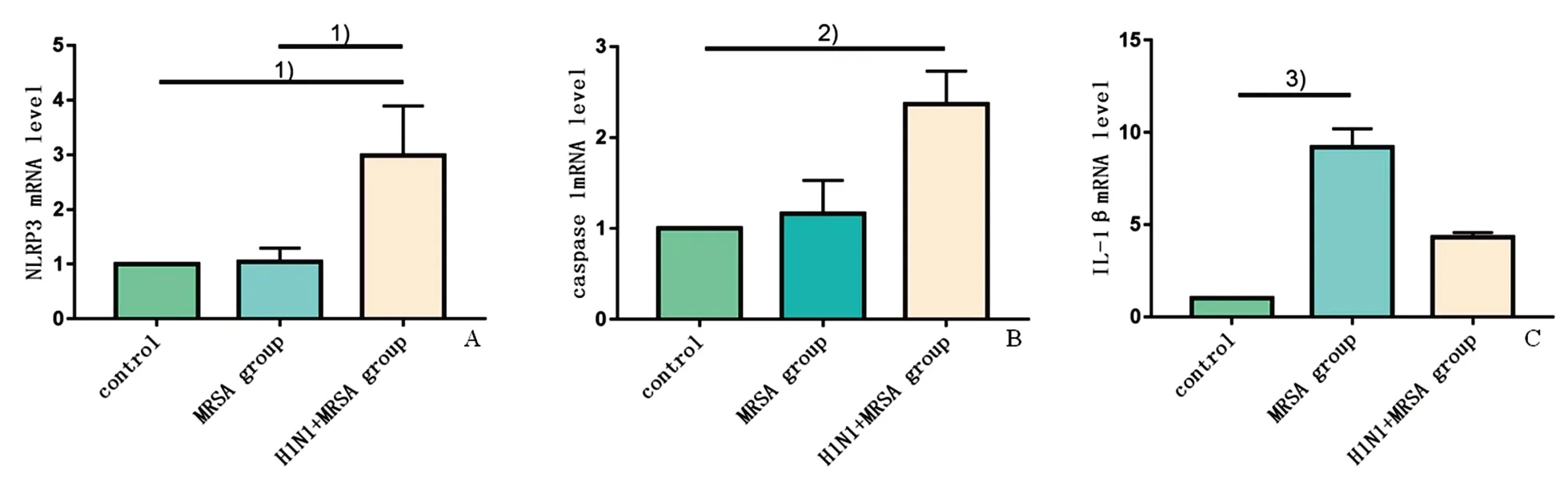
图2 荧光定量PCR检测小鼠巨噬细胞NLRP3、Caspase-1和IL-1β的mRNA相对表达量Fig.2 mRNA level of NLRP3,Caspase-1 and IL-1β detected by fluorescence RT-PCR
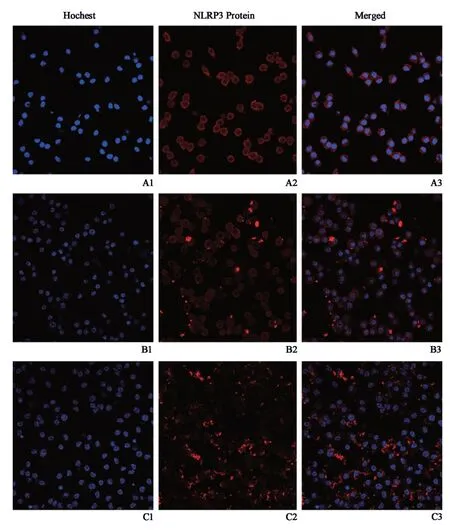
图3 免疫荧光检测小鼠巨噬细胞NLRP3蛋白密度及分布Fig.3 Density and distribution of NLRP3 protein detect⁃ed by immunofluorescence
细胞上清液IL-1β 浓度各组总体分布不完全相同(F=160.75,P=0.000),与空白对照组比,MRSA组细胞培养上清液IL-1β 浓度明显升高,H1N1+MRSA 组上清液中IL-1β 浓度也升高。同时,H1N1+MRSA 组IL-1β 浓度低于MRSA 组。两两比较的差异均有统计学意义(P分别为0.000、0.001、0.000;图5);MRSA 组和空白对照组相比,IL-1β 上清液浓度与mRNA表达水平的结果相一致。
3 讨论
甲流病毒致病机制为感染呼吸道上皮细胞及肺泡巨噬细胞等免疫细胞,引起剧烈的炎症反应。MRSA 可定植于人体鼻咽部,其主要的致病因子包括磷壁酸、肽聚糖及外毒素等,当局部或全身免疫力下降时,引起MRSA 侵袭性肺炎。甲流病毒感染患者继发MRSA 肺炎,是导致重症肺炎甚至临床死亡的主要原因。临床发现甲流病毒感染后约1 周时间是继发MRSA 肺炎的高峰期[8-10]。这些线索提示甲流病毒与MRSA 在致病及免疫应答方面存在相关性。

图4 Western blot检测小鼠巨噬细胞NLRP3的蛋白相对表达量Fig.4 Translation of NLRP3 detected by western blot
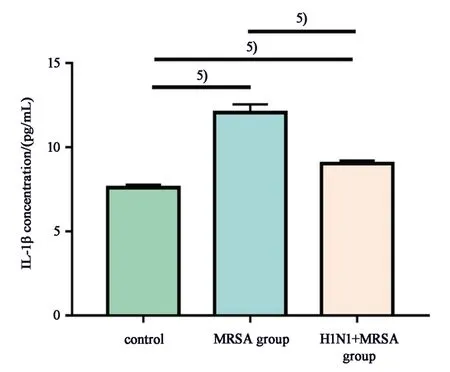
图5 ELISA检测小鼠巨噬细胞培养上清液IL-1β的浓度Fig.5 The concentrations of IL-1β in supernatant mea⁃sured by ELISA
肺泡巨噬细胞是抗甲流病毒及MRSA 感染最重要的免疫细胞,主要由Toll 样受体(Toll like receptor,TLR)、NOD 样受体(NOD like receptor,NLR)等模式识别受体识别甲流病毒及MRSA 的相应成分,介导固有免疫与特异性免疫应答[11]。
TLR 在细菌感染中作用及机制已有大量研究。如本课题组研究发现MRSA 可通过TLR2/TLR4-NF-κB 途径引起肺泡巨噬细胞坏死及肿瘤坏死因子(TNF)-α、IL-10 的释放[12-13]。NLR 在感染中的作用以NOD 样受体蛋白3(NLRP3)炎症小体研究最为深入[6]。NLRP3 炎症小体主要表达于单核巨噬细胞,是NLRP3 蛋白、凋亡相关斑点样蛋白(ASC)与半胱天冬酶1(caspase-1)形成的三聚体,诱导白介素(interleukin,IL)-1β、IL-18的释放,介导下游的炎症反应。NLRP3 炎症小体途径的IL-1β 释放需要双信号通道。第一信号为TLR 识别病原微生物及其组成成分,通过NF-κB 途径,诱导IL-1β 的基因转录和翻译,生成无活性的pro-IL-1β。第2 信号为NLRP3 炎症小体三聚体形成,自剪切无活性的caspase-1 为活化的cleaved-caspase-1,cleaved-caspase-1 剪切pro-IL-1β 为活性的IL-1β。NLRP3、caspase-1 及IL-1β 是监测该炎症小体活性及炎症反应的良好指标。
主流研究[7]认为,甲流病毒感染巨噬细胞通过NLRP3 炎症小体途径促进IL-1β 的释放。本课题组前期研究也验证,甲流病毒H1N1 感染巨噬细胞1周明显激活NLRP3炎症小体[8]。虽然也有研究发现MRSA 可通过吞噬-溶酶体途径产生的活性氧激活NLRP3 炎症小体[9],但对NLRP3 炎症小体在MRSA 感染中的作用及机制存在较多争议。Robin⁃son 等[14]研究发现,甲流病毒联合MRSA 感染小鼠,NF-κB 信号途径受到抑制,Pro-IL-1β 的产生及活性IL-1β 的释放均降低,加剧MRSA 肺炎,但该研究未进一步揭示NLRP3炎症小体在其中的作用。
分析本实验结果,MRSA 组比空白对照组IL-1β 的mRNA 表达及上清液浓度均明显升高,是MRSA 感染引起严重肺炎的分子机制。但MRSA组NLRP3、caspase-1 的mRNA 表达均没有增强,NLRP3 蛋白免疫荧光强度也未见明显增强,west⁃ern blot 检测NLRP3 的蛋白表达量没有增加,表明MRSA感染巨噬细胞24 h引起IL-1β的转录及分泌并不依赖NLRP3 炎症小体途径。研究[14-15]发现金葡菌联合甲流病毒感染引起肺泡上皮细胞从凋亡向坏死性改变,并不是NLRP3 炎症小体介导的焦亡。而我们前期究已发现MRSA 感染引起巨噬细胞坏死性改变是由TLR 信号途径介导[12-13]。Richa等[16]发现金黄色葡萄球菌中枢神经感染由ASC 而不是NLRP3 介导炎症反应及保护作用。本研究结果与上述研究结论相一致。
进一步分析实验结果,甲流病毒预感染后继发MRSA 感染,NLRP3、caspase-1 的mRNA 表达均有增强,NLRP3蛋白免疫荧光密度及分布也明显增加、增多,western blot 检测NLRP3 的蛋白表达量明显增加,上清液中IL-1β 浓度也升高,表明NLRP3炎症小体信号通路的激活。但甲流病毒预感染组与单纯MRSA感染相比,虽然NLRP3的mRNA表达量、免疫荧光密度及蛋白表达量均增强,但IL-1β的mRNA 表达及上清液浓度均降低。综上结果表明,甲流病毒H1N1 预感染1 周继发MRSA 感染虽然激活了NLRP3 炎症小体通路,但总体上降低了MRSA 感染引起的IL-1β 的表达。推论可能的机制为甲流病毒预感染激活NLRP3 炎症小体第一信号通路的TLR17,竞争性抑制了巨噬细胞抗MRSA免疫的TLR2、TLR4信号通路,总体上降低了巨噬细胞对MRSA 的免疫反应。有观察到类似现象的研究,甲流病毒感染抑制吞噬细胞NADPH 氧化酶依赖的细菌清除作用,增加了继发MRSA 感染的易感性[5]。同时,因为IL-1β 是炎症反应重要的上游促炎症细胞因子,IL-1β 表达及分泌下降削弱了机体免疫强度及对MRSA 的清除能力,该效应可能是甲流病毒感染易继发MRSA 肺炎的机制之一。
综上所述,本实验发现MRSA 感染肺泡巨噬细胞引起IL-1β的释放不依赖NLRP3炎症小体途径,甲流病毒预感染降低了巨噬细胞抗MRSA 免疫IL-1β 的表达,该效应可能是甲流病毒感染易继发MRSA 肺炎的机制之一。同时,NLRP3 炎症小体在机体发生甲流病毒感染继发MRSA 肺炎时的具体作用、机制以及信号网络如何,关于TLR17与TLR2、TLR4信号通路的推论,都将有待于进一步的研究明确。
