雪莲注射液对重症急性胰腺炎患者的治疗作用
2020-08-17钱晶王小红蓝宇
钱晶,王小红,蓝宇
急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症之一,其以轻症多见,病程呈自限性,其中10%~30%的患者会进展为重症急性胰腺炎(severe acute pancreatitis,SAP)[1]。SAP病情进展快,病情危重,常并发多脏器功能不全综合征,病死率高达20%~30%[2],给家庭和社会带来沉重负担。因此,探索SAP 的发病机制,寻找有效的治疗药物尤为重要。研究表明,AP的严重程度取决于炎症反应及胰蛋白酶激活的状况,自噬受损则可能会促进胰腺腺泡细胞内胰蛋白酶原的激活以及炎症反应的加剧[3-4]。本课题组前期实验结果表明,雪莲注射液对SAP 大鼠有确切的治疗作用[5-6]。目前有关雪莲注射液治疗SAP患者的临床报道尚少见。本研究旨在探讨雪莲注射液对SAP 的临床治疗作用及其作用机制。
1 资料与方法
1.1 一般资料 选择2018 年6 月—2019 年9 月在南京鼓楼医院集团仪征医院普通外科及消化科住院治疗的SAP患者。纳入标准:(1)按照《中国急性胰腺炎诊治指南(2013,上海)》标准确诊AP[7]。SAP的诊断标准为具备AP的临床表现和生物化学改变,须伴有持续的器官功能衰竭,即持续48 h 以上且不能自行恢复的呼吸系统、心血管或肾脏功能衰竭,可累及1个或多个脏器。(2)发病24 h内入院。排除标准:(1)慢性疾病临终状态者。(2)合并外伤、免疫缺陷病、严重心血管疾病、终末期肝肾疾病、恶性肿瘤者,以及孕妇、哺乳期妇女。(3)近3个月内使用激素或免疫抑制剂者。(4)存在严重慢性脏器功能障碍,患者正进行有可能干扰本研究的其他治疗。(5)病因含有医源性或正在进行有可能干扰本研究的其他治疗。(6)临床研究期间死亡或未能执行完整治疗方案者。纳入符合上述条件的SAP患者50例,其中男27例,女23例;年龄28~72 岁,平均(52.78±13.55)岁。采用随机数字表法将其分为常规治疗组25例和常规治疗+雪莲注射液治疗组(雪莲注射液组)25 例。另择同期健康体检志愿者25 例为正常对照组。正常对照组、常规治疗组和雪莲注射液组年龄分别为(54.20±13.22)、(51.36±14.00)、(51.80±13.39)岁,男女分别是15/10、12/13、14/11例,3组年龄(F=0.320)、性别(χ2=0.753)比较差异均无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,获患者或家属知情同意并签署知情同意书。
1.2 治疗方法 常规治疗组患者住院后即给予禁食、水,胃肠减压、生长抑素(瑞士Merck Serono SA Aubonne Branch 公司产品,3 mg/支)抑制胰液分泌,乌司他丁(广东天普生化医药股份有限公司产品,10万U/支)抑制胰酶,雷贝拉唑(江苏奥赛康药业股份有限公司产品,20 mg/支)抑制胃酸,导泻、消胀、止痛、抗感染及营养支持等治疗。雪莲注射液组在常规治疗的基础上,给予0.5%雪莲注射液(新疆西域药业有限公司产品,2 mL/支,含总黄酮10 mg/支,国药准字号为Z65020023)4 mL,肌内注射,每日1 次,连用10 d。正常对照组不给予任何治疗。
1.3 观察指标 (1)自噬及炎性因子。治疗前及治疗后10 d晨起空腹抽取受检者外周静脉血,采集的血液标本常温下静置2 h,然后高速离心机4 ℃下以3 000 r/min 离心15 min,取上清液,分装入EP 管中,放置入-80 ℃冰箱内保存。采用双抗体夹心酶联免疫吸附试验(ELISA)[8]检测血清Beclin-1、微管相关蛋白1轻链3(LC3)水平,试剂盒购自武汉优尔生科技股份有限公司;采用ELISA[9]检测血清核因子(NF)-κB p65、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β及IL-10水平,试剂盒购自深圳晶美生物工程有限公司,具体操作步骤按试剂盒说明书进行。(2)急性生理与慢性健康评分(APACHE)Ⅱ和胰腺改良CT 严重指数评分(MCTSI)。采用APACHEⅡ评分[10]评估 AP 病情变化及预后,胰腺 MCTSI 评分[11]评估SAP炎症反应及胰腺坏死程度。(3)记录常规治疗组、雪莲注射液组患者的住院时间及腹痛缓解时间。
1.4 统计学方法 采用SAS 8.2 统计软件进行统计学处理。计量资料以均数±标准差()表示,3 组间比较采用单因素方差分析,组间多重比较行LSD-t检验;2组间比较采用独立样本t检验;各组治疗前后各指标比较采用重复测量资料的方差分析,组内不同时间点各指标比较采用Profile 法,同一时间点各指标2 组间比较采用Lsmeanst法;计数资料以例(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3 组自噬及炎性因子水平比较 治疗前,常规治疗组和雪莲注射液组患者血清Beclin-1、LC3、NF-κB p65、TNF-α、IL-1β 和IL-10 水平均明显高于正常对照组(P<0.05),常规治疗组与雪莲注射液组差异均无统计学意义(P>0.05);与治疗前比较,治疗后10 d 常规治疗组和雪莲注射液组血清Beclin-1、LC3、NF-κB p65、TNF-α 和IL-1β 水平明显降低,IL-10水平明显升高(P<0.05)。治疗后10 d雪莲注射液组血清Beclin-1、LC3、NF-κB p65、TNF-α和IL-1β 水平低于常规治疗组,IL-10水平高于常规治疗组(P<0.05),见表1。
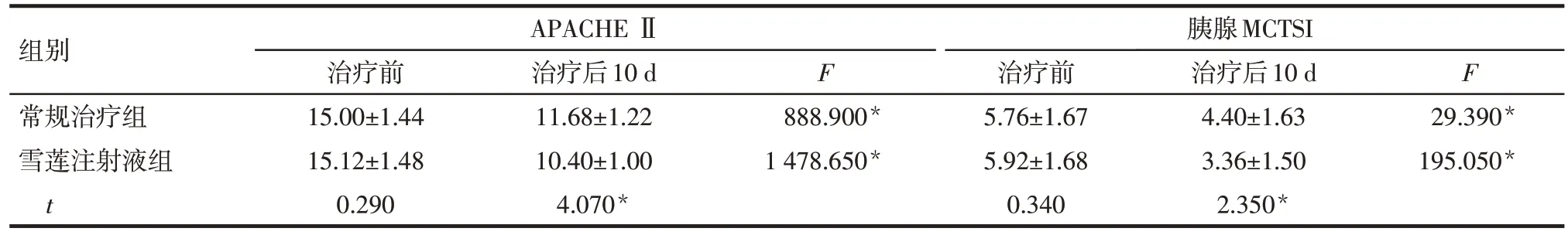
2.2 常规治疗组与雪莲注射液组APACHEⅡ、胰腺MCTSI 评分比较 治疗前,雪莲注射液组与常规治疗组APACHEⅡ、胰腺MCTSI 评分差异均无统计学意义(P>0.05);与治疗前比较,治疗后10 d 常规治疗组和雪莲注射液组APACHEⅡ、胰腺MCTSI 评分均明显降低。治疗后10 d 雪莲注射液组APACHEⅡ、胰腺MCTSI 评分均低于常规治疗组(P<0.05),见表2。
2.3 常规治疗组与雪莲注射液组住院时间、腹痛缓解时间比较 雪莲注射液组患者住院时间和腹痛缓解时间分别为(17.84±2.88)d、(5.36±0.81)d,明显低于常规治疗组的(22.16±3.26)d、(7.52±1.09)d(t分别为4.960、8.090,P<0.05)。
3 讨论
目前AP的发病机制尚未阐明,研究认为炎症反应及胰腺腺泡细胞异常自噬对AP 的发生发展具有重要作用。受损的胰腺腺泡细胞可释放多种炎性因子,从而产生炎性细胞浸润及细胞炎性因子间的级联放大效应,导致胰腺腺泡细胞的坏死[12-13]。自噬与炎症反应密切相关,自噬受损,炎性小体不能被及时清除,导致炎性小体过度堆积,诱导IL-1β表达水平上调,上调的IL-1β 进一步加重自噬受损并且促进了胰蛋白酶原的激活,从而导致AP 的发生发展[14]。
Beclin-1 基因也称BECN1 基因,是酵母自噬相关基因6 的同系物,也是哺乳动物参与自噬的特异性基因。 Beclin-1 与磷酸肌醇 3 激酶(phosphoinositide-3-kinase,PI3K)结合是自噬中自噬体形成的起始条件。LC3 是公认的自噬体标志物,可在一定程度上反映自噬体的数量[15]。作为Rel蛋白家族的转录调节子,NF-κB是由5个亚基(p50、p52、p65、c-Rel、Rel B)组成的同源或异源二聚体,而NF-κB p65 是其主要亚基。在正常生理条件下,NF-κB与κB抑制剂(inhibitor of the kappa B,IκB)蛋白家族成员结合而失活。通过细胞刺激启动细胞内第二信使系统可以诱导IκB磷酸化或酸化,导致IκB从NF-κB 中降解和分离,进一步激活NF-κB,使其从细胞质迁移到细胞核,并与DNA启动子区域中相应靶基因的结合位点结合,从而产生一系列与免疫炎症反应相关的基因转录程序,同时诱导包括TNF-α、IL-1β 及IL-6 在内的多种促炎细胞因子的高表达。NF-κB 激活使p65 磷酸化,使其从细胞质迁移到细胞核,并在其中进一步调节转录。IL-10可以通过抑制NF-κB 的活性及其与DNA 结合能力来阻止NF-κB启动相关促炎因子基因的转录,而NF-κB通路是参与调节人体炎症反应的重要信号通路[16]。
Tab.1 Comparison of serum levels of Beclin-1,LC3,NF-κB p65,TNF-α,IL-1β and IL-10 between three groups表1 3组血清Beclin-1、LC3、NF-κB p65、TNF-α、IL-1β和IL-10水平比较 (n=25,)

Tab.1 Comparison of serum levels of Beclin-1,LC3,NF-κB p65,TNF-α,IL-1β and IL-10 between three groups表1 3组血清Beclin-1、LC3、NF-κB p65、TNF-α、IL-1β和IL-10水平比较 (n=25,)
*P<0.05;a与正常对照组比较,b与常规治疗组比较,P<0.05;F1为同一组别治疗前、后比较;F2为3组治疗前比较,t为常规治疗组与雪莲注射液组治疗后比较
组别正常对照组常规治疗组雪莲注射液组F2或t LC3(μg/L)Beclin-1(μg/L)治疗前0.14±0.02 0.71±0.08a 0.71±0.08a 543.790*治疗后10 d-0.43±0.04 0.33±0.04b 9.750*F1 F1 F1 1 995.440*3 547.780*治疗前0.15±0.02 0.92±0.08a 0.91±0.08a 1 114.440*治疗后10 d-0.59±0.04 0.49±0.04b 9.737*2 722.840*4 561.560*NF-κB p65(mg/L)治疗前10.86±1.39 41.50±3.67a 41.48±3.77a 495.030*治疗后10 d-29.13±2.93 22.92±3.72b 7.698*6 753.080*112 028.000*组别正常对照组常规治疗组雪莲注射液组F2或t IL-1β(mg/L)IL-10(mg/L)TNF-α(mg/L)治疗前12.56±1.43 60.89±6.96a 61.49±7.25a 564.320*治疗后10 d F1 F1 F1 47.38±4.41 36.36±4.39b 10.563*697.390*1 919.840*治疗前2.51±0.85 6.52±1.49a 6.68±1.54a 52.970*治疗后10 d-5.60±1.55 4.61±1.50b 2.624*409.190*4 526.300*治疗前9.88±1.18 13.14±1.92a 13.36±1.98a 371.100*治疗后10 d-21.17±1.91 29.74±1.68b 17.493*35 921.900*26 380.000*
Tab.2 Comparison of APACHEⅡand pancreas MCTSI scores between two groups表2 常规治疗组与雪莲注射液组APACHEⅡ、胰腺MCTSI评分比较 (n=25,分,)
Tab.2 Comparison of APACHEⅡand pancreas MCTSI scores between two groups表2 常规治疗组与雪莲注射液组APACHEⅡ、胰腺MCTSI评分比较 (n=25,分,)
*P<0.05
组别常规治疗组雪莲注射液组t APACHE Ⅱ胰腺MCTSI治疗前15.00±1.44 15.12±1.48 0.290治疗后10 d 11.68±1.22 10.40±1.00 4.070*F F 888.900*1 478.650*治疗前5.76±1.67 5.92±1.68 0.340治疗后10 d 4.40±1.63 3.36±1.50 2.350*29.390*195.050*
研究表明,NF-κB信号通路参与了SAP的发生、发展[17]。Yang 等[18]研究发现,抑制 NF-κB 信号通路,导致Beclin-l 及LC3Ⅱ表达水平下降,自噬空泡形成减少,AP严重程度减轻。自噬抑制剂3-甲基腺嘌呤通过调节NF-κB 信号通路和蛋白酶-1-IL-1β信号通路来减弱自噬通量并减轻炎症反应,从而降低炎性因子水平,减少对器官的损伤[19]。本研究结果显示,SAP 患者入院时血清Beclin-1、LC3、NF-κB p65、TNF-α、IL-1β、IL-10 均较正常对照组明显升高,提示炎症反应NF-κB信号通路及胰腺腺泡细胞异常自噬参与SAP 的发生发展,与以往文献报道一致。
雪莲注射液是从天山雪莲中提取的以雪莲黄酮为主要成分的纯中药单方制剂,具有抗氧化、抗炎和免疫调节等作用,且无明显毒性和不良反应[20]。本课题组前期动物实验研究发现,雪莲注射液可通过抑制SAP大鼠NF-κB信号通路的激活,调节细胞因子的合成与释放,从而减轻胰腺损伤;其可通过激活PI3K/蛋白激酶B 信号通路,改善脑微循环,从而对大鼠SAP并发脑损伤具有治疗作用[5-6]。
本研究结果显示,与治疗前比较,治疗后10 d常规治疗组和雪莲注射液组血清Beclin-1、LC3水平明显降低,且雪莲注射液组血清Beclin-1、LC3 水平低于常规治疗组,提示雪莲注射液具有抑制SAP 患者胰腺腺泡细胞异常自噬的作用;另外,与治疗前比较,治疗后10 d 常规治疗组和雪莲注射液组血清NF-κB p65、TNF-α 和IL-1β 水平明显降低,IL-10水平明显升高;且雪莲注射液组血清NF-κB p65、TNF-α 和IL-1β水平低于常规治疗组,IL-10水平高于常规治疗组,提示雪莲注射液具有抑制SAP 患者炎症反应NF-κB信号通路的作用。此外,治疗后雪莲注射液组APACHEⅡ及胰腺MCTSI评分下降幅度均高于常规治疗组,且住院时间和腹痛缓解时间均低于常规治疗组,提示雪莲注射液对SAP 患者有较好的辅助治疗作用。
综上所述,雪莲注射液可能通过抑制胰腺腺泡细胞异常自噬,阻断NF-κB 信号通路,进一步抑制炎症反应,从而对SAP患者发挥辅助治疗作用。
