体外膜肺氧合在严重气管狭窄及复杂气管病变手术中的应用效果
2020-08-17郭权威钟承华李斌王成颜峻况军莫益俊张建华
郭权威,钟承华,李斌,王成,颜峻,况军,莫益俊,张建华
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是一种特殊方式的体外循环,其可将血液从静脉引出,经过膜肺氧合后排出二氧化碳而形成动脉血,另在泵的推动下回到静脉或动脉,常用于体外呼吸支持及心脏支持[1]。目前,临床针对气管狭窄常用的手术方式包括气管端端吻合术[2]、气管切开造口术[3]、T型硅胶管置入术[4]等,其中气管端端吻合术被认为是最直接有效的治疗手段[5]。一般情况下,患者在气管端端吻合术前均给予镇静药物,然后在气管镜下插管到气管狭窄近端,在气管切除远端插入另一套气管插管以保证通气,然后切除病变气管,在术野气管插管不受影响的情况下行气管后壁吻合,而后拔除术野气管插管,将经口气管插管越过吻合口送至气管远端,最后吻合气管前壁,闭合气管管腔,吻合口处包埋[6]。常规方法虽步骤繁琐,但技术成熟,但对于严重气管狭窄不能耐受麻醉诱导气管插管且无法在术前建立人工气管的患者无法采用常规麻醉手术方式。对于复杂气管病变手术,如何保证患者在不缺氧、术野不受影响的情况下实施手术是临床的难点。本研究旨在探讨ECMO在严重气管狭窄及复杂气管病变手术中的应用效果,现报道如下。
1 对象与方法
1.1 研究对象 选取2013年9月—2017年5月南方医科大学深圳医院和兰州大学第二医院收治的严重气管狭窄及复杂气管病变患者8例,术前均行颈部及胸部CT+三维检查以明确气管病变的部位、长度及气管狭窄程度,并行纤维支气管镜检查以了解管腔情况、狭窄程度、瘘口大小及病变距离声门或隆突的距离。纳入标准:(1)气管狭窄分级≥4级,并存在不同程度的肺部炎症、哮鸣、喘鸣或呼吸困难症状;(2)气管瘘合并食管瘘等复杂气管病变患者。排除未接受颈部、胸部CT或气管镜检查,临床资料不全的患者。8例患者中男4例,女4例;年龄28~56岁,平均(42.8±10.7)岁;气管病变长度为23~40 mm,平均(29.6±5.9)mm;气管最狭窄处直径为2~6 mm,平均(3.6±1.3)mm;病变距声门距离为10~75 mm,平均(41.1±22.6)mm;诱因:创伤5例,气管肿瘤2例,口服农药1例;气管狭窄分级[7]:4级(气管狭窄率为76%~90%)2例,5级(气管狭窄率>90%)5例。8例患者临床资料详见表1。
1.2 方法 病例1、3、4、6:患者气管狭窄严重,为避免常规气管插管致气管梗阻而出现窒息,先在局部麻醉下游离右股动静脉,插管成功后开启ECMO支持,待血氧饱和度处于参考范围内后行静脉麻醉,并根据病变位置及长度决定半劈胸骨(病例1、6)或全劈胸骨(病例3、4)以充分暴露病变气管,切除狭窄气管环并行气管端端吻合术,吻合完毕后将气管插管越过吻合口,并使球囊上端位于吻合口下至少2 cm,结束转机,4例患者ECMO时间分别为70、76、69、64 min。
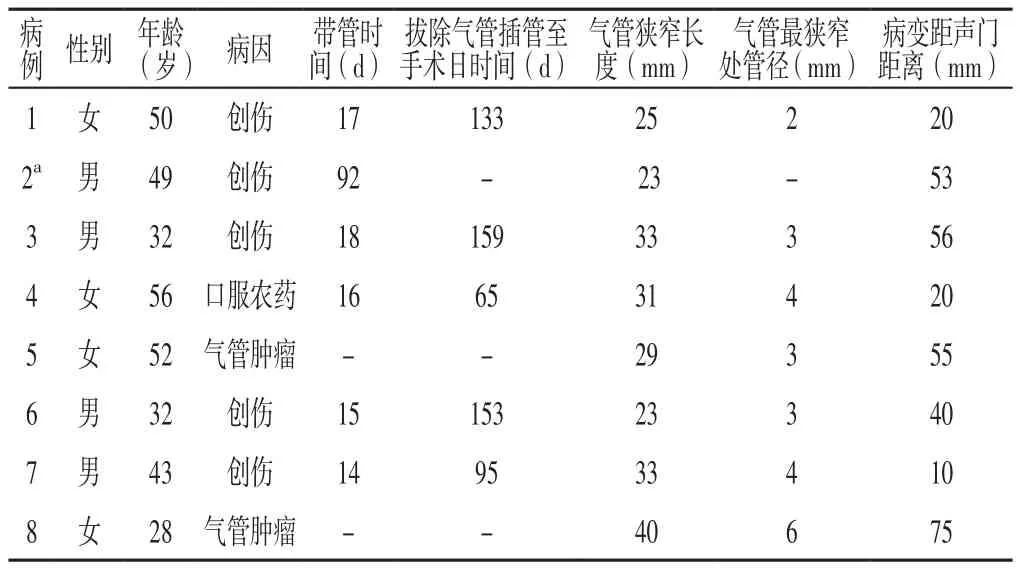
表1 8例患者临床资料情况Table 1 Clinical data of 8 cases of patients
病例2:患者已行气管切开,先常规进行麻醉再全劈胸骨以暴露病变气管,游离气管食管的同时建立右股动静脉ECMO管道,欲拔除气管插管时开始转机,待患者血氧饱和度恢复至参考范围内后切除气管瘘口处气管,暴露食管瘘口,然后予以修补缝合,待食管修补满意后行气管端端吻合术,吻合完毕后将气管插管送至吻合口下端,并使球囊上端位于吻合口下2 cm以上,结束转机,ECMO时间为89 min,最后缝合气管切口。
病例5、8:患者存在气管肿瘤,为避免常规气管插管致瘤体脱落而导致气管梗阻及窒息,故在局部麻醉下建立右股动静脉ECMO管道后转机,病例5自胸骨上窝半劈胸骨,病例8经右侧后外侧切口进胸,充分暴露气管肿瘤并切除瘤体行气管端端吻合术,病例5吻合完毕后气管插管越过吻合口,并使球囊上端位于吻合口下2 cm以上;病例8因吻合口距离隆突较近,吻合完毕后气管插管位于吻合口上端,并使球囊下端位于吻合口上2 cm以上,结束转机,2例患者ECMO时间分别为63、121 min,术后病理检查均提示为腺样囊性癌。
病例7:患者先在局部麻醉下建立右股动静脉ECMO管道后转机,待其血氧饱和度恢复至参考范围内后行静脉麻醉,术中游离颈部气管,经探查可见狭窄上段位于甲状软骨后方,术中邀请耳鼻喉科医师会诊后认为气管狭窄处位置较高,考虑无法行气管端端吻合术,遂于气管狭窄下方行气管切开以维持正常呼吸,转机时间为47 min。
2 结果
2.1 近期预后 本组8例患者均接受手术治疗,病例1、3、4、5、6、8恢复良好并出院,病例3术后出现胸骨愈合不良,经对症处理后愈合出院;病例2术后20 d死亡,原因为该患者创伤后致高位截瘫,无咳嗽反射,虽气管吻合口及食管瘘口愈合良好,但因肺部严重感染而无法脱机,医疗费用高,患者家属于术后20 d放弃治疗,最终患者因呼吸衰竭而死亡;病例7仅行探查术,原因为气管狭窄上段位于甲状软骨后方,术中邀请耳鼻喉科医师会诊后认为气管狭窄处位置较高,考虑无法行气管端端吻合术。
2.2 远期预后 随访2年7个月~6年3个月,病例1、3、4、6均未出现气管再次狭窄;病例5、8术后均予以含铂双药化疗,其中病例8因瘤体靠近隆突,虽瘤体下切缘病理检查阴性但仍预防性给予放疗,随访至今未见气管狭窄及肿瘤复发;病例7因气管狭窄位置较高,本院胸外科及耳鼻喉科未能行气管端端吻合术,后就诊于外院耳鼻喉科行气管甲状软骨吻合术,术后随访3年11个月未出现气管狭窄。
3 讨论
气管狭窄主要由于颈部创伤和医源性损伤所致,其中以气管插管和气管切开最为常见[3]。临床工作中,在严重创伤、药物中毒患者的抢救、呼吸衰竭及复杂外科手术后均需行呼吸机辅助通气,但长时间佩戴气管插管、气管切开或护理不当者在拔管后可能出现气管狭窄[8]。本组病例中长期带管或气管插管护理不当致气管病变6例,其中致气管狭窄5例,带管时间14~18 d;致食管气管瘘1例,其带管已92 d,拔管后至本次手术日时间为65~159 d。谢冬等[6]研究表明,预计气管插管时间超过1周者需尽早行气管切开,长时间留置气管插管或气管切开者需警惕气管狭窄发生,而气管狭窄症状首次出现常在拔管后3~6周。本组有两例为原发性气管肿瘤,但其发病率较低,仅占上呼吸道肿瘤的2%[9]。
针对严重气管狭窄患者,任何气管操作均可能增加缺氧程度而导致窒息,如果盲目麻醉诱导、强行气管插管可能进一步加重气管狭窄程度,甚至造成气管完全阻塞,患者如出现严重缺氧可导致心脏和呼吸骤停。因此,如何建立安全高效的气体交换是治疗气管狭窄的关键。GOYAL等[10]研究表明,在气管狭窄较严重而无法实施气管插管且无高频通气设备时,ECMO支持下进行紧急手术是比较安全的选择,其可及时维持患者呼吸功能,顺利渡过麻醉诱导期。ECMO的优点:首先,术前可避免气管插管风险,为安全麻醉创造条件;其次,可保障患者术中血氧饱和度处于参考范围,提供清晰的术野和手术空间,利于操作,失血可回输(肿瘤病变患者除外),避免因缺氧出现窒息、心脏骤停及脑水肿,提高了气管插管手术成功率;最后,对于肺功能严重受损患者,术后还可进行长期的肺脏支持[11-13]。
本组8例患者均为较重气管病变,除食管气管瘘患者已行气管切开并呼吸机辅助通气外,其他7例患者均是在局部麻醉中下行右股动静脉插管建立ECMO,转机后成功行麻醉诱导,进一步证实ECMO支持下行麻醉诱导是安全有效的。
1965年NEVILE等[14]首次报道了体外循环在胸外科手术中的应用,该技术日益成熟,现已被成功地应用于多种需要阻断血流或提供有效气体交换的复杂外科手术中,使既往胸外科无法切除的晚期食管癌、肺癌、严重气管狭窄及复杂气管病变等手术的完成得以实现[12]。在体外循环支持下,术中无需反复更换气管插管,可将支气管任意开放,术者可在无血条件下进行手术操作,同时还能减少剥离压迫肿瘤或应用手术器械而导致的肿瘤细胞血行播散的概率,有效降低手术风险,进而为复杂外科手术提供了有效的保障,扩大了手术适应证。因体外循环建立过程复杂,需使用较多的血液制品和抗凝药物,且可能会对血细胞造成损伤,而ECMO技术可解决这一问题。本组8例患者均为较重气管病变,尤其是病例2和病例8,病例2因食管气管均存在较大瘘口,且食管位于气管下方,在处理食管瘘口时难度大;病例8因患者气管肿瘤距离隆突较近,病变长度较长,切除后重建的难度大,而ECMO技术保障了患者术中氧合,使得术野基本处于无血状态,避免了气管插管的影响,使得气管病变切除、气管重建顺利完成[13]。
对于疑难危重的气管病变患者,胸外科、麻醉科、耳鼻喉科及体外循环团队术前应常规进行多学科讨论,术中密切协作。本组病例7因病变位置靠近喉部,胸外科医师团队对喉部结构不熟悉,同时本院耳鼻喉科医师鲜做此类手术,最终未能在本院接受气管甲状软骨吻合术。
当患者肺功能严重受损且对呼吸机等常规治疗无效时,ECMO可替代肺组织进行气体交换,使肺处于休息状态,为患者的康复赢得宝贵时间[15]。笔者所在团队将ECMO技术应用于大咯血致气管梗阻需紧急抢救患者,即使患者气管完全被血凝块阻塞也能够保证氧合,使得麻醉诱导安全可靠,术中还可保证机体血液循环稳定,使术者从容完成出血肺叶切除术,从而避免了术前出现血凝块完全阻塞气管造成窒息、常规麻醉无法进行、术中需反复调整气管插管位置及缺氧致脑水肿的难题,术后待患者肺出血及感染等控制后再脱机,治疗效果良好。
综上所述,ECMO技术在严重气管狭窄及复杂气管病变患者中应用安全可行;但ECMO技术存在一定局限性,如需要ECMO设备、配置专业的医护人员、医疗费用高等,若使用不当则可能出现出血或血栓形成、感染、肾功能不全、插管侧肢体缺血坏死等并发症,因此,临床可通过加强ECMO技术及ECMO团队人员培训,细化ECMO带机状态下的凝血功能检测与护理管理,尤其是并发症的预防等。
作者贡献:郭权威进行文章的构思与设计,撰写论文;钟承华、李斌、王成、颜峻、况军进行研究的实施与可行性分析;李斌、颜峻、莫益俊进行数据收集、整理、分析;况军进行结果分析与解释;钟承华进行论文的修订,负责文章的质量控制及审校;张建华对文章整体负责,监督管理。
本文无利益冲突。
