慢性阻塞性肺疾病急性加重期患者出院后30 d内再入院的影响因素分析及Nomogram模型构建
2020-08-17周寅川荣蓉黄祎丹李业彪
周寅川,荣蓉,黄祎丹,李业彪
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以气道不完全可逆性气流受限为特征的肺部慢性疾病,与肺部、体循环及免疫反应有,是全球慢性病发病、死亡的主要原因之一[1]。据统计,2013年我国COPD死亡人数达910 809例,占全球COPD病死总人数的31.1%[2]。急性加重是COPD患者住院、死亡的主要原因[3-4],且慢性阻塞性肺疾病急性加重期(acute exacerbations of chronic obstructive pulmonary disease,AECOPD)患者在出院 30 d 内有继发性加重风险,存在再入院的可能[5]。目前炎性反应在AECOPD中的潜在作用机制虽尚不完全明确,但临床常采用白细胞计数(WBC)[6]、红细胞沉降率(ESR)[7]、C反应蛋白(CRP)[8]评估COPD患者炎症程度。外周血中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、淋巴细胞与单核细胞比值(LMR)及白蛋白与球蛋白比值(AGR)作为炎性反应标志物常用于评估恶性肿瘤患者预后[9],近年临床开始将其用于评估AECOPD患者严重程度及预后[10-12],但由于缺乏有效的统计学方法而致使炎性反应标志物或炎性因子在AECOPD患者中的应用并不充分。Nomogram模型是通过整合不同变量生成的一个直观评分系统,可优化个体预测精度,目前被广泛应用于多种疾病预后的评估[13-14]。本研究旨在探讨AECOPD患者出院30 d内再入院的影响因素,并构建Nomogram模型,以为临床诊疗提供参考。
1 对象与方法
1.1 对象与方法 选取广东医学院附属厚街医院2017年2月—2019年2月收治的AECOPD患者286例为试验组,均符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》[15]中的AECOPD诊断标准。纳入标准:(1)年龄>18岁;(2)急性发作时间≤72 h;(3)戒烟至少1年以上。排除标准:(1)因肺结核、支气管扩张等导致肺组织结构严重受损者及合并支气管哮喘者;(2)合并COPD以外肺部炎症性疾病者;(3)住院期间死亡者;(4)合并恶性肿瘤者;(5)近期有手术史、严重肝肾疾病者。根据患者出院30 d内是否再入院治疗将试验组分为再入院亚组(n=128)及未再入院亚组(n=286)。另采用相同的纳入与排除标准选取广东省农垦中心医院2017年1月—2019年1月收治的AECOPD患者128例作为外部验证组。本研究经广东医学院附属厚街医院、广东省农垦中心医院医学伦理委员会审核批准,且患者对本研究知情并签署知情同意书。
1.2 方法 收集患者入院24 h内临床资料及出院30 内再入院情况,临床资料包括性别、年龄、吸烟史(每日吸烟3支及以上,且持续时间为1年及以上)、COPD评估测试(COPD assessment test,CAT)评分、基础疾病(包括冠心病、高血压、脑梗死、糖尿病)、血红蛋白(Hb)、红细胞分布宽度(RDW)、平均血小板体积(MPV)、血小板分布宽度(PDW)、WBC、ESR、CRP、NLR、PLR、LMR、AGR。其中CAT主要通过评估咳嗽、咳痰、胸闷、睡眠、精力、情绪和活动能力而分析疾病对患者的影响,每项评分为0~5分,CAT评分范围为0~40分。CAT评分越高表明患者疾病越严重[15]。再入院治疗主要因患者自出院起病情再次恶化,出现呼吸系统症状并恶化连续2 d以上,需入院进行药物干预治疗。
1.3 统计学方法 采用SPSS 21.0统计学软件进行数据处理。计数资料分析以相对数表示,组间比较采用χ2检验;计量资料以(± s)表示,组间比较采用两独立样本t检验;绘制受试者工作特征曲线(ROC曲线)以评估相关变量对AECOPD患者出院30 d内再入院的最佳截断值;采用多因素Logistic回归分析AECOPD患者出院30 d内再入院的影响因素,采用R版3.5.2中的“rms”软件包构建预测AECOPD患者出院30 d内再入院的Nomogram模型并进行外部验证,计算一致性指数(CI)。以P<0.05为差异有统计学意义。
2 结果
2.1 外部验证组与试验组临床资料比较 试验组患者Hb、CRP低于外部验证组,PDW高于外部验证组,差异有统计学意义(P<0.05);两组患者性别、年龄、吸烟史、CAT评分、冠心病发生率、高血压发生率、脑梗死发生率、糖尿病发生率、RDW、MPV、WBC、ESR、NLR、PLR、LMR、AGR及出院30 d再入院率比较,差异无统计学意义(P>0.05,见表1)。
2.2 再入院亚组与非再入院亚组临床资料比较 再入院亚组患者年龄大于非再入院亚组,有吸烟史者占比、CAT评分≥30分者占比、冠心病发生率、糖尿病发生率、RDW、WBC、ESR、CRP、NLR、PLR高于非再入院亚组,Hb、LMR、AGR低于非再入院亚组,差异有统计学意义(P<0.05);两组患者性别、高血压发生率、脑梗死发生率、MPV、PDW比较,差异无统计学意义(P>0.05,见表2)。
2.3 预测价值 将表2中有统计学差异的计量资料进行二分类转化,ROC曲线结果显示,年龄、Hb、RDW、WBC、ESR、CRP、NLR、PLR、LMR、AGR 预测AECOPD患者出院30 d内再入院的曲线下面积(AUC)分别为0.783、0.715、0.690、0.749、0.698、0.729、0.914、0.758、0.690、0.822,最佳截断值分别为69岁、12 g/dl、19.7%、9×109/L、19.9 mm/1 h、2.2 mg/dl、3.5、146.9、2.7、1.4(见图1、表3)。
2.4 多因素Logistic回归分析 将表2中有统计学意义的指标作为自变量,是否再入院作为因变量(变量赋值见表4)行多因素Logistic回归分析,结果显示,CAT评分≥30分、糖尿病、CRP≥2.2 mg/dl、NLR≥3.5、PLR≥146.9、AGR<1.4是AECOPD患者出院30 d内再入院的独立危险因素(P<0.05,见表5)。
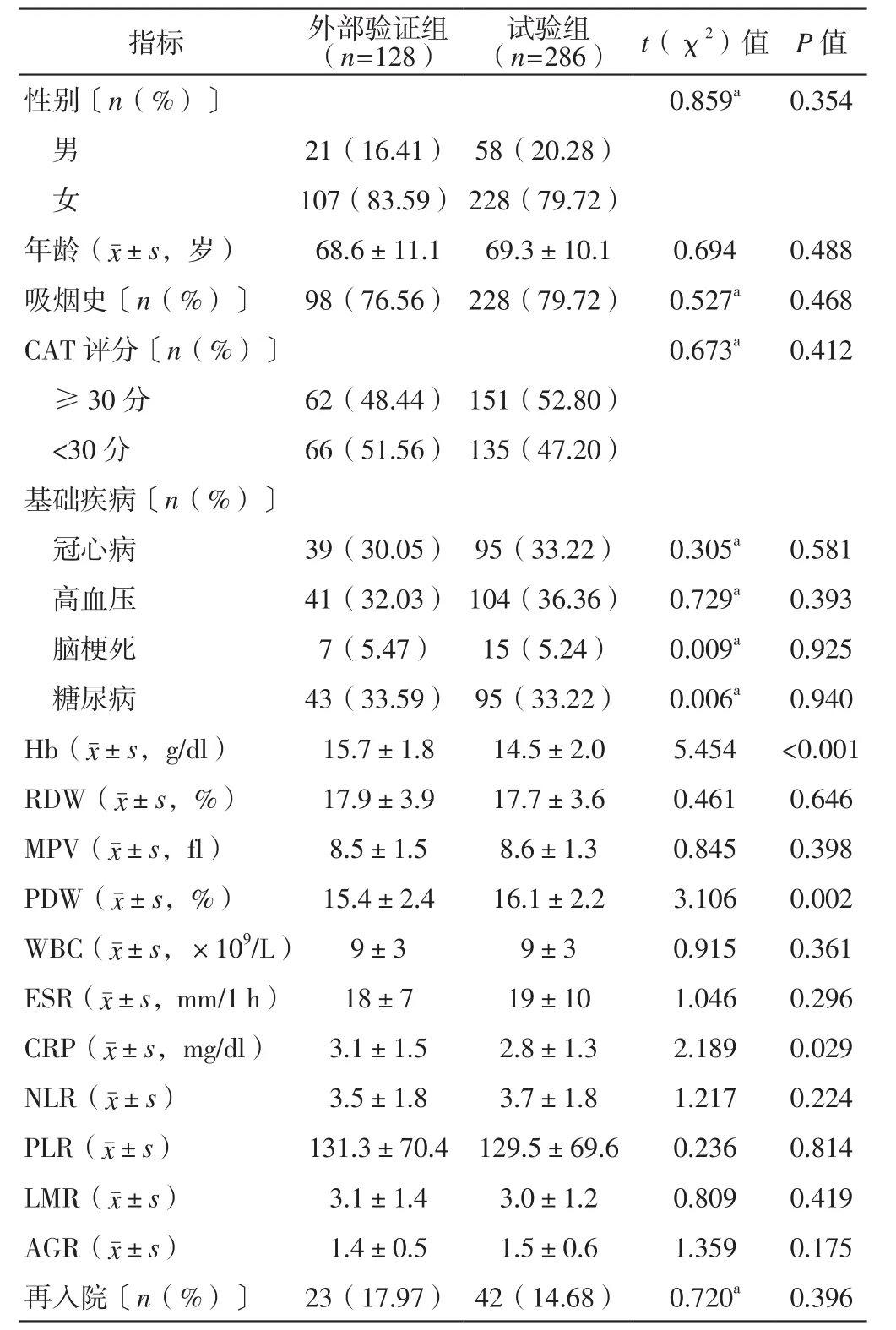
表1 外部验证组与试验组患者临床资料及出院30 d内再入院情况比较Table 1 Comparison of clinical data and post-discharge 30-day readmission between experimental group and validation group
2.5 Nomogram模型构建及外部验证结果 将CAT评分≥30分、糖尿病、CRP≥2.2 mg/dl、NLR≥3.5、PLR≥146.9、AGR<1.4作为预测AECOPD患者出院30 d内再入院的Nomogram模型预测因子(见图2),外部验证结果显示,Nomogram模型预测AECOPD患者出院30 d内再入院的CI为0.772〔95%C(I0.659,0.863),见图3〕。
3 讨论
AECOPD患者出院30 d内再入院率为6%~19%[16-17]。本研究结果显示,试验组患者出院30 d内再入院率为14.68%,与上述研究结果接近。AECOPD患者出院30 d内再入院后急性肾损伤[18]、主要不良心血管事件[19]发生风险较高。
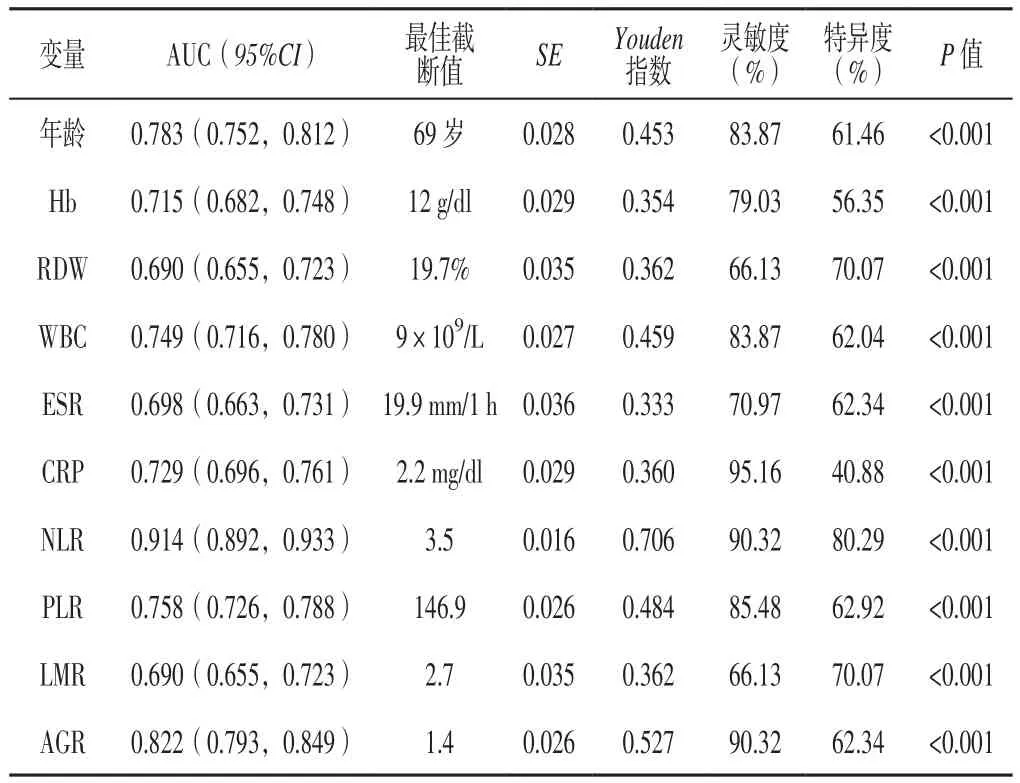
表3 相关连续变量对AECOPD患者出院30 d内再入院的预测价值Table 3 Predictive value of variables associated with post-discharge 30-day readmission in patients with AECOPD
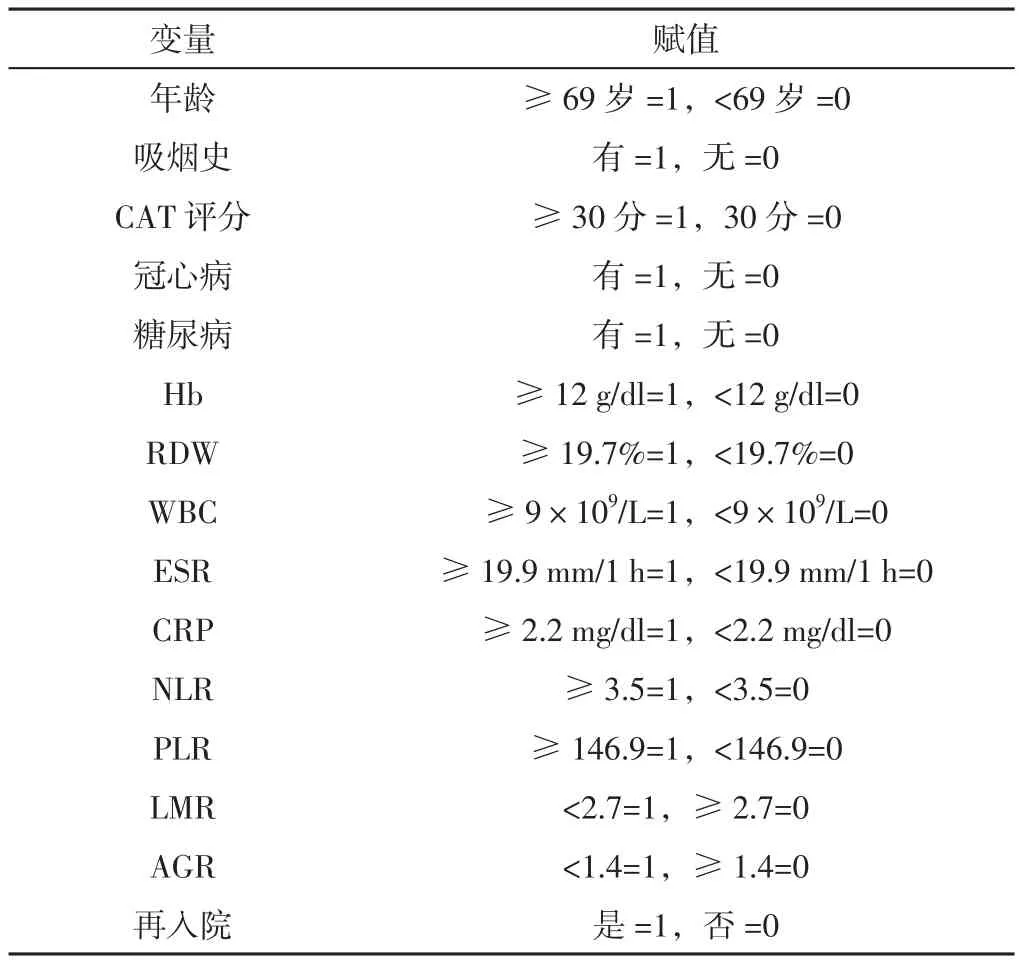
表4 AECOPD患者出院30 d内再入院影响因素的变量赋值Table 4 Assignment for variables influencing post-discharge 30-day readmission of AECOPD patients
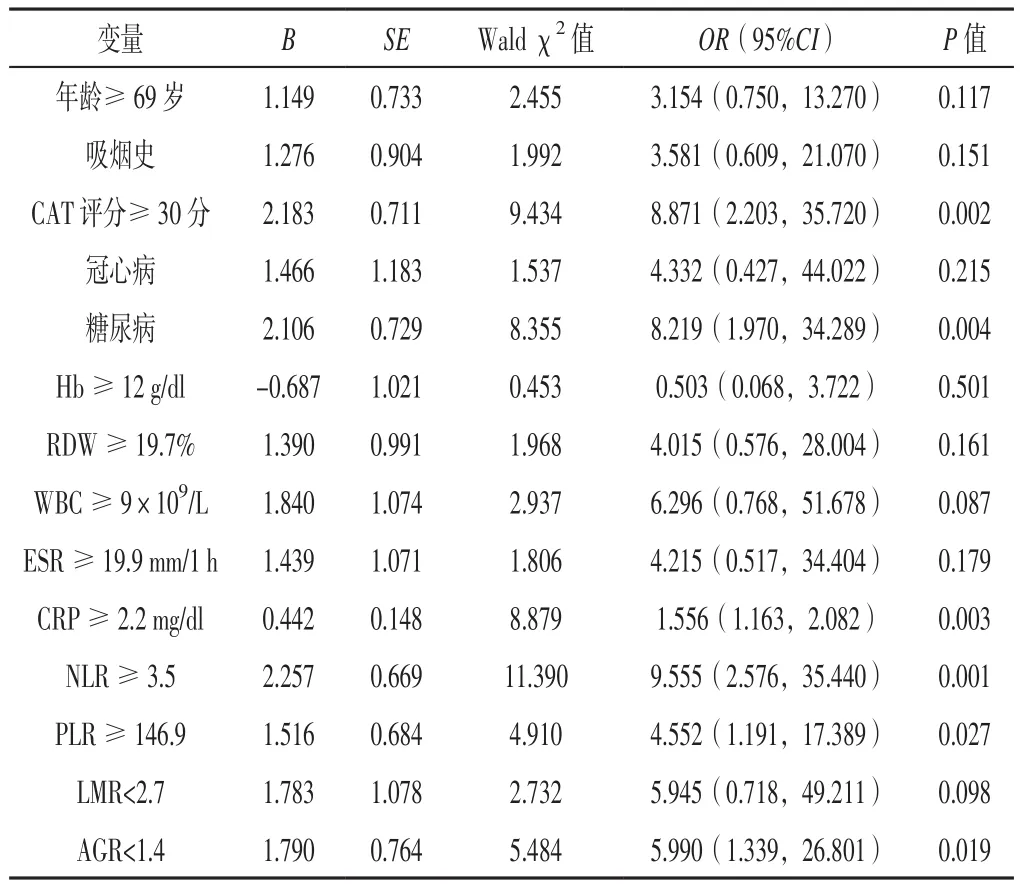
表5 AECOPD患者出院30 d内再入院影响因素的多因素Logistic回归分析Table 5 Multivariate Logistic regression analysis of influencing factors for post-discharge 30-day readmission of AECOPD patients
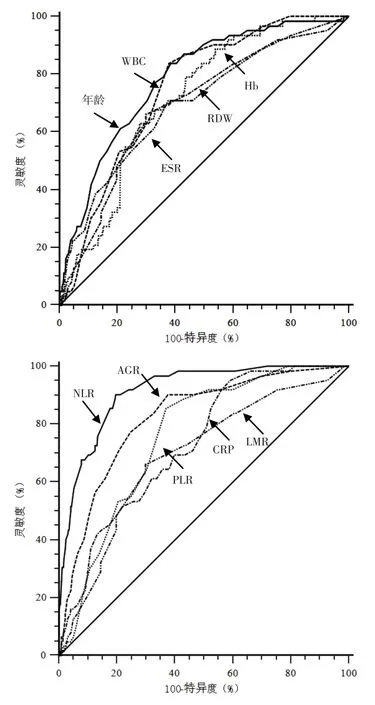
图1 相关连续变量预测AECOPD患者出院30 d内再入院的ROC曲线Figure 1 ROC curve of correlation variables in predicting post-discharge 30-day readmission in patients with AECOPD
肺部和全身炎性反应是COPD自然病因中的突出特征,包括全身氧化应激、循环炎性细胞活化和循环炎性细胞因子水平升高[20]。AECOPD是COPD患者呼吸系统症状恶化的表现,病情加重分为细菌性、病毒性和其他/未明确的原因,反映了呼吸道潜在慢性炎性反应被级联放大,这种炎症特征是肺泡巨噬细胞、中性粒细胞、T淋巴细胞和固有淋巴细胞数量增加及激活[21]。此外,先天性免疫抑制和适应性免疫抑制均可导致AECOPD患者抗病原体能力减弱,使炎性肺微环境恶化,进而加重病情严重程度[22]。因此,针对有病情恶化风险的AECOPD患者需尽早实施适当的预防策略。本研究基于炎性反应标志物结合临床指标成功构建预测AECOPD患者出院30 d内再入院风险的Nomogram模型,以便于临床早期筛查AECOPD再入院高危患者,以为优化治疗方案提供理论依据。
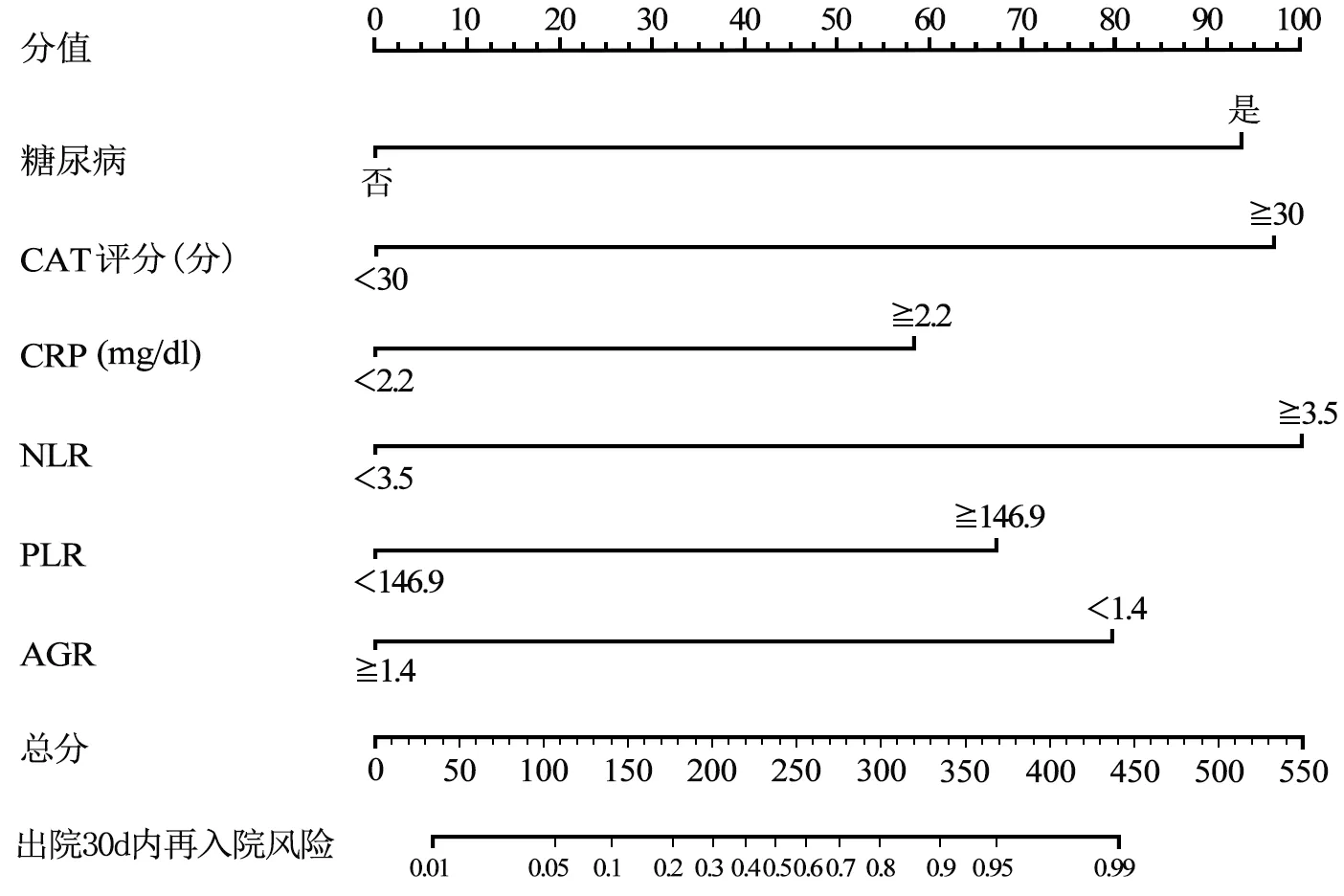
图2 AECOPD患者出院30 d内再入院的Nomogram模型构建Figure 2 Nomogram model for post-discharge 30-day readmission risk prediction in patients with AECOPD

图3 Nomogram预测模型的校准曲线Figure 3 Calibration curve of Nomogram prediction model
本研究结果显示,CAT评分≥30分、糖尿病是AECOPD患者出院30 d内再入院的独立危险因素,与既往研究结果一致[14]。CAT评分在临床中应用广泛,并被我国指南推荐作为症状严重程度的方法[15]。而高血糖会导致机体免疫功能受损,抑制抗炎细胞趋化、吞噬、胞内菌活性、细胞介导免疫[23]。CRP是一种由肝脏产生的急性期蛋白,其水平可在感染、炎症或组织损伤情况下升高。研究表明,CRP水平与AECOPD患者治疗后50 d病情恶化有关[24];另有研究表明,CRP水平能预测AECOPD患者1年再入院风险[25]。本研究结果显示,CRP≥2.2 mg/dl是AECOPD患者出院30 d内再入院的独立危险因素。目前,NLR、PLR、LMR及AGR是一个简单、广泛可用、从全血中获得的低成本炎性反应标志物,其并不仅反映某个单一炎性指标而是2种炎性指标的动态平衡。本研究结果显示,NLR≥3.5、PLR≥146.9、AGR<1.4是AECOPD患者出院30 d内再入院的独立危险因素。NLR与疾病炎性细胞群的改变有关,可预测系统性自身免疫性疾病(包括类风湿关节炎、强直性脊柱炎、骨关节炎、系统性红斑狼疮)[26]、恶性肿瘤[27]的发生、发展及预后。
病毒和细菌感染是AECOPD患者最常见病因,可刺激促炎和趋化因子〔包括白介素6(IL-6)、白介素8(IL-8)、CXC类趋化因子配体5(CXCL5)、CXC类趋化因子配体8(CXCL8)和Toll样受体4(TLB4)〕产生,进而导致中性粒细胞募集和急性炎症出现。研究表明,AECOPD患者淋巴细胞分数下降,而中性粒细胞分数增加[28],全身炎症可导致血小板活化[29]。MACLAY等[29]研究显示,与非COPD患者相比,COPD患者血小板活化程度增加,且AECOPD患者血小板活化程度较稳定期增加更明显。AGR是一种简单的肝功能生化指标,主要受血清白蛋白和球蛋白浓度影响。近年来,AGR被认为是机体炎性反应标志物之一,免疫球蛋白G(IgG)是球蛋白的主要成分,AECOPD患者体内存在大量IgG沉积[30];此外,低蛋白血症在AECOPD患者中较为常见,发生率高达35.2%[31]。低白蛋白是AECOPD患者急性呼吸衰竭的独立危险因素[32]。因此,结合本研究的结果,AECOPD患者入院时高炎性因子水平可能预示其出院后病情恶化风险较高。
Nomogram模型的优势在于将复杂回归方程转变为简单且可视化图形,使预测模型结果更具可读性。本研究是根据多因素Logistic回归分析结果构建预测AECOPD患者出院30 d内再入院风险的Nomogram模型,采用外部数据对Nomogram模型进行验证并根据CI来评估Nomogram模型预测能力,外部验证结果显示,预测AECOPD患者出院30 d内再入院的Nomogram模型的CI为0.772。SAKAMOTO等[13]构建 AECOPD患者死亡风险的Nomogram模型的CI为0.775;HU等[14]构建的AECOPD患者病情恶化的Nomogram模型的CI为0.702。因此,本研究构建的Nomogram模型预测效能较好。
综上所述,CAT评分≥30分、糖尿病、CRP≥2.2 mg/dl、NLR ≥ 3.5、PLR ≥ 146.9、AGR<1.4 是AECOPD患者出院30 d内再入院的独立危险因素,而整合该指标构建Nomogram模型对AECOPD患者出院30 d内再入院风险的预测效能较好,有助于指导临床医生完善治疗方案,为患者治疗提供临床思路。但本研究存在一定局限性:首先,本研究为回顾性研究,结论存在偏倚;其次,本研究虽然采用外部数据验证Nomogram模型预测效能,但纳入样本量较少,可能会降低Nomogram模型预测效能;第三,炎性反应标志物可能受其他疾病或药物影响,如感染和使用类固醇等;虽然本研究排除COPD以外肺部炎症性疾病患者,但仍可能存在潜在的炎性反应。
作者贡献:周寅川进行文章的构思与设计,撰写论文;周寅川、荣蓉进行研究的实施与可行性分析,数据收集、整理、分析;周寅川、李业彪进行结果分析与解释,并对文章整体负责、监督管理;荣蓉、黄祎丹进行论文的修订;周寅川、黄祎丹负责文章的质量控制及审校。
本文无利益冲突。
