3株犬源乳酸杆菌的分离鉴定与益生特性研究
2020-08-17田其真唐晨晨沈丹晴黄银云蔡丙严
田其真,唐晨晨,沈丹晴,黄银云,蔡丙严
(江苏农牧科技职业学院,江苏 泰州 225300)
乳酸杆菌是人和动物胃肠道中的优势菌群,其在调节机体肠道微生态平衡、促生长、增强免疫力和抗感染等多方面发挥重要作用[1-2],也是广泛应用于制备保健或疾病防治用益生菌制剂的主要菌株[3]。目前,益生菌制剂作为生物兽药和饲料添加剂,在猪、鸡、牛、羊等动物肠炎、腹泻病的治疗和预防上已发挥了日益显著的作用[4-5]。伴随宠物产业的兴起,国内外宠物保健品市场有着广阔的前景,针对幼龄宠物犬胃肠道健康具有保健作用的益生菌制剂需求大幅增长。但市场上进口的犬用益生菌制剂价格昂贵且质量良莠不齐,国产宠物犬益生菌制剂研究应用相对较少。菌种选择是益生菌制剂技术成败的关键因素之一,因此对菌种益生特性的研究和筛选已成为焦点。KUMAR等[6]证实,将犬源约氏乳杆菌CPN23给试验犬连续口服63 d,可以增加粪便中乙酸和丁酸的含量,减少粪便氨气的排放,促进肠道健康。BAILLON等[7]研究发现,给健康犬饲喂嗜酸乳杆菌DSM13241,既能改善犬的肠道菌群组成,也能提高相关免疫功能。全志海[8]将犬源棒状乳酸杆菌和瑞士乳酸杆菌饲喂犬,供试犬平均日增质量提高14.76%,腹泻率下降6.22%。任普军[9]从犬的粪便中分离出嗜酸乳酸杆菌、干酪乳酸杆菌和肠球菌,并将其按一定比例制成益生菌制剂饲喂腹泻犬,结果表明,对致病性大肠杆菌所致的腹泻模型犬具有较好的治疗效果。李艳欣[10]将分离自犬肠道的动物乳酸杆菌饲喂犬,14 d后发现试验犬肠道内乳酸菌含量明显增加,而大肠杆菌、沙门氏菌、梭菌及肠球菌的含量明显减低,且可显著缓解犬的腹泻。为筛选犬用益生菌制剂的候选菌株,从散养的健康成年中华田园犬粪便中分离、鉴定出3株乳酸杆菌。采用耐酸、抗胆盐、细胞黏附、抑菌和小鼠口服促生长等益生特性试验,探讨3株乳酸杆菌作为益生菌的可能性,以期为犬用益生菌制剂候选菌株的开发提供理论依据。
1 材料和方法
1.1 样品与菌株
样品采自泰州市郊区村民散养的健康成年中华田园犬新鲜粪便。犬源致病性大肠杆菌菌株201,由江苏农牧科技职业学院教学动物医院实验室分离、鉴定保存。
1.2 供试动物
健康KM小鼠,体质量(20.00±0.20)g,购自扬州大学兽医学院比较医学中心。
1.3 主要试剂
乳酸杆菌用成套生化鉴定管及MRS液体培养基、MRS固态培养基均购自海博生物技术有限公司;Ezup柱式细菌基因组DNA抽提试剂盒、SanPrep柱式DNA 胶回收试剂盒等均购自上海生工生物工程股份有限公司;CaCO3、Triton X-100(辛基苯基聚氧乙烯醚)、牛胆盐等均购自北京索莱宝科技有限公司;LB营养琼脂培养基、LB营养肉汤培养基均购自Oxoid公司。
1.4 菌株分离鉴定
1.4.1 样品采集和菌株分离 无菌取健康成年田园犬新鲜粪便10 g加入灭菌蒸馏水90 mL,充分涡旋混匀,采用梯度稀释法将样品稀释,分别取10-5~10-8稀释度的样品200 μL,涂布于含有0.75% CaCO3的改良MRS培养基上,37 ℃培养48 h 后观察菌株生长情况,挑选形态不同且有明显溶钙环生成的菌落,在MRS平板上划线培养3 次纯化,将革兰氏染色镜检阳性的菌落,-80 ℃保存备用。
1.4.2 生理生化鉴定 将纯化后的菌株,参照文献[11]方法进行过氧化氢酶试验、硝酸盐还原试验、硫化氢试验和糖发酵试验等生理生化指标测定。
1.4.3 16S rRNA基因序列分析 按照细菌DNA提取试剂盒提取分离菌株的总DNA,采用细菌16S rRNA基因通用引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492 R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR 扩增体系(20 μL):2Mix 10 μL,10 μL mol/L 的上下游引物各0.5 μL, DNA 模板5 μL,ddH2O 4 μL。PCR 扩增条件:95 ℃ 预变性5 min;94 ℃ 变性30 s,57 ℃ 退火30 s,72 ℃ 延伸90 s,35 个循环;72 ℃ 延伸10 min,4 ℃ 保存。将扩增产物用1% 琼脂糖凝胶电泳检测,扩增产物送上海生工生物工程股份有限公司测序,将测序结果与GenBank 数据库中的参考菌株序列进行同源性比对,最终确定所分离的3株分离菌株的属种。
1.5 分离菌株的益生特性
1.5.1 对酸的耐受性 将冻存复苏后的分离菌株,以5% 的接种量分别接种于pH值1.0、2.0、3.0、4.0、5.0、6.0的MRS肉汤培养基中,37 ℃ 条件下100 r/min培养3 h,用分光光度计测其OD600。
1.5.2 对胆盐的耐受性 将冻存复苏后的分离菌株,以5%的接种量分别接种于含牛胆盐0.1%、0.2%、0.3%、0.4%、0.5%、0.6%的MRS肉汤培养基中,37 ℃条件下100 r/min培养3 h,用分光光度计测定其OD600。
1.5.3 对犬源致病性大肠杆菌的抑制作用 参照文献[12]采用牛津杯法。取复苏至对数期的大肠杆菌200 μL,涂布于LB固体培养基平板,4 ℃ 扩散吸收2 h。待菌液完全吸收后,在每个平板上放置3个已灭菌的牛津杯。将培养24 h后的乳酸杆菌,8 000 r/min,4 ℃条件下离心10 min,收集上清液,每种菌株分别取上清液2份,1份测定pH值作为原液,1份调节pH值至6.5,2份上清均用0.22 μm的滤膜过滤除菌。分别取每种分离菌的2份上清滤液各200 μL,加入到3个牛津杯中,37 ℃培养12 h后测量抑菌圈直径。
1.5.4 对肠黏膜上皮细胞黏附能力测定 参照文献[13]方法,选择出生后未吃初乳的田园幼犬,无菌操作剪开小肠,用pH值7.2的PBS洗去内容物,将干净小肠浸于PBS中,4 ℃放置30 min。取出小肠,PBS洗涤3次,用无菌载玻片边缘将肠黏膜上皮细胞轻轻刮下,悬浮于PBS 液中,调整细胞数量至1×105个/mL,无菌备用。将培养18 h后的3株分离菌,4 ℃条件下8 000 r/min离心10 min,弃去上清液,将菌体用PBS重悬,使菌数量达1×107cfu/mL。分别取1 mL 乳酸杆菌悬液与1 mL肠上皮细胞悬液,加入已放置细胞爬片的试管中混合,在37 ℃条件下 20 r /min 作用30 min,弃去混合液,加入PBS液洗涤2次,然后加入2 mL 含有0.1% Triton X-100的PBS,使细胞裂解10 min。将细胞裂解液用PBS进行10倍稀释,在MRS 固体培养基上培养48 h后进行细菌计数,每个稀释重复3次。计算黏附率:黏附率=(细胞裂解后的细菌数/加入到试管中的细菌数)×100%。
1.5.5 对小鼠的安全性与促生长作用 将分离菌接种于MRS肉汤中培养24 h,3 000 r/min离心10 min,弃去上清液,加入无菌的生理盐水至原体积,重复洗涤3次。配制成1×109cfu/mL菌液,按菌种编号对28日龄小鼠进行分组,每组10只,每只分别灌服0.2 mL菌液,每天灌服1次,共28 d。对照组小鼠灌服等体积的生理盐水,每天观察小鼠精神状态、饮食及死亡情况,每周称体质量。
1.6 数据处理
试验数据采用平均值±标准差表示,使用SPSS 17.0进行统计学分析。
2 结果与分析
2.1 分离菌株的形态特征
将稀释后的新鲜粪便,采用0.75% CaCO3的MRS改良琼脂培养基,分离出3株形态不同且具有明显融钙环的乳酸杆菌,革兰氏染色均为阳性,无鞭毛和芽孢(图1)。TCSL1菌体呈短杆状,两端圆形,单独或成对存在;TCSL2呈球状、短链状;TCSL3呈长杆状。
图1 3株乳酸杆菌形态特征Fig.1 Morphological characteristics of three strains of Lactobacillus
2.2 分离菌株的生理生化鉴定
从表1可以看出,3株分离菌株过氧化氢酶试验、硝酸盐试验、硫化氢试验均为阴性,乳糖、半乳糖、葡萄糖、麦芽糖等发酵试验均为阳性,符合乳酸杆菌的生理生化特征。

表1 3株乳酸杆菌生理生化鉴定Tab.1 Physiological and biochemical identification of three strains of Lactobacillus
2.3 分离菌株的16S rRNA 基因序列分析
3株分离菌均扩增出约1 500 bp 的16S rRNA 基因片段(图2)。测序结果经BLAST 软件同源性比对分析,TCSL1 与唾液乳酸杆菌(L.salivarius)的16S rRNA的相似性达99.6%,TCSL2 与约氏乳酸杆菌(L.johnsonii)的16S rRNA 的相似性达99.4%,TCSL3与瑞氏乳酸杆菌(L.helveticus)的16S rRNA的相似性达99.1%。结合形态学及生理生化鉴定结果,将TCSL1鉴定为唾液乳酸杆菌(L.salivarius),TCSL2 鉴定为约氏乳酸杆菌(L.johnsonii),TCSL3鉴定为瑞氏乳酸杆菌(L.helveticus)。
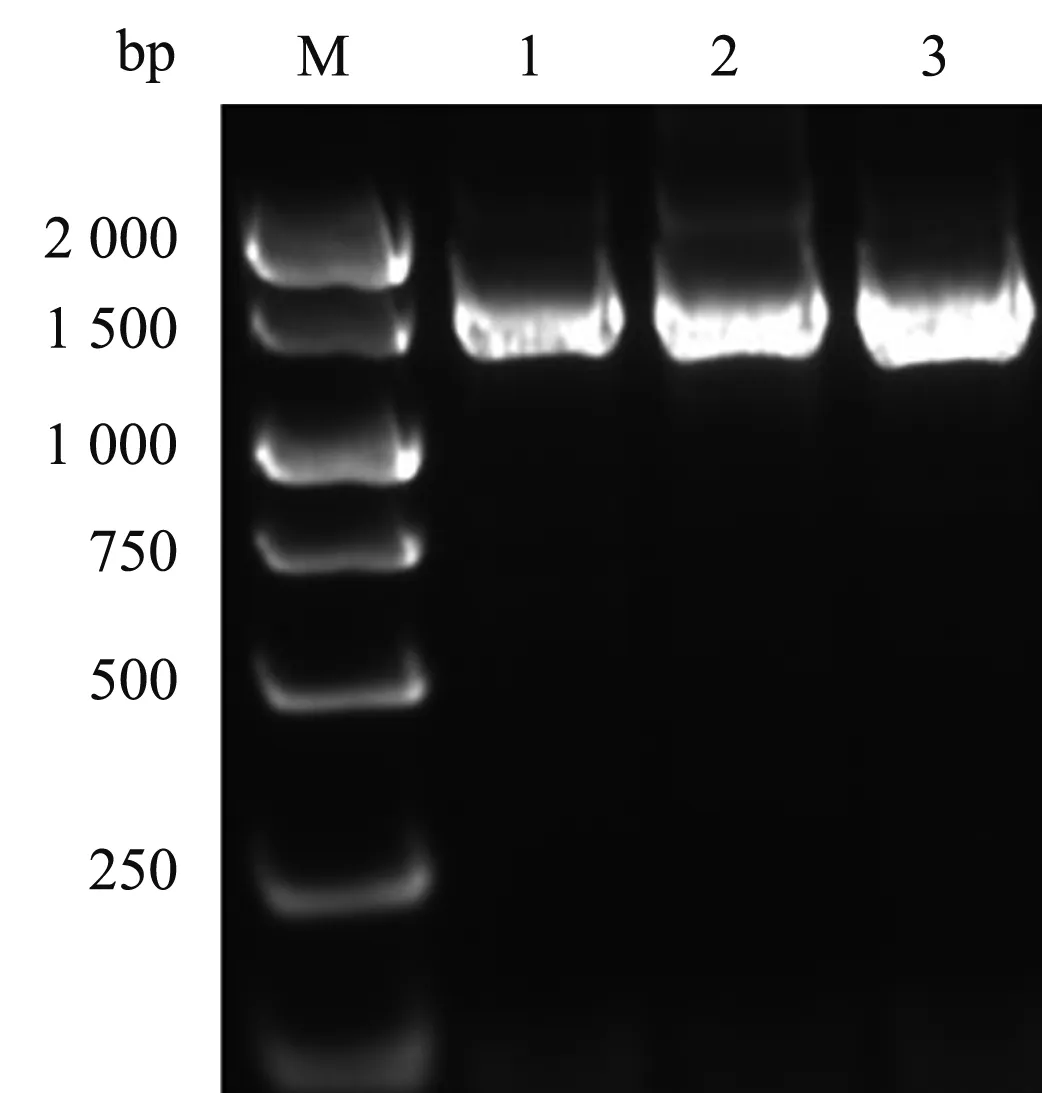
M.DNA标准DL2000;1.唾液乳酸杆菌(TSL1);2.约氏乳酸杆菌(TSL2);3.瑞士乳酸杆菌(TSL3)M.DNA Marker DL2000;1.L.salivarius(TSL1);2.L.johnsonii(TSL2);3.L.helveticus(TSL3)图2 3株乳酸杆菌16S rRAN PCR结果Fig.2 16S rRAN PCR results of three strains of Lactobacillus
2.4 分离菌株的益生特性
2.4.1 对酸的耐受性 将3株分离菌株接种到不同pH值的MRS液体培养基中,测定其对酸的耐受性。由图3可知,3株分离菌株在pH值1.0的酸性环境中生长受到抑制,在pH 值2.0时缓慢生长,当pH值达到3.0时开始快速生长,至pH值为6.0时达到峰值,表明3株分离菌株均能耐受pH值2.0以上的酸性环境。TCSL1和TCSL3对酸的耐受性优于TCSL2。

图3 3株乳酸杆菌在不同pH值培养基中的生长情况Fig.3 Growth of three strains of Lactobacillus in different pH value medium
2.4.2 对胆盐的耐受性 将3株分离菌株接种到不同含量牛胆盐的MRS液体培养基中,测定其对胆盐的耐受性。由图4可知,TCSL1含量在0.4%、TCSL2和TCSL3含量在0.3% 时,OD600值达到峰值,之后随牛胆盐含量的升高,3株菌的生长均受到抑制;当牛胆盐含量达到0.6%时,3株菌的OD600值与牛胆盐含量0.1% 时接近,表明3株分离菌株在含0.6%牛胆盐的MRS培养基中均能存活。
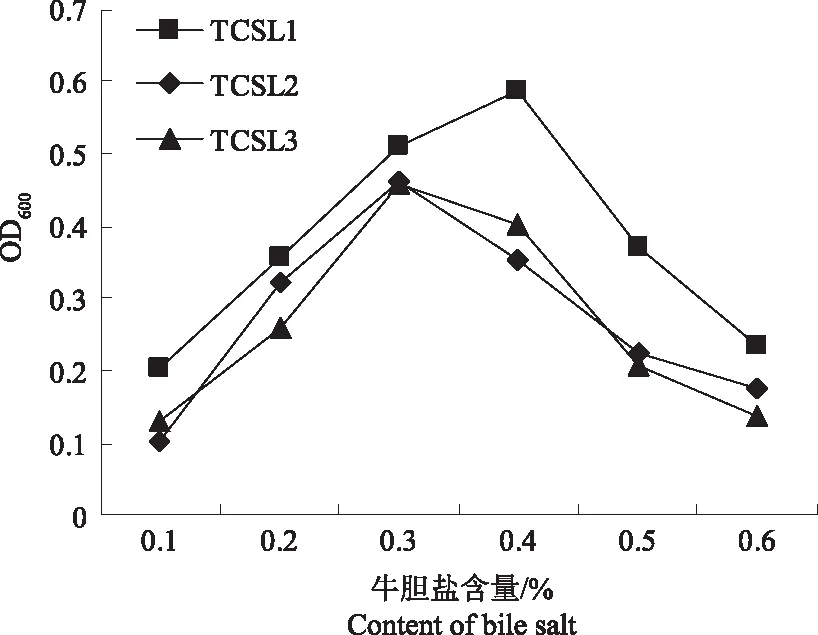
图4 3株乳酸杆菌在含牛胆盐培养基中的生长情况Fig.4 Growth of three strains of Lactobacillus in culture containing bile salt
2.4.3 对犬源致病性大肠杆菌的抑菌作用 由表2可知,TCSL1、TCSL2和TCSL3培养24 h未调节pH时的上清液(原液)和上清液(调节pH值至6.5),对犬源致病性大肠杆菌均具有显著的抑制作用,上清液(原液)的抑菌效果优于调节pH值至6.5后的上清液。
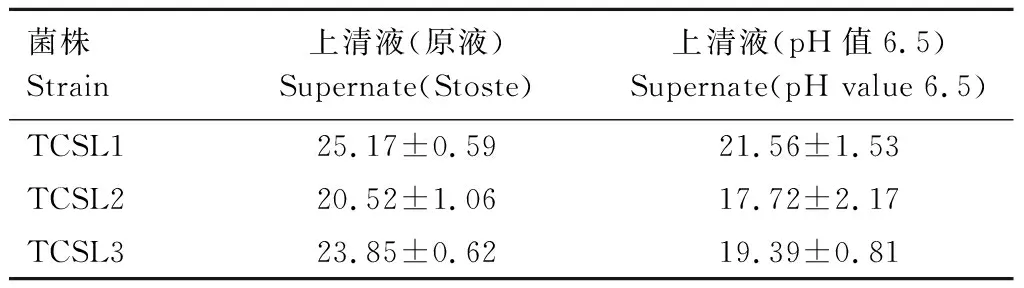
表2 3株乳酸杆菌发酵液上清液对犬致病性大肠杆菌抑菌圈直径Tab.2 Diameter of bacteriostatic circle of the three Lactobacillus supernatant on pathogenic Escherichia coli in dogs mm
2.4.4 对犬小肠上皮细胞的黏附力 3株分离菌与犬小肠上皮细胞混合30 min后,表现出了较强的黏附能力,TCSL1、TCSL2和TCSL3对犬小肠上皮细胞黏附率均达到65%以上,TCSL2黏附率最高为77.41%(图5)。
2.4.5 对小鼠安全性与体质量的影响 将3分离菌株菌给小鼠连续灌服28 d,期间各组小鼠精神良好,采食正常,无死亡,安全性较好。由表3可知,与对照组相比,TCSL1菌株接种小鼠从14 d开始,TCSL2菌株从21 d开始,小鼠体质量显著上升(P<0.05),TCSL3菌株接种小鼠体质量无明显变化。结果表明,TCSL1和TCSL2菌株均能促进小鼠的生长。

图5 3株乳酸杆菌对犬上皮细胞的黏附力Fig.5 Adhesion of three strains of Lactobacillus to canine epithelial cells

表3 3株乳酸杆菌对小鼠体质量的影响Tab.3 Effect of three Lactobacillus strains on the body weight of mice g
3 结论与讨论
从犬的肠道或粪便中分离乳酸杆菌是筛选犬用益生菌制剂候选菌株的重要途径。研究表明,已从犬的粪便中分离出了多种具有益生作用的乳酸杆菌,如罗伊氏乳酸杆菌(L.reuteri)AI[14]和X-18[15]、约氏乳酸杆菌(L.johnsonii)CPN23[16]、唾液乳酸杆菌(L.salivarius)LAB9[17]、植物乳酸杆菌(L.plantarum)VET14A[18]等。本研究从犬粪便中分离筛选出了3株乳酸杆菌,经生理生化和16S rRNA序列分析鉴定为唾液乳酸杆菌、约氏乳酸杆菌和瑞士乳酸杆菌。本次分离的乳酸菌种类与KIM等[19]报道犬肠道内的乳酸杆菌种类主要为罗伊氏乳酸杆菌(L.reuteri)、动物乳酸杆菌(L.animalis)和约氏乳酸杆菌(L.johnsonii),分别以77.8%、80.6%和86.1%的频率出现,有差异。犬源瑞士乳酸杆菌(L.helveticus)分离出的几率较低,仅全志海[8]报道从犬肠道和粪便筛选出了1株瑞士乳酸杆菌。乳酸杆菌种类出现差异的原因可能与分离犬的种类、饲养方式、分离方法等不同有关。
口服是乳酸杆菌作为益生菌菌株进入动物胃肠道的主要途径,而低pH值的胃酸和肠道内胆汁中的胆盐,食物通过胃肠道的时间等因素均能影响其存活,因此对酸和胆盐的耐受性是评价益生乳酸杆菌的重要指标[20]。本研究结果表明,3 株乳酸杆菌经过3 h 的不同pH值和不同含量的牛胆盐处理后,均能耐受pH 值2.0以上的酸性环境和0.6% 的牛胆盐,其中,以唾液乳酸杆菌的耐受性最好。刘小兰等[21]报道,从鸡肠道内分离出唾液乳酸杆菌,其对酸的耐受性与本研究结果相一致,而耐胆盐结果则不一致。从犬粪便中分离的唾液乳酸杆菌对牛胆盐的耐受能力较强,在0.1%~0.4% 低含量时能促进其生长,而从鸡肠道内分离的唾液乳酸杆菌对胆盐的耐受能力稍差,其存活率随胆盐含量的升高而降低,其差异可能是乳酸杆菌的分离来源不同。犬源瑞士乳酸杆菌对酸的耐受性结果与朱炳林等[22]从猪肠道内分离的瑞士乳酸杆菌一致,均能耐受pH值 2.5以上。食物通过胃肠道的时间通常为1~2 h[23]。本研究得到的3 株乳杆菌均具有较强的耐酸耐胆盐能力,在经过酸、胆盐处理3 h时后仍能保持较好的生长状态,显示出作为益生菌菌株的潜力。
乳酸杆菌在代谢过程中产生的乳酸、细菌素和过氧化氢等活性物质,可显著降低环境pH值和氧化还原点位值,从而使肠内酸度增高,能够抑制大肠杆菌类和沙门氏菌等病原菌,调节肠道菌群平衡,借以预防腹泻或缓解相应症状[24]。本研究中,培养24 h后的3株乳酸杆菌发酵上清液为酸性,其pH值在3.25~3.71。将pH值调至6.5后,对犬源致病性大肠杆菌仍具有显著的抑制作用。结果表明,3株乳酸杆菌的抑菌活性物质不仅有代谢产生的乳酸,可能也有细菌素或过氧化氢等其他活性成分。试验结果与邹建华等[25]分离的鸡源唾液乳酸杆菌对致病性大肠杆菌有抑菌作用一致,且抑菌效果更好,其差异可能与唾液乳酸杆菌的分离来源和作用的大肠杆菌种类不同有关,本研究选用的致病性大肠杆菌来源于腹泻的病犬,抑制作用更具有针对性。3株乳酸杆菌发酵上清液中的何种物质在抑菌活性中发挥了关键性的作用,其机制有待进一步研究。
乳酸杆菌能黏附定植在肠黏膜上皮细胞上是其发挥益生作用的关键因素之一,不能黏附于肠上皮细胞,仅是过路菌,则随粪便排出[26]。作为优良益生菌株必须具有较好的黏附性,才能在维持肠道正常菌群的生理平衡和抵御外来病原菌的入侵等方面发挥益生作用。本研究选用出生后未吃初乳的田园幼犬小肠上皮细胞,与分离的乳酸杆菌体外作用后检测其黏附能力,结果表明,3株乳酸杆菌对犬小肠上皮细胞均具有较好的黏附作用,其中唾液乳酸杆菌的黏附率最高为77.41%。本试验参照李太元等[13]的方法并做改进,既兼顾了直接染色观察乳酸杆菌细胞黏附状态的优点,又增添了计算黏附率评价乳酸杆菌黏附能力的相对客观性。采用新鲜分离的幼犬上皮细胞,虽然细胞来源简便,但与乳酸杆菌体外黏附的过程中由于没有添加细胞培养液,细胞的体外存活率会受到影响,进而影响到乳酸杆菌的黏附能力,因此,体外黏附试验作用时间应缩短,选择30 min较为适宜。
乳酸杆菌在代谢过程中产生的乳酸不仅能改变肠道的pH值环境,发挥抑菌作用,同时能促使胃蛋白酶原转变为胃蛋白酶,提高胃蛋白酶的活性,促进动物对蛋白质的消化吸收,从而提高饲料报酬,改善动物生长性能[27]。本研究选用28日龄小鼠作为动物模型,观察了3株乳酸杆菌的饲用安全性和促生长作用。结果表明,给小鼠连续28 d 口服3株乳酸杆菌,试验过程中无小鼠死亡,且唾液乳酸杆菌和约氏乳酸杆菌对小鼠生长有显著的促进作用。研究结果与杨红亚等[28]报道的约氏乳酸杆菌能显著提高雏鸡体质量的作用相一致。受供试动物条件限制,本研究并未选择犬作为动物模型,乳酸杆菌来源与试验对象不一致,可能对试验结果会有影响,但也从侧面反映了3株乳酸杆菌具有较强的体内益生作用。
综上,本研究从散养健康的中华田园犬粪便中分离得到了唾液乳酸杆菌、约氏乳酸杆菌和瑞士乳酸杆菌,3株乳酸杆菌对酸、胆盐耐受性好,能抑制犬源致病性大肠杆菌,对犬小肠上皮细胞的黏附能力强且能促小鼠生长,显示出较好的益生特性,可作为犬用益生菌制剂候选菌株开展进一步研究。
