以LPS构建IPEC1细胞损伤模型及相关指标的测定
2020-08-16王树辉陈少魁王秀英刘玉兰
徐 桥,王树辉,陈少魁,王秀英,肖 勘,刘玉兰
(武汉轻工大学动物营养与饲料科学湖北省重点实验室,湖北武汉 430023)
肠道在机体的生长发育中扮演着十分重要的角色。一方面,作为营养物质消化吸收的主要场所,肠道起着满足机体营养需要的作用;另一方面,肠道作为免疫器官在抵御病原入侵及维持机体内环境的稳定中发挥重要作用[1-2]。研究发现,环境中病毒、细菌或霉菌毒素等均可破坏肠道的结构和功能,并诱导炎性细胞因子大量产生,进一步加剧肠道的损伤[3]。因此,建立相应的肠细胞损伤模型对研究肠道损伤机制和营养调控有十分重要的意义。
研究发现,大肠杆菌K88可以诱导猪肠上皮细胞系(IPEC1)细胞损伤并导致乳酸脱氢酶(LDH)活性显著升高[4]。多项研究也表明IPEC1细胞的损伤伴随着LDH活性显著升高[5-6]。脂多糖(LPS)是革兰氏阴性菌细胞壁的一种有毒成分,常用于构建肠细胞或肠道损伤模型。马小叶等[7]研究发现,LPS刺激可导致Caco-2细胞生长速度下降,细胞形态改变,细胞膜的通透性增大,ZO-1的mRNA表达量显著降低。与此类似,余长松等[8]研究发现,LPS刺激可导致IPEC-J2细胞ZO-1、claudin-1和occludin的mRNA表达量下降,细胞的通透性增大。LPS除了可构建肠细胞损伤模型之外,也可用于构建动物肠道损伤模型。研究发现,腹膜注射100 μg/kg的LPS可导致仔猪肠道结构和屏障功能损伤,肠道炎症相关基因的mRNA表达量显著升高[9-10]。然而,有关LPS对IPEC1细胞影响的研究较少。
本试验以IPEC1细胞为研究对象,探究不同浓度的LPS刺激对IPEC1细胞活力、LDH活性、紧密连接蛋白和炎症相关基因mRNA表达的影响,旨在建立IPEC1细胞损伤模型。
1 材料与方法
1.1 试验材料 IPEC1细胞由德克萨斯农工大学伍国耀教授馈赠;TRIzol购于Invitrogen公司;CCK8试剂盒、LPS(大肠杆菌血清型055:B5)购于Sigma公司;RNA反转录试剂盒、定量PCR试剂盒均购置于TaKaRa公司;LDH试剂盒购于南京建成生物科技有限公司;DMEM/F-12培养基和磷酸盐缓冲液(PBS)购于Hyclone公司;表皮生长因子(EGF)、胎牛血清(FBS)、胰酶、双抗(PSF)和谷氨酰胺(Gln)、RNA Plus裂解液、转铁蛋白(ITS-X)均购于Gibco公司。
1.2 试验设计
1.2.1 培养基的配制 在DMEM/F-12培养基的基础上,按比例配制成含有5%的胎牛血清、1%的双抗、1%的谷氨酰胺、1‰的ITS-X、0.5‰的EGF的完全培养基,待用。
1.2.2 细胞培养 将冻存的细胞复苏,在5% CO2,37℃的恒温培养箱中培养。当细胞量达到可消化的程度时(贴壁细胞量达到90% 以上),用胰酶消化。将消化得到的细胞进行适当稀释、铺板。待贴壁细胞量达到合适浓度,用含有不同浓度(0、0.025、1、10 μg/mL)LPS的培养液对细胞进行处理,并于LPS处理后1、2、4、8 h检测相关指标。
1.3 检测指标及方法
1.3.1 细胞活力 细胞经过胰酶消化,接种到96孔板中进行培养。每个处理8个重复。待贴壁细胞量达到60%时,换上含有不同浓度LPS的培养液,刺激不同的时间。在刺激时间结束时,换上含有CCK8的培养基(CCK8和完全培养基按1:9配制),在恒温培养箱中静置,避光保存1 h,再用酶标仪(检测波长450 nm)进行读数。
1.3.2 LDH活性、mRNA表达量 将消化后的细胞转移到12孔板中培养。每个处理4个重复。待贴壁细胞量达到60%~70% 时,用含有不同浓度LPS的培养液处理不同时间,收集细胞培养液,用于测定LDH活性。LDH活性采用LDH试剂盒检测。贴壁细胞用TRIzol处理,用于mRNA测定。按照TRIzol试剂的说明,样品经过提取、沉淀清洗、溶解等步骤,提取得到总RNA。按照反转试剂盒说明,反转得到cDNA。再运用Real-time PCR试剂盒,测定紧密连接蛋白和炎症相关基因的mRNA表达量[11]。数据分析是以β-actin为内参,采用Livak等[12]的2-ΔΔCt法进行计算。Real-time PCR引物序列见表1。
1.4 统计分析 采用SPSS 22.0软件进行单因素方差分析和Duncan´s多重比较,结果采用平均值±标准误表示,以P≤0.05为差异显著性标准。
2 结果
2.1 不同剂量LPS对IPEC1细胞活力的影响 由图1可知,与对照组相比,当LPS处理IPEC1细胞1 h时,10 μg/mL的LPS导致IPEC1细胞活力较其他3组显著降低。当处理时间为2 h时,1 μg/mL的LPS导致细胞活力较其他3组显著上升。当处理时间为4 h时,1 μg/mL和10 μg/mL的LPS导致细胞活力较0、0.025 μg/mL LPS组显著上升。因此,当LPS处理时间为1、2、4、8 h时,不同浓度的LPS刺激对细胞活力的影响未呈现出显著的规律性。
2.2 不同剂量LPS对IPEC1细胞培养液中LDH活性的影响 由图2可知,与对照组相比,当LPS处理IPEC1细胞时间为1、4、8 h时,1 μg/mL的LPS导致IPEC1细胞上清液LDH活性较0、0.025 μg/mL LPS组显著上升。10 μg/mL的LPS导致LDH活性在不同的时间点均显著上升,且随着LPS浓度的增加,LDH活性上升幅度变大。

表1 基因的引物序列
2.3 不同剂量LPS对IPEC1细胞紧密连接蛋白mRNA表达的影响 由表2可知,与对照组相比,当LPS处理IPEC1细胞1 h时,与0、10 μg/mL LPS相比,0.025 μg/mL的LPS导致claudin-1的mRNA表达显著上升。当处理4 h时,1 μg/mL的LPS导致claudin-1和occludin的mRNA表达较0.25 μg/mL LPS处理显著下降。因此,当LPS处理时间为1、2、4、8 h时,不同浓度的LPS刺激对紧密连接蛋白mRNA表达的影响未呈现出显著的规律性。
2.4 不同剂量LPS对IPEC1细胞TLR4、NF-κB、TNF-α和IL-6mRNA表达的影响 由表3可知,当LPS处理IPEC1细胞1 h时,与0 μg/mL LPS处理相比,10 μg/mL LPS导致TLR4的mRNA表达显著上升。当处理2 h时,0.025、1、10 μg/mL LPS均导致IL-6的mRNA表达较0 μg/mL LPS处理显著下降。可见,当LPS处理时间为1、2、4、8 h时,不同浓度的LPS刺激对TLR4、NF-κB、TNF-α和IL-6的mRNA表达未呈现出显著的规律性。
3 讨论
肠道作为机体重要的消化吸收场所和免疫器官,在维持机体内环境的稳定中发挥着十分重要的作用[1]。LPS主要存在于革兰氏阴性菌,可通过激活机体的免疫细胞,引起炎症信号通路激活,诱导炎性细胞因子TNF-α、IL-6、IL-1等产生,造成肠道损伤[13-14]。本试验以IPEC1细胞为研究对象,探究不同浓度LPS刺激对细胞的影响,以建立细胞损伤模型。
细胞活力是指细胞群中活细胞所占的比率,可反映细胞的生长状况。当细胞受损时,细胞内的LDH会释放到培养液中,因此,通过检测培养液中LDH活性可评判细胞受损情况。本试验中LPS刺激对IPEC1细胞活力的影响未呈现明显的规律性,但LPS刺激使LDH活性显著上升,且随着LPS浓度增加,LDH活性上升的幅度变大,表明LPS刺激能引起细胞损伤。余长松等[8]研究发现LPS刺激导致IPEC-J2细胞萎缩脱落死亡。Palocz等[15]研究发现,LPS刺激导致IPEC-J2细胞中活性氧含量升高,导致细胞损伤。马小叶等[7]研究发现,LPS刺激导致Caco-2细胞数目减少、形态改变。以上这些研究均表明LPS刺激能导致细胞损伤,与本试验结果类似。
紧密连接蛋白是肠黏膜的主要组成成分之一,在黏膜屏障中发挥着重要的作用。当机体受到病原微生物刺激,可导致肠黏膜紧密连接蛋白的表达量下降,肠道通透性增大。本试验中,不同浓度的LPS处理IPEC1细胞不同时间,对IPEC1细胞紧密连接蛋白mRNA的表达的影响未呈现明显的规律性。马小叶等[7]研究发现,LPS刺激导致Caco-2细胞膜的通透性增大,ZO-1的mRNA表达量下降。余长松等[8]研究也发现,LPS刺激导致IPEC-J2细胞紧密连接蛋白ZO-1、claudin-1和occludin的mRNA表达量下降,细胞的通透性增大。此外,Liu等[9]在仔猪上的研究也发现,LPS刺激导致小肠黏膜claudin-1蛋白表达量下降。以上研究表明,LPS刺激能导致紧密连接蛋白的mRNA表达量发生改变,这些结论均与本试验的结果相反。
研究表明,LPS可通过诱导炎性细胞因子的大量释放,引起肠道或肠细胞损伤[16]。本试验中,LPS刺激对IPEC1细胞TLR4、NF-κB、IL-6和TNF-α的mRNA表达的影响无规律性。Palocz等[15]研究发现,LPS刺激导致IPEC-J2细胞IL-6和IL-8的mRNA表达量显著上升。Razzuoli等[17]和Paszti等[18]研究也发现,LPS刺激导致IPEC-J2细胞发生炎症反应,炎症相关基因的mRNA表达显著上升。孙丽等[19]研究表明,LPS刺激Caco-2细胞可导致细胞中TNF-α、IL-6和TLR4的mRNA表达量上升。研究表明,LPS刺激导致仔猪肠道TLR4信号通路被激活,导致炎症相关基因(如TLR4、NF-κB和TNF-α等)的mRNA表达量显著上升[11]。与本试验结果相反,这些研究均表明了LPS刺激能导致炎症信号因子mRNA表达量上升。
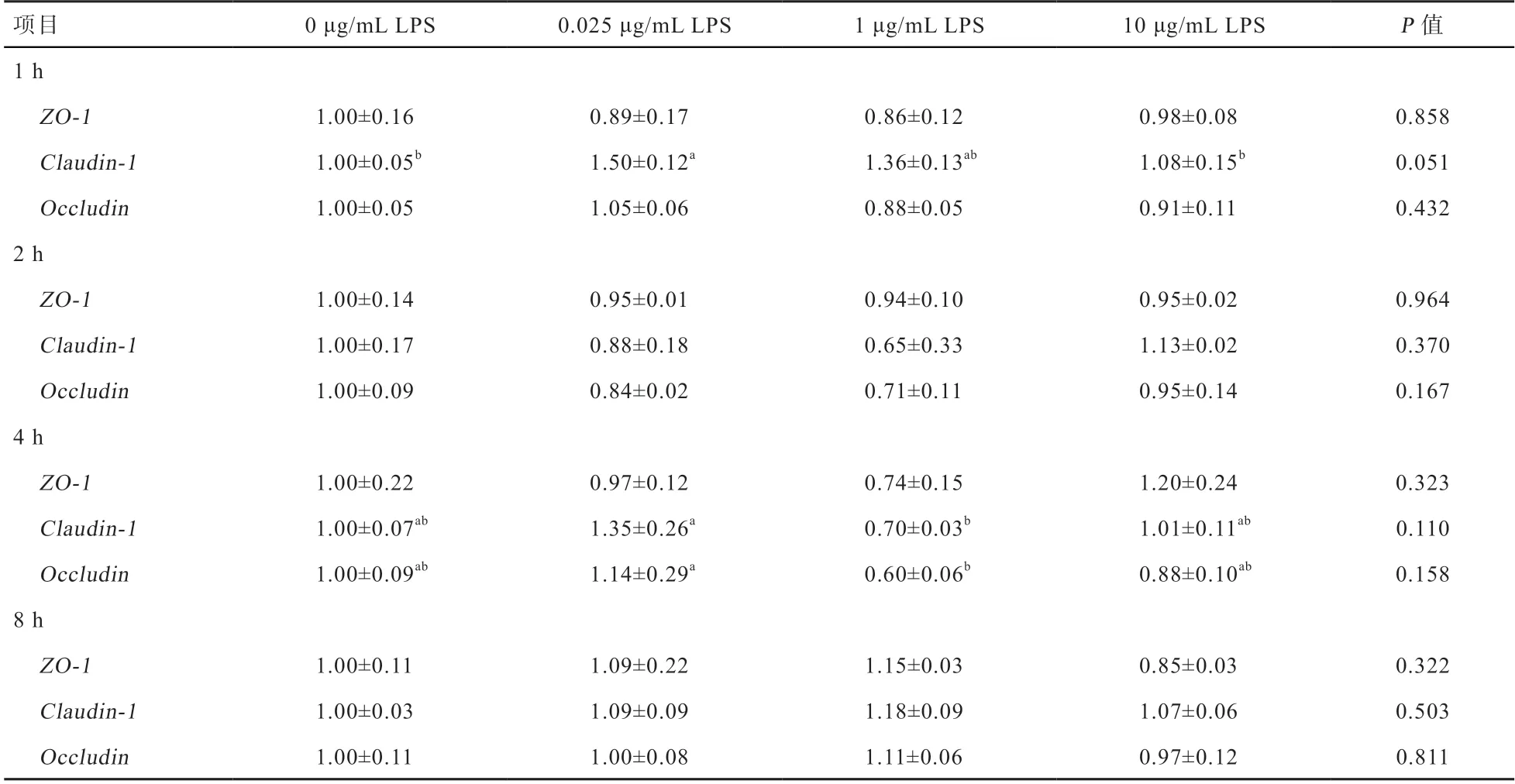
表2 不同剂量LPS对IPEC1细胞紧密连接蛋白mRNA表达的影响

表3 不同剂量LPS对IPEC1细胞TLR4、NF-κB、TNF-α 和IL-6 mRNA表达的影响
本试验结果发现,LPS处理IPEC1细胞对紧密连接蛋白和炎症相关基因mRNA表达的影响未呈现出显著的规律性,这可能是因为本试验选取的细胞类型与其他研究者不同,所以IPEC1细胞对于LPS这种刺激物的敏感性也不一样。目前LPS处理IPEC1细胞后紧密连接蛋白和炎性因子是否会有变化也未见研究报道。
本试验中,LPS刺激对IPEC1细胞活力的影响未呈现出规律性,LPS刺激使LDH活性显著上升,表明LPS确实能导致细胞损伤。LPS对紧密连接蛋白和炎症相关基因的mRNA表达量几乎无影响,与其他研究者的报道矛盾。推测本研究所培养的IPEC1细胞可能缺乏LPS的受体TLR4,从而导致该细胞对LPS的刺激无明显反应,其原因需要进一步的研究。
4 结论
在本试验条件下,LPS处理细胞1、4 h和8 h时,1 μg/mL和10 μg/mL LPS处理导致IPEC1上清液LDH活性显著升高。但不同浓度和不同时间的LPS刺激对紧密连接蛋白和炎症相关基因的mRNA表达的影响未呈现出显著的规律性。以上表明LPS刺激能引起IPEC1细胞损伤,但不能诱导显著的炎症反应。
