影响荷斯坦牛繁殖力及犊牛健康的遗传缺陷基因研究进展
2020-08-16孙东晓张胜利
张 毅,孙东晓,肖 炜,张胜利
(1.中国农业大学动物科学技术学院,北京 100193;2.北京市畜牧总站,北京 100107)
近几十年来,奶牛通过高强度选择,产奶性能大幅提高,然而在育种过程中,对种公牛的选择总局限在少数优秀家系,奶牛基因库逐渐缩小。同时,人工授精技术的广泛使用使优秀种公牛的使用频率增加,奶牛群体近交程度不断增加。美国奶牛育种委员会统计,1960—2017年,荷斯坦牛作为奶牛主导品种,单产从6 334 kg增加到12 723 kg,同时平均近交系数以每年约0.12%的速率递增,2017年达7.24%(图1)。基因组选择育种技术虽然理论上可以减缓近交[1],但由于公牛早期选择和世代间隔缩短,实际近交增加速度更快[2]。伴随群体近交积累,隐性有害基因纯合概率增加,遗传缺陷发病风险随之增加。
近年来,基因组测序技术的发展及牛基因组SNP芯片的出现[3]不仅提高了传统基因定位的效率,还催生了新的定位策略,鉴定出多种导致胚胎死亡或犊牛出生缺陷的有害基因。本文将从常见遗传缺陷种类、缺陷基因来源和传递方式、基因定位和分子检测方法、对奶牛生产影响及管理策略等方面,概述荷斯坦牛遗传缺陷基因的研究进展,并展望遗传缺陷基因育种应用的方向。
1 荷斯坦牛常见的遗传缺陷基因
国际上,在荷斯坦牛公牛系谱中标注的常见遗传缺陷共11种(表1)。
1.1 已鉴定的单基因遗传缺陷
1.1.1 尿苷酸合酶缺乏症(Deficiency of Uridine-5’-Monophophate Synthase,DUMPS)DUMPS可导致隐性纯合的后代胚胎早期死亡[4-5]。患病犊牛表现为尿苷酸合酶(UMPS)活性下降,酶作用底物4-羧基尿嘧啶(乳清酸)水平显著提高[4]。其分子遗传机制是牛1号染色体上UMPS基因第5外显子1个C/T突变,使编码精氨酸的密码子突变为终止密码子,导致原编码产物C末端缺失76个氨基酸[6]。
1.1.2 并趾症(Mulefoot)并趾症也称单蹄症(Syndactyly),临床症状为牛蹄发育过程中融合,犊牛单蹄,一只或多只脚趾上生出多余的脚趾,跛行和站立不稳,最常见于前肢,但也有四肢全部并趾[7]。其分子机制为牛15号染色体LRP4基因上的2个连续点突变(GC/AT),导致2个氨基酸从天冬氨酸和甘氨酸,突变为赖氨酸和半胱氨酸[8]。
1.1.3 白细胞黏附缺陷症(Bovine Leukocyte Adhesion Deficiency,BLAD)BLAD于1983年发现,患病犊牛表现食欲下降、生长发育受阻、持续性或反复性炎症,多数患病牛出生后在短期内死亡[9]。其致病机理为牛1号染色体上CD18(ITGB2)基因第383位碱基发生了A/G的错义突变,其编码的氨基酸由天冬氨酸变为甘氨酸,致使白细胞表面的整合素表达明显减少或缺乏而引起临床发病[10]。
1.1.4 脊椎畸形综合症(Complex Vertebral Malformation,CVM)CVM最早于2001年报道,患病犊牛表现为体重减轻、脊椎畸形、腿部肌腱萎缩等症状,导致母牛妊娠期流产、早产、死产,或犊牛出生后短期内死亡[11]。其致病机理是牛3号染色体上SLC35A3基因的第559位碱基发生了G/T的错义突变,其编码的氨基酸由缬氨酸变为苯丙氨酸,导致编码溶质载体家族35A3功能障碍,从而引起临床发病[12]。
1.1.5 短脊柱综合症(Brachyspina,BS)BS最早于2006年发现,对患病死胎解剖显示,患病牛发育迟缓,颈椎和胸椎严重缩短,胸椎前有刺状突起,四肢细长,外形像麋鹿[13]。BS致病机理是牛21号染色体上FANCI基因发生了一段3 329 bp缺失,组成FANCI基因的37个外显子中25~27号外显子丢失,第28号外显子提前出现终止密码,引起了无义介导的RNA衰退[14]。
1.2 遗传缺陷单倍型 单倍型是在同一染色体上多个位点等位基因的组合,常作为一个整体进行遗传[15]。2011年,3种导致荷斯坦牛胚胎死亡的单倍型(HH1、HH2和HH3)被最早鉴定出来[16],后续还发现了HH4、HH5及HCD。尽管这些缺陷单倍型的致病基因后续已研究明确,但命名仍沿用最早的名称。
1.2.1 HH1(Holstein Lethal Haplotype 1)HH1胚胎致死单倍型起初被定位于牛5号染色体58~66 Mb位置区域(UMD 3.0 genome assembly)[16]。之后,Adams等[17-18]通过全基因组重测序发现在APAF1(Apoptotic Peptidase Activating Factor 1)基因上存在1个C/T无义突变,使编码谷氨酸的密码子突变为终止密码子,导致APAF1基因编码的蛋白质缺失约1/3;APAF1编码蛋白是细胞色素C介导的细胞凋亡途径的必需分子,在胚胎发育中发挥重要作用,因此该突变很可能是HH1的致病位点。
1.2.2 HH2(Holstein Lethal Haplotype 2)HH2胚胎致死单倍型最早被定位于牛1号染色体92~97 Mb位置区域(UMD 3.0 genome assembly)[16]。2014年,McClure等[19]通过外显子测序技术将HH2致病位点的区域缩小到牛1号染色体94.86~96.55 Mb位置。目前HH2遗传缺陷单倍型的分子机制尚不明确。
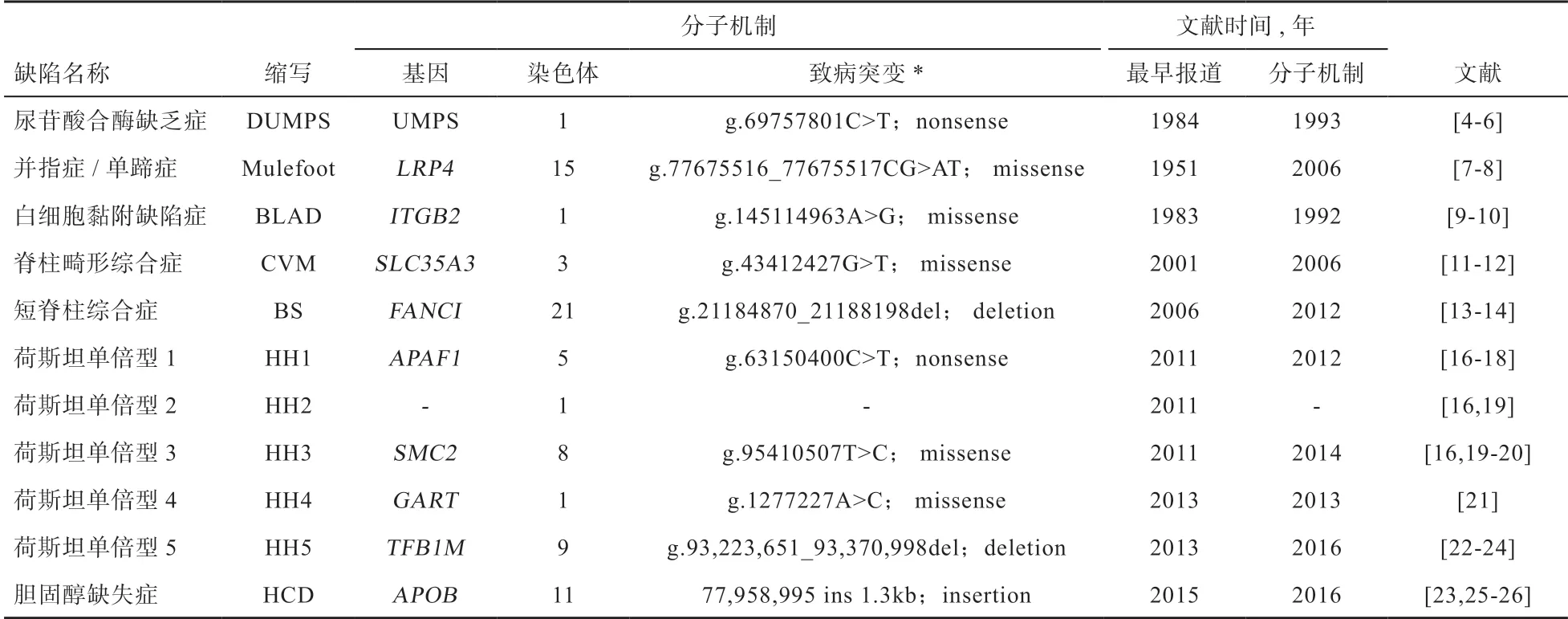
表1 荷斯坦牛常见遗传缺陷的分子机制
1.2.3 HH3(Holstein Lethal Haplotype 3)HH3胚胎致死单倍型起初被定位于牛8号染色体90~95 Mb位置区域(UMD 3.0 genome assembly)[16]。2014年,McClure等[19]通过外显子测序技术发现牛8号染色体SMC2(Structural Maintenance of Chromosomes 2)基因上1个T/C突变,导致编码的氨基酸由苯丙氨酸突变为丝氨酸。SMC2基因在染色体结构维持和DNA修复中起关键作用,突变导致SMC2基因功能异常,最终导致胚胎死亡。同年,Daetwyler等[20]通过分析234头公牛的全基因组测序数据也定位到HH3致因突变。
1.2.4 HH4(Holstein Lethal Haplotype 4)2013年,Fritz等[21]通过分析法国荷斯坦牛SNP芯片数据及全基因组测序数据,确定了HH4胚胎致死单倍型的致病机理,即牛1号染色体的GART(Glycinamide Ribonucleotide Transformylase)基因编码区内的A/C突变,导致编码氨基酸从天冬氨酸突变为苏氨酸。由于GART基因编码甘氨酰胺核苷酸转甲酰基转移酶,而该物质在嘌呤的生物合成中起关键作用,发生突变后GART功能丧失,嘌呤无法合成,最终导致胚胎在妊娠早期死亡[21]。
1.2.5 HH5(Holstein Lethal Haplotype 5)2013年,Cooper等[22]将HH5胚胎致死单倍型位点定位在牛9号染色体。之后,致病机理被确认为牛9号染色体上1个长达138 kb的缺失,其中包含整个TFB1M(Dimethyl-Adenosine Transferase 1)基因[23]。TFB1M对于线粒体中启动蛋白翻译起决定性作用,该突变导致胚胎在妊娠前60 d内发生死亡[24]。
1.2.6 HCD(Holstein Haplotype for Cholesterol Deficiency)HCD最早由德国学者在2015年报道,表现为犊牛慢性腹泻、生长受阻,继发肺炎、水肿等症状,一般在出生后3周到6月内死亡,血液化学分析显示患病犊牛血浆胆固醇浓度明显降低[25]。起初定位的HCD单倍型位于11号染色体74.5~77.0 Mb[25],后续研究证明其分子机理为APOB(Apolipoprotein B)基因内,发生1 299 bp内源性逆转录酶病毒LTR的插入(ERV2-1),造成牛APOB蛋白从4 567个氨基酸截短至135个氨基酸[23,26]。APOB基因编码载脂蛋白B,它是胆固醇和低密度脂蛋白的主要载脂蛋白,突变使其无法实现生理学功能[23,26]。
2 遗传缺陷基因的来源及传递方式
2.1 缺陷基因的来源 DNA作为遗传信息载体,在从亲代向子代传递过程中,并非100%保守,而是以极低概率(2.2×10-9)[27]发生突变。新产生的突变大多为中性,但也存在有利或有害的突变。根据群体遗传学理论,有害突变纯合子因繁殖力和生活力下降,会被自然选择逐渐清除,但在遗传漂变和选择搭车效应(即因与有利突变处于密切连锁状态,被同时选择而提高频率)的作用下,少部分突变在群体中以杂合子形式存在。研究显示,每个人的基因组中包含约100个使基因丧失功能的有害突变[28],每头牛携带的有害基因数目与人相近[29]。遗传缺陷通常指对家畜个体造成严重影响的有害突变,表现为身体结构的缺陷或生理功能的障碍。
2.2 缺陷基因的遗传模式 目前常见的奶牛缺陷基因均受单基因控制,呈常染色体隐性遗传模式,遵循孟德尔遗传规律。1个基因座具有2个等位基因(野生型和缺陷型),缺陷型等位基因的携带者表现正常,但携带者之间交配,后代1/4概率为缺陷纯合子(图2)。
遗传缺陷的共同特征是呈家系遗传,每种缺陷基因均可以追溯到共同祖先。荷斯坦牛常见11种遗传缺陷的祖先公牛出生在1947年(Mutefoot)到1991年(HCD)(表2)。由于这些共同祖先或其直系后代曾经为著名公牛,使遗传缺陷广泛扩散。例如,BLAD祖先为出生于1952年的美国公牛“Osborndale Ivanhoe”,在美国基因组数据库中,其子代种公牛达到137头,孙代种公牛934头[30]。其儿子“Penstate Ivanhoe Star”(1963年出生)及孙子“Carlin-M Ivanhoe Bell”(1974年出生)均为世界知名公牛,且共同携带CVM和BLAD,随着遗传物质贸易使缺陷基因广泛扩散。1999年丹麦荷斯坦牛CVM携带率高达31%[12],2003年德国荷斯坦牛CVM携带率为13.2%[31];1993年丹麦荷斯坦牛BLAD携带率高达21.5%[32],德国为11.6%[33]。
CVM和BLAD 2种遗传缺陷在20世纪90年代的流行,给世界荷斯坦牛育种敲响警钟,之后各国开始重视奶牛群体遗传多样性。后续新发现的遗传缺陷(BS、HH1-5、HCD),单个基因频率都并不高(< 5%)(表2)。然而,由于常见缺陷基因有十个之多,奶牛群体的缺陷基因总体携带率居高不下。如美国农业部对87万头荷斯坦牛统计显示,26%的奶牛携带至少1种常见缺陷基因[30],凸显了遗传缺陷基因风险管理的重要性。
3 遗传缺陷的基因定位
定位缺陷基因和挖掘诊断标记是遗传缺陷研究的关键。20世纪90年代,分子标记和基因克隆技术发展,开启了奶牛遗传缺陷基因定位的研究。研究人员最早利用候选基因分析揭示了BLAD[10]和DUMPS[6]的致病机理。采用基于微卫星标记的全基因组扫描(Whole-Genome Scan)及位置候选基因分析策略,Mulefoot[8,34]和CVM[12]的分子机理先后被确定。但由于这种经典基因定位的技术局限,需要积累多世代样本和大量分子实验工作,研究周期往往需要数年。
2009年之后,牛基因组SNP芯片面世[3]加速了遗传缺陷基因定位进程。利用高密度基因组标记,不仅提高了传统基因定位的效率,还催生了新的定位策略。
3.1 纯合定位(Autozygosity Mapping)纯合定位是挖掘隐性遗传疾病的传统策略,其原理是假设发病个体(隐性纯合子)共享一段相同的染色体纯合区域。Charlier等[14]利用6个发病个体和15个正常个体的54K芯片数据,通过纯合定位将短脊柱综合症(BS)基因锁定于2.46 Mb染色体区域,进而利用全基因组测序挖掘出致因突变。
3.2 纯合子缺失(Loss of Homozygosity)定位 2011年,VanRaden等[16]最早提出通过检测纯合子缺失来挖掘遗传缺陷基因。对大规模奶牛SNP芯片数据(荷斯坦牛58 452头,娟姗牛5 288头,瑞士褐牛1 991头)分析发现,一些基因组单倍型片段在群体中频率很高,但没有纯合子出现,说明其纯合致死;将这些单倍型片段与奶牛繁殖性状进行关联分析,发现携带者之间交配会显著降低母牛受胎率,据此在3个奶牛品种中定位到5种遗传缺陷单倍型[16]。随着奶牛基因组选择技术的广泛应用和基因组标记数据积累,这种检测哈代温伯格平衡偏离程度的策略,被证明是挖掘胚胎致死遗传缺陷的高效方法[21,22,25,35]。
最近几年,随着全基因组测序成本降低,加快了从基因定位到确定致因突变的过程。特别是千牛基因组计划实施[20],为挖掘致因突变提供了有力基因组数据资源,多种新的奶牛遗传缺陷基因相继被发现。
4 遗传缺陷基因分子检测
分子标记技术尚未出现之前,判断公牛是否携带遗传缺陷基因需要测交,将待测公牛与已知携带者母牛或者携带者公牛的女儿交配,从而确定公牛基因型[36]。如今,随着遗传缺陷的致因突变或连锁标记被揭示,可以建立分子检测方法,从而准确判定个体的缺陷基因携带状态。目前有2种策略,即基于单倍型的检测和针对突变位点的检测。

表2 荷斯坦牛常见遗传缺陷名称、隐性纯合子表型、共同祖先和基因频率
4.1 单倍型检测 单倍型检测是利用基因组SNP信息,通过单倍型分析对缺陷基因等位基因进行推断[16],其特点是充分利用了奶牛基因组选择育种中积累的现成数据,不需要额外的分子检测;同时,不论SNP芯片版本和标记密度是否一致,都可以通过基因型填充和单倍型分析,较为准确地推断各种缺陷基因的状态[37]。然而,其本质上是利用缺陷基因突变周边的标记对缺陷等位基因的间接推断,准确性受标记连锁不平衡程度影响。例如对HCD的分析发现,致病单倍型与一个健康单倍型完全一致,必需辅以系谱分析才能推测携带状态[25]。这反映出单倍型推断的局限性,故有学者建议对重要种公牛,在单倍型推断基础上,仍需要分子检测验证[23]。
4.2 直接分子检测 根据致因突变类型特点,可以开发不同检测方法(表3)。
针对单个位点的分型,经典的方法有PCR产物电泳检测[26,38]、PCR-RFLP[10,21,39]等,使用常规仪器即可完成检测,成本较低。但适用性有明显局限,需设计等位基因特异性引物,或者必需被酶切位点所识别,且需要多个实验步骤、耗时长。一些基于荧光信号的检测方法,例如TaqMan探针法[14,40]、高分辨熔解曲线法[23]、KASP方法[41],灵敏性和准确性更高,是当前遗传变异分型的主流方法;因其在PCR过程中或在PCR之后采集荧光信号即可分型,没有额外的实验步骤,故耗时较短。
针对多位点的分型,目前流行的方法是Mass Array核酸质谱分析[19]及微流控芯片[42]。前者通过引物延伸与时间飞行质谱技术结合实现等位基因判型。由于检测过程需要多重PCR,故对引物设计有较高的要求。后者是SNP分型技术和微流控芯片技术结合的新型检测手段,将点样、反应、检测等基本操作单元集成到一块微米尺度的芯片上,自动完成分析全过程[42]。最近,该方法被用于对8种常见奶牛遗传缺陷的分型[43]。
5 遗传缺陷基因对奶牛生产影响及经济损失
遗传缺陷所引起的经济损失主要体现在胚胎发育失败、新生犊牛死亡以及母牛流产导致的生产性能和利用价值降低等。
5.1 对生产的影响
5.1.1 对母牛繁殖力影响 繁殖力一直是高产奶牛管理和选育的难题。胚胎死亡是繁殖力降低的原因之一。有研究报道1980—2006年,荷斯坦母牛产犊率从55%降低到40%,而早期胚胎死亡发生的频率则由28%增长到43%[44]。常见的11种遗传缺陷中,HH1-5、DUMPS、CVM和BS隐性纯合时均导致胚胎死亡,母牛流产。
对美国荷斯坦牛的统计显示,风险交配(母牛的父亲及母牛的与配公牛均为携带者)与非风险交配(均为非携带者)相比,HH1、HH2、HH3分别导致妊娠率降低3.1%、3.0%、3.2%,死胎率增加0.7%、1.8%、1.0%[16]。法国荷斯坦牛5种遗传缺陷(HH1、HH3、HH4、BS、CVM)频率为1.7%~4.6%,风险交配较非风险交配的母牛产犊率降低0.35%~9.89%[21]。德国荷斯坦牛5种遗传缺陷(HH1-5)在2012—2014年出生母牛中的频率为0.88%~3.29%,除HH2之外的4种遗传缺陷,风险交配较非风险交配导致56 d非返情率和90 d非返情率下降1.6%~9.2%,而HH2因频率较低而统计不显著[45]。
5.1.2 对犊牛健康影响 CVM和BS缺陷基因纯合子除导致胚胎死亡之外,有部分胎儿可以出生,但因骨骼发育畸形而死亡[12,14]。Mulefoot缺陷基因导致犊牛蹄畸形,出生后立即淘汰[8]。BLAD[10]和HCD[25]分别导致犊牛免疫缺陷和胆固醇代谢缺陷,出生数周内死亡。
5.1.3 其他影响 一些初步研究发现,DUMPS和HCD缺陷等位基因并非完全隐性,缺陷基因对携带者的生化指标有一定影响。DUMPS携带者牛的一些组织表现出酶活性降低,导致泌乳牛的乳及尿中4-羧基尿嘧啶(乳清酸)水平升高[46]。HCD携带者公牛与纯合子公牛相比,血液甘油三酯(TAG)、磷脂(PL)、总胆固醇(TC)显著低,但没有出现任何消化不良的临床症状,说明携带者有维持胆固醇和脂蛋白生物合成的能力[47]。但在人类上的研究显示,APOB基因变异导致家族性低β脂蛋白血症(FHBL),携带者虽然一般无症状,但更易于出现脂肪肝和肠道吸收不良[48]。因此HCD对奶牛的影响仍有待深入研究。
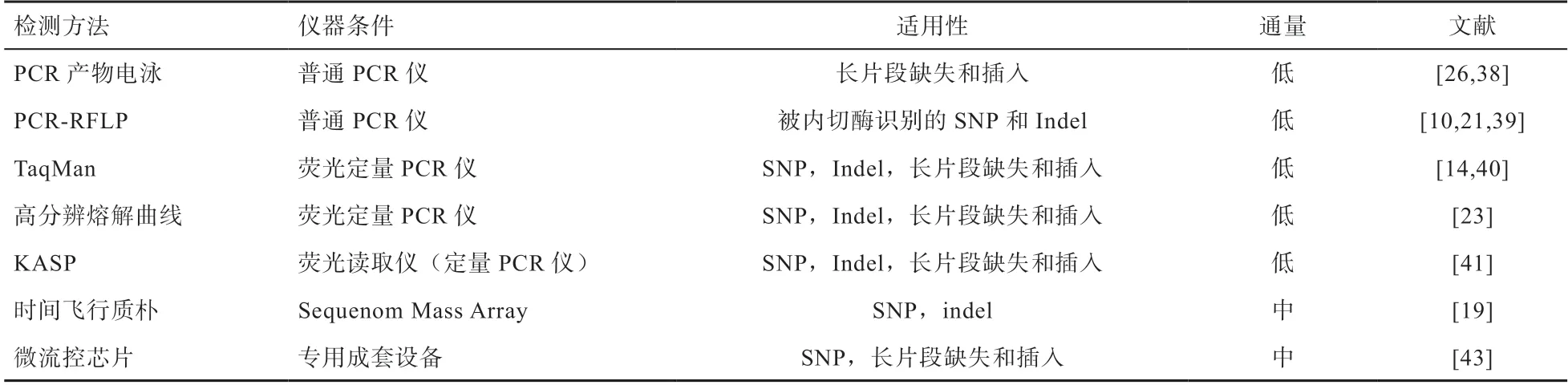
表3 遗传缺陷基因的分子检测方法
5.2 遗传缺陷基因带来的经济损失 将胚胎死亡带来的经济损失量化,来源分2个部分:一是使母牛受孕(人工授精)的成本,二是增加产犊间隔的成本。研究发现,尽管HH1-5均能够引起胚胎死亡,但所造成的经济损失并不相同,因该基因在妊娠过程中造成胚胎死亡的时间而异,HH1、HH2导致胚胎56~90 d死亡,而HH3、HH4、HH5造成胚胎在56 d前死亡。据测算,使母牛怀孕的平均成本为15欧元,而妊娠期间母牛每天饲养成本1.3欧元,由此估计HH1和HH2经济损失为97欧元,HH3、HH4和HH5为70欧元[45]。在美国,母牛流产的经济损失测算为200美元/头,犊牛早期(假设平均21日龄)死亡损失342美元(出生犊牛300美元+每天2美元),据此估计美国奶牛生产中因常见遗传缺陷造成的损失为1 074万美元/年[30]。若加上因母牛流产及犊牛死亡造成的兽医治疗费用,实际损失会更高。
6 缺陷基因的遗传管理
对缺陷基因的遗传管理有两种简单做法。第一,在配种中完全不考虑遗传缺陷,这显然会造成损失,特别是对于母牛小群体,若所用种公牛有限,携带者公牛会快速提升群体缺陷基因频率和经济风险。第二,完全避免使用遗传缺陷携带者公牛,这样缩小了可用公牛的范围,使虽携带遗传缺陷基因但综合遗传性能很高的公牛没有得到充分利用,导致遗传进展降低。对奥地利Fleckvieh牛的研究显示,如果完全弃用6种遗传缺陷携带者,将导致遗传进展减少7%,生产效益降低9%[49]。
随着越来越多的奶牛遗传缺陷被发现,完全直接淘汰遗传缺陷携带者既不现实也不经济[50],合理做法是充分考虑多个遗传缺陷基因,通过科学选配降低缺陷基因纯合概率,实现效益最大化。
对于单个缺陷基因的管理,行之有效的办法是避免携带者交配,从而控制因风险交配而产生缺陷基因纯合子。针对多个缺陷基因,相关学者提出2种新策略。一种是用遗传指数(Genetic Index,GI)来选择母牛,其中所考虑的遗传特征既包括缺陷基因也包括有利基因(如无角),GI综合了各个遗传特征的基因型、等位基因频率和经济加权;而对公牛一方,仍根据综合育种值来选择,以保持较快的群体选择进展[45]。另一种是兼顾近交和遗传缺陷基因的选配策略,即针对任何一个交配组合,估计后代育种值为双亲育种值的均值(Parent Average,PA)减去近交罚分及遗传缺陷罚分[37];该策略综合考虑多基因效应、近交及遗传缺陷基因型,理论上更合理。
7 结语与展望
世界范围内,以奶牛为引领的动物育种产业已进入基因组选择时代,遗传改良速率实现前所未有的提高,动物生产性能将继续提升。同时,基因组学及功能基因组学的深入发展,反向遗传学、表观遗传学、基因编辑技术方兴未艾,将使人们能够准确、快速鉴定出更多有害突变。这不仅有助于理解生物的基因组进化和重要表型遗传机制,还为选育更健康的动物提供了可能。此外,在基于基因组信息的选种和选配策略中,如何优化考虑多基因效应和少数遗传缺陷有害基因及有利基因(如酪蛋白基因、无角基因),将是今后奶牛遗传缺陷基因应用研究的重要领域。
