灯盏花乙素苷元结构修饰的研究进展
2020-08-15韩官甫李润涛
韩官甫 李润涛 张 伟
1.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;2. 昆明龙津药业股份有限公司,云南 昆明 650503;3.北京大学药学院,北京 100191
《柳叶刀》2017全球疾病负担研究(Global Burden of Disease Study 2017, GBD)显示目前世界范围内,慢性非传染性疾病(NCD)死亡人数占全球总死亡人数的73.4%(4110万),其中心脑血管疾病死亡的人数(1780万)是NCD最大的死亡原因,在2007~2017年十年间,全球因心脑血管疾病造成的死亡人数同比增加21.1%,针对心脑血管疾病的防治面临极大的挑战[1]。
目前,中药在心脑血管疾病的预防和治疗中发挥着重要作用,我国脑血管病治疗方案已经成为国际最高标准。心脑血管疾病是机体复杂因素引起,血瘀是中医理论中心脑血管疾病的主要发病原因,中药治疗心脑血管疾病的机理主要通过改善心脑及周围血管功能,提高靶器官血液循环,抑制组织增生,调节机体的免疫力等多靶点、多环节作用来发挥疗效[2]。通过对已有的,有明确药理活性的中药有效成分进行结构改造是目前开发新药的有效手段之一。自20世纪七十年代起,灯盏花乙素(图1.1)就被制成各种制剂用于治疗心脑血管疾病,有巨大的发展潜力,值得药学工作者深入研究。
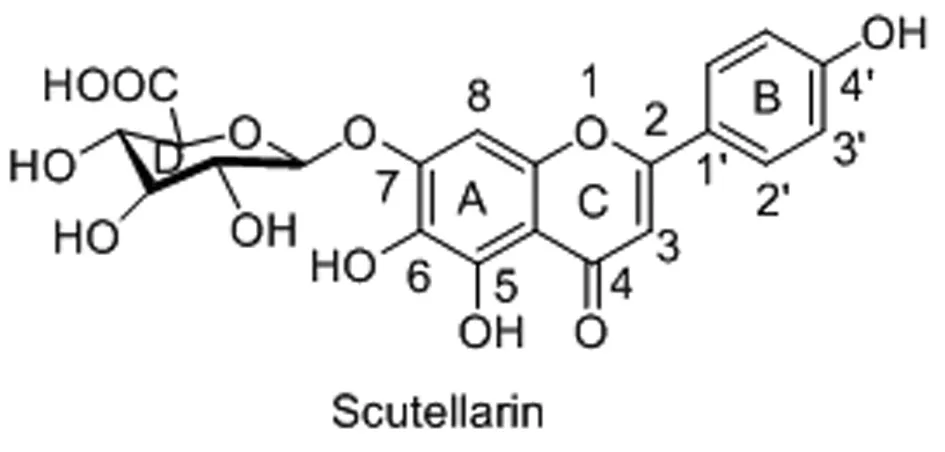
图1 灯盏花乙素的化学结构
灯盏花又名灯盏细辛, 是菊科植物短葶飞蓬Erigeronbreviscapus(Vant.) Hand.-Mazz.的干燥全草,以根或全草入药, 微苦, 甘温辛, 性温, 归心、肝经, 具有祛风除湿、活络止痛功效。灯盏花主要产于我国云南、湖南、贵州等地,其中云南省能入药的灯盏花资源占全国总资源总量的95%以上[3]。灯盏花乙素是灯盏花中含有的明确药效成分,主要药理作用为抗炎、抗氧化、抗凋亡、抗纤维化、神经保护、抗凝及改善循环[4],最近有报道称其具有潜在的降血糖和保护肾脏等作用[5]。
尽管灯盏花乙素(Scutellarin)在临床使用中有着确切的疗效,但该药物目前也存在缺点:水溶性差(0.056g/L)、脂溶性差(logP=-2.56,pH=4.2磷酸缓冲溶液)、口服生物利用度低(0.4%),半衰期短(52±29min)等缺点,这些缺点限制了灯盏花乙素类药物在临床中的使用。
灯盏花乙素苷元1-1(图2)是灯盏花乙素在人体内的主要吸收形式,且与灯盏花乙素相比,其口服生物利用度是灯盏花乙素的3倍[6],但是灯盏花乙素苷元也存在溶解度和稳定性差,生物利用度低和活性弱等缺陷。将有活性的天然产物作为先导化合物,对其进行结构修饰是目前新药开发有效手段之一。因此对灯盏花乙素进行相关结构改造,希望以此获得活性更高,溶解度更高,生物利用度改善的衍生物。目前,针对灯盏花乙素苷元的结构优化主要集中在A环和B环上,下面依次进行介绍。
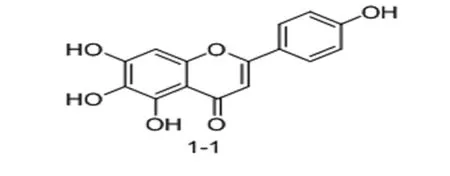
图2 灯盏花乙素苷元的化学结构
1 灯盏花乙素苷元A环结构改造
1.1 灯盏花乙素苷元A环6位结构改造 段金廒课题组[7]对灯盏花乙素苷元的四个羟基分别进行单甲基化,双甲基化和三甲基化后发现:6-位甲基化灯盏花乙素苷元1-2(图三)显示出比灯盏花乙素苷元更优的抗血栓形成活性,更强的抗氧化活性以及更好的溶解性和脂水分配系数。提示化合物1-2可以作为心脑血管疾病治疗的先导化合物。该课题组[8]在此前工作的基础上,为了改善代谢稳定性及提高生物利用度,在灯盏花乙素苷元6位引入常见含氮药效基团。结果表明,当6-位取代基为N,N-二异丙氨乙基时(图3,1-3),该化合物的抗凝血活性、抗氧化活性及水溶性都有明显提高。
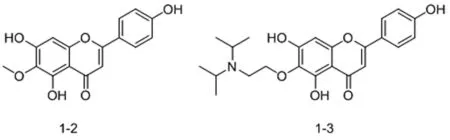
图3 灯盏花乙素苷元6位改造的化学结构
1.2 灯盏花乙素苷元A环7位结构改造 杨丽梅[9]通过药理活性测试初步证实灯盏花乙素结构中的葡萄糖醛酸基团对药理活性作用不大,设计合成了18个灯盏花乙素苷元的衍生物:苷元酯类化合物3个、醚类苷元化合物14个和磺酸钠盐苷元化合物1个,对其进行药理活性测试,发现化合物1-4(图4)在保持灯盏花乙素苷元活性的同时对缺氧损伤的原代大鼠心肌细胞和SHSY5Y细胞具有更优的保护作用。并根据活性测试结果推断灯盏花乙素4′-羟基对缺氧损伤大鼠心肌细胞的保护起决定性因素。

图4 灯盏花乙素苷元7位改造的化学结构
1.3 灯盏花乙素苷元A环8位结构改造 李念光等[10]将灯盏花乙素苷元与凝血酶(2R2M)进行分子对接发现,灯盏花乙素苷元的B环和C环能够很好的与凝血酶S2和S1口袋相结合,但是A环只能与S3口袋结合一部分,因此他们尝试利用曼尼希反应在A环引入一系列脂肪胺和脂环族胺制备灯盏花乙素苷元8-氨基甲基化衍生物。并通过凝血酶原时间(PT),活化部分凝血活酶时间(APTT),凝血酶时间(TT)和纤维蛋白原(FIB)的分析测试了所有化合物的凝血酶抑制活性。根据测试结果,在合成的一系列化合物中发现当8位为吗啉基亚甲基取代化合物1-5(图5)时与灯盏花乙素苷元相比具有更强的抗凝活性,更好的水溶性和更优的抗氧化活性,该结果对灯盏花乙素苷元进一步结构修饰提供了新思路。
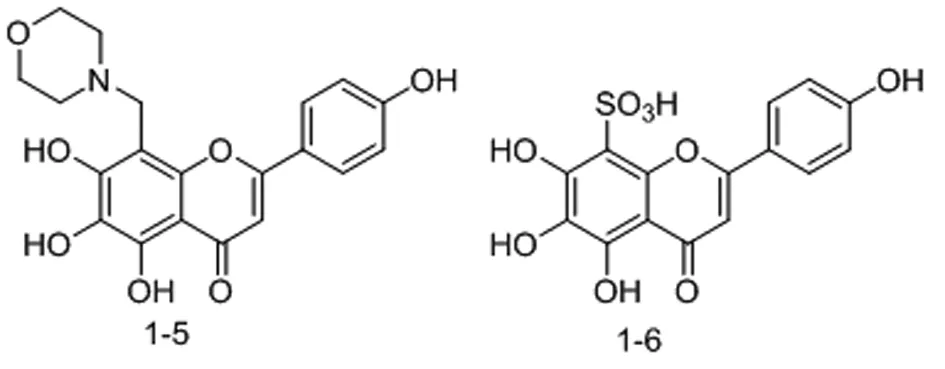
图5 灯盏花乙素苷元8位改造的化学结构
随后,该课题组[11]为了进一步解决灯盏花乙素苷元水溶性较差这一问题,继续对8位进行结构修饰。目前,对类黄酮类化合物进行磺酸化是增加其溶解度的有效方法之一[12]。当在灯盏花乙素苷元8位引入磺酸集团后,发现化合物1-6(图5)的溶解度为1949.64 μg/mL,而灯盏花乙素苷元仅为6.85 μg/mL,与此同时母体化合物的生物活性仍得以保留。
2 灯盏花乙素苷元B环结构改造
药物拼合是现代新药开发的有效手段之一,通过将两个不同药效的化合物拼合在一起发挥协同作用,不但增加药物的活性,同时能降低毒副作用等[13]。将灯盏花乙素苷元与其它药效基团拼接也为进一步结构改造提供了方向。
2.1 灯盏花乙素苷元B环4’位结构改造(连接氨基酸类) 为了设计合成有较强神经细胞氧化损伤保护作用的灯盏乙素苷元衍生物,傅晓钟等[14]以灯盏花乙素苷元为先导化合物,利用药物拼合原理在其4’-羟基上引入L-氨基酸酯、醚结构, 设计并合成11个衍生物。通过H2O2诱导PC12细胞氧化损伤模型对这一系列衍生物进行体外抗氧化活性评价, 同时进行了目标化合物理化性质研究。发现设计合成的系列化合物均具有抗氧化活性,溶解度也有一定提高,但通过稳定性实验发现灯盏乙素苷元4’-L-氨基酸酯类化合物可能会在体内分解为灯盏花乙素苷元致其相对生物利用度无明显变化,尤其是在中性条件下酯类化合物降解半衰期(t1/2) 0.5 h。
随后该课题组[15]为了解决灯盏花乙素苷元4′-L-氨基酸酯类化合物在弱酸环境下不稳定的缺点,在氨基酸的羧基和氨基中插入苯环以防止其在体内快速水解,获得了一系列新的前药衍生物,其中化合物1-7(图6)的稳定性得到极大提升,并且该衍生物能在体内通过酶促反应快速释放原药,进一步发挥抗氧化作用,可以作为有潜力的候选药物继续进行研究。
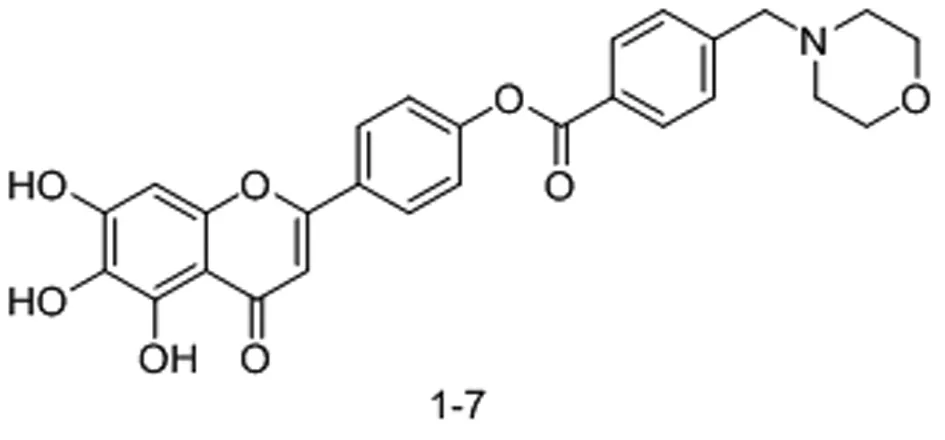
图6 灯盏花乙素苷元4’位连接氨基甲酸酯的化学结构
2.2 灯盏花乙素苷元B环4’位结构改造(连接氮芥) 氮芥是最早用于治疗肿瘤且效果明显的抗肿瘤药物,该药物进入人体后通过分子内成环作用,形成高度活泼的乙酰亚胺离子,一方面可以有效的发挥抗癌作用,但另一方面也有极强的致癌副作用[16]。而灯盏花乙素作为天然的多酚类化合物,有着广谱的生物活性和低毒性。其本身也有诱导细胞凋亡[17]、抑制迁移和侵袭[18]和对敏感细胞的化疗[19]等作用。
将灯盏花乙素苷元与氮芥进行拼接有可能开发出一款新的抗肿瘤新药。基于这一原理,李大宏课题组[20]将灯盏花乙素苷元与氮芥进行拼合,得到3个化合物1-8 a-c(图7),这三个化合物对MCF-7(乳腺癌)和Bel-7402(肝癌)细胞表现出良好的抗增殖活性,IC50值在1.50-9.07μM之间;1-8a和1-8c对A549(肺癌)细胞系表现出中等活性,IC50值分别为21.47 μM和23.51 μM。

图7 灯盏花乙素苷元4’位连接氮芥的化学结构
综合以上体外活性结果,选择对化合物1-8 a进行MCF-7细胞系的相关研究。机理研究表明,1-8 a可以诱导MCF-7细胞凋亡,将MCF-7细胞周期阻滞在G1期,并以浓度依赖的方式引起线粒体功能障碍。此外,促凋亡蛋白caspase-9、caspase-3、Bax和cytochrome c,以及抗凋亡蛋白Bcl-2的表达降低,也都证实化合物1-8 a诱导MCF-7细胞内在的凋亡途径。强大的抗增殖活性和良好的选择性使化合物1-8 a做为潜在的抗肿瘤药物被该课题组进一步开发。
3 小结与展望
对以上灯盏花乙素苷元的结构修饰进行总结,发现目前得到活性较好的新化合物集中在A环的6、7、8位和C环的4’位酚羟基的醚化或酯化,对芳香环的修饰还未触及,仍有很大的改造空间;一些新药中常见的药效基团如F、CF3和环丙烷等也可以作为电子等排体适当引入,以期能得到活性更好,理化性质更强的新药;将两个或多个相似活性的药物进行化学拼合以找到效果更好的药物这一新药开发手段也可以用于该化合物进一步的结构修饰中。
