规模化种猪场几种病毒性疫病抗体水平及病原检测分析
2020-08-15蔺俐仲徐春志景书灏李照伟
蔺俐仲,徐春志,张 海,景书灏,杨 源,刘 艳,刘 霞,李照伟
(1.贵阳市草地站,贵州 贵阳 550081;2.贵阳市动物疫病预防控制中心,贵州 贵阳 550081;3.贵州省动物疫病预防控制中心,贵州 贵阳 550081)
FMD(猪口蹄疫)、CSF(猪瘟)、PRRS(猪繁殖与呼吸综合征)和PR(猪伪狂犬病)是规模化养猪场最常见的几种主要病毒性疫病[1],也是当前我国开展“规模化种猪场主要动物疫病净化创建场”和“规模化种猪场主要动物疫病净化示范场”评估认证工作中必检的疫病。其中,FMD是严重危害偶蹄动物的传染病,主要引起畜体口腔黏膜、舌面、唇、鼻镜、乳头及蹄叉等部位形成或发生水疱,严重者可致死亡,严重影响畜牧业的健康持续发展,并造成巨大经济损失,甚至还会带来国际政治影响,素有“政治经济病”之称[2],使家畜及其产品的国际贸易受阻[3]。CSF、PRRS和PR是猪群常见的繁殖障碍性疫病,可导致妊娠母猪流产,产死胎、木乃伊胎、病弱胎或畸形胎,严重危害畜牧业的发展[4]。因此,做好上述几种病毒性疫病的检测评估与净化对养猪场十分必要[5]。为了掌握某种猪场FMD、CSF、PRRS和PR的免疫抗体水平以及野毒感染情况,以加快贵阳市规模化养猪场主要动物疫病净化工作步伐,课题组于2019年6—9月对某种猪场开展了猪群健康状态监测评估,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 血清和组织样本 2019年6—8月采集贵阳市某规模化种猪场血清和扁桃体组织样本各362份,其中生产公猪12份,后备母猪166份,经产母猪184份。经调查,所采集猪只于2019年4—5月期间分别免疫过猪口蹄疫O型灭活疫苗(新疆天康)、高致病性猪蓝耳病弱毒疫苗(新疆天康)、猪瘟传代细胞苗(哈药集团)和猪伪狂犬病活疫苗(武汉科前)。具体免疫程序如下:FMD(每4个月免疫1次),CSF(种公猪每年春、秋季各免疫1次;种母猪配种前10 d免疫1次,产后10 d加强免疫1次,以后每次免疫应于产后进行,妊娠期不再免疫),PRRS(种公猪每年春、秋季各免疫1次;后备种猪配种前5~6周和2~3周各免疫1次;生产母猪配种前12 d免疫1次,以后每5个月免疫1次)和PR(种公猪每年春、秋季各免疫1次;后备种猪配种前7 d免疫1次,以后每隔4个月免疫1次)。
1.1.2 检测试剂盒 猪O型口蹄疫病毒、猪繁殖与呼吸综合征病毒、猪瘟病毒、猪伪狂犬病病毒gB蛋白和猪伪狂犬病病毒gE蛋白ELISA抗体检测试剂盒购自武汉科前动物生物制品有限公司;猪口蹄疫病毒非结构蛋白3ABC-ELISA抗体检测试剂盒购自深圳市康百得生物科技有限公司;口蹄疫病毒、猪繁殖与呼吸综合征病毒通用型实时荧光RT-PCR检测试剂盒,猪瘟病毒野毒株实时荧光RT-PCR检测试剂盒和猪伪狂犬病病毒(gE基因)实时荧光PCR检测试剂盒均购自北京世纪元亨动物防疫技术有限公司。
1.2 方法
1.2.1 血清抗体检测 采集的血清样本按照标记顺序严格按上述6种ELISA抗体检测试剂盒操作说明分别进行FMD、CSF、PRRS、PR的抗体水平检测和结果判定。
1.2.2 实时荧光PCR/RT-PCR检测 取采集的扁桃体组织样本置于灭菌的1.5 mL离心管中,按3~5倍体积加入0.9%的生理盐水后采用手持式研磨器研磨匀浆,反复冻融3次后12 000 r/min高速离心,取上清液作为备检样本。按照上述病毒核酸提取试剂盒操作说明对备检样本进行病毒核酸提取,并按上述实时荧光PCR/RT-PCR扩增试剂盒操作说明分别进行体系构建和目的基因扩增,扩增结束后观察扩增曲线和CT值对结果进行判定。
2 结果
2.1 FMD、CSF、PRRS和PR免疫抗体检测结果
362 份猪血清经猪O型口蹄疫病毒(FMDV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪伪狂犬病病毒(PRV)gB蛋白ELISA抗体检测试剂盒检测,结果见表1。
表1检测结果显示,猪群FMD、CSF、PRRS和PR的抗体阳性率依次为90.61%、94.75%、88.12%和96.96%。由于该种猪场已免疫过FMD、CSF、PRRS和PR疫苗,且临床上未观察到上述4种疫病的症状,猪群临床健康状况良好,检测结果表明4种疫病的整体抗体阳性率较高,均超过了国家规定标准70%,说明该场的疫苗免疫效果较好。
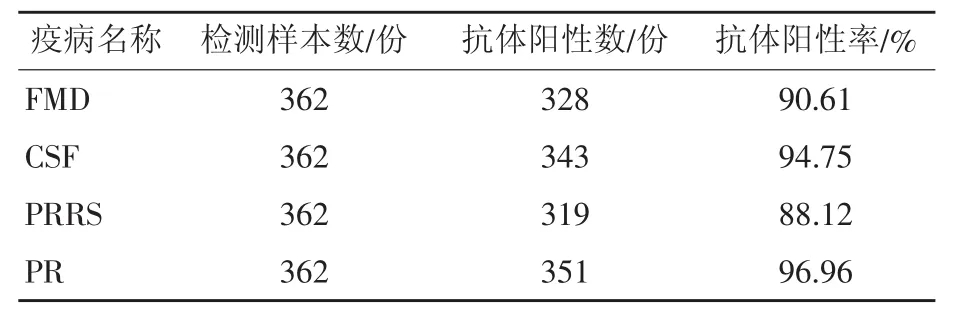
表1 免疫抗体检测结果
2.2 FMD和PR感染抗体检测结果
362 份猪血清经猪口蹄疫病毒非结构蛋白3ABC-ELISA抗体检测试剂盒和猪伪狂犬病病毒gE蛋白ELISA抗体检测试剂盒检测,结果见表2。
表2检测结果显示,猪口蹄疫病毒非结构蛋白和猪伪狂犬病病毒gE蛋白抗体阳性率分别为1.38%和3.59%。由于猪口蹄疫病毒非结构蛋白3ABC-ELISA抗体检测试剂盒和猪伪狂犬病病毒gE蛋白ELISA抗体检测试剂盒检测的均为野毒感染抗体,检测结果提示:该种猪场存在FMDV和PRV隐性感染的可能性。

表2 感染抗体检测结果
2.3 FMDV、CSFV、PRRSV和 PRV实时荧光 PCR/RT-PCR检测结果
362 份猪扁桃体组织样本经 FMDV、CSFV、PRRSV和PRV实时荧光PCR/RT-PCR检测试剂盒检测,结果见表3。
表3检测结果显示,362份猪扁桃体组织样本经实时荧光PCR/RT-PCR扩增后,FMD、CSF、PRRS和PR的病毒核酸阳性率依次为 0、0.83%、0和1.38%,检测结果说明被检样本中有CSF和PR野毒感染情况。
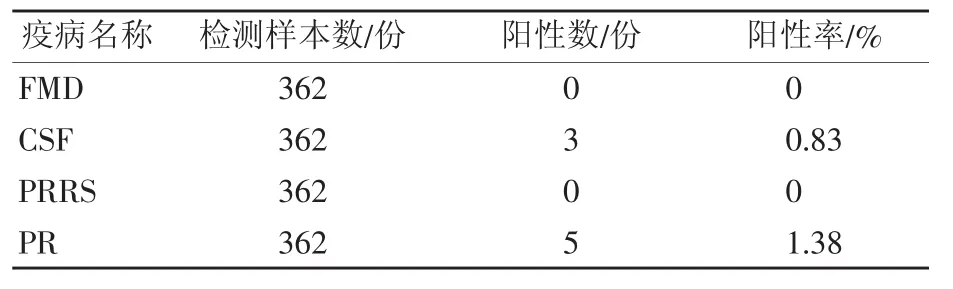
表3 实时荧光PCR/RT-PCR检测结果
3 讨论
3.1 本试验采用ELISA和实时荧光PCR/RT-PCR方法对种猪场开展了猪群健康状态检测分析,通过检测分析充分掌握了该猪场FMD、CSF、PRRS和PR的免疫抗体水平和野毒感染情况。试验结果表明:该猪场4种病毒性疫病的免疫抗体水平较高,说明疫苗免疫效果较好;但FMD和PR的野毒感染抗体检测结果提示,该猪场存在FMD和PR野毒感染的风险;实时荧光PCR/RT-PCR检测结果说明,该猪场存在CSF和PR野毒感染情况。针对上述检测结果分析评估,建议该猪场今后应继续加强疫苗免疫,并立即对检出的CSF和PR病毒核酸阳性猪只进行淘汰处理,同时加强对FMD和PR感染抗体阳性猪只的隔离和监控。
3.2 经调查,该猪场免疫的FMD和PR疫苗分别为非结构蛋白3ABC基因和gE蛋白基因缺失苗,课题组为了保证检测结果的准确性,对FMD、PR的感染情况检测采用缺失基因ELISA抗体检测和实时荧光PCR/RT-PCR相结合的方法。检测结果中PR的野毒感染抗体和实时荧光PCR均出现了阳性,且实时荧光PCR检出的阳性样本均显示野毒感染抗体阳性,进一步说明了该猪场存在PR野毒感染情况;而FMD实时荧光RT-PCR病毒核酸检出率虽为0,但野毒感染抗体检测出现了阳性,因此并不能完全排除该场存在FMD野毒感染的可能。经查阅相关资料[6-8],对FMDV核酸检测检出率最高的组织部位为颌下淋巴结,而PRV检出率最高的组织部位为三叉神经节、嗅球和脑,其次为扁桃体和内脏。本试验检测评估的猪场为临床健康猪群,未能活体采集到颌下淋巴结、三叉神经节和嗅球等组织样本,只能活体采集扁桃体组织样本替代,因此不排除实时荧光PCR/RT-PCR出现漏检的可能。
3.3 FMD、CSF、PRRS和PR是国家开展“规模化种猪场主要动物疫病净化创建场”和“规模化种猪场主要动物疫病净化示范场”评估认证指定的4个必检病种,因此做好种猪场FMD、CSF、PRRS和PR的监测评估工作十分必要。对照“两场”评估认证标准,本次所监测评估的种猪场猪群健康状态达到了申报“规模化种猪场主要动物疫病净化创建场”的要求(种猪群或后备猪群CSF免疫抗体合格率≥80%,FMD免疫抗体合格率≥70%,PR gE抗体阳性率≤10%,PRRS无临床发病记录),而要申报“规模化种猪场主要动物疫病净化示范场”免疫净化标准尚需对FMD、CSF和PR的野毒感染进行彻底净化,同时应进一步提高PRRS的免疫抗体合格率至90%以上。
