miR-133a介导Bcl-xl表达调节内皮细胞的凋亡
2020-08-14张永杰闫志刚刘慧兵孙四玉王立波赵国安
张永杰,林 飞,闫志刚,刘慧兵,孙四玉,王立波,赵国安
0 引 言
心血管疾病成为全球疾病死亡的首要原因,冠心病是心血管疾病死亡的重要组成部分,严重威胁人类健康[1]。冠心病的主要病理基础为动脉粥样硬化(atherosclerosis, AS),内皮功能障碍是As发生的启动环节[2],氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)可诱导内皮细胞凋亡[3],促进As的发生发展。因此,探讨内皮细胞凋亡途径将为As的机制研究提供新视角。
miRNA是一种长度约为22~24个核苷酸的短链非编码RNA,主要通过与靶基因mRNA3′-非编码区(3′-UTR)结合,调控靶基因蛋白表达,调节多种细胞功能(生长、分化、增值及凋亡)。在AS研究中miRNA参与斑块形成到斑块不稳定至破裂的整个过程,并调节内皮及免疫功能[4]。miR-133a不仅与斑块稳定性有关,与冠心病同样相关[5-6]。另外,高血糖、高血脂、高同型半胱氨酸均可诱导内皮细胞miR-133a增高,促使血管内皮功能紊乱,而抑制miR-133a可保护内皮功能,阻止AS的发生[7]。miR-133a是否参与调节内皮细胞凋亡,文献报道较少。B淋巴细胞瘤因子2-特大型(B-cell lymphoma extra large, Bcl-xl)在细胞线粒体凋亡途径中扮演重要角色[8],miR-133a可靶向调节Bcl-xl[9-11]。本研究旨在探讨miR-133a靶向调节Bcl-xl参与内皮细胞凋亡过程,为As的机制研究及治疗靶点提供可参数据。
1 材料与方法
1.1 主要材料原代人冠状内皮细胞(human coronal endothelial cells, HCAECs)及内皮细胞培养基(endothelial cell medium, ECM)购于美国Sciencell公司,ox-LDL购于北京索莱宝生物有限公司,MTT、BCA试剂盒购于上海碧云天生物技术有限公司,FITC标记Annexin V(Aposcreen Annexin V-FITC,Annexin V-FITC)/碘化丙啶(propidium iodide, PI)双染试剂盒和纤连蛋白购于美国BD生物技术公司,miRNA(miR-133a、miR-324、miR-133b、let-7c、let-7g、miR-491、miR-326、miR-608)、Bcl-xl及GAPDH引物合成于上海生工生物工程股份有限公司,miRNA 及mRNA反转录及qRT-PCR试剂盒购于TaKaRa公司,miRNA 沉默(inhibitor)、过表达(mimics)、无义序列(NC)、沉默无义序列(inhibitor NC, in NC)由上海吉玛基因生物有限公司合成,脂质体Lipofectamine RNAiMAX Reagent购买于赛默飞世尔科技公司,RIPA蛋白裂解液购于上海雅酶生物科技有限公司,兔抗Bcl-xl及兔抗caspase3购于美国Cell Signaling Technology公司,鼠抗β-actin购于美国Proteintech生物公司。
1.2 细胞培养首先纤连蛋白包被培养瓶(板),用含5%胎牛血清及含有内皮细胞生长因子的ECM于37℃、5% CO2饱和湿度培养箱中常规培育、传代,第3-7代用于实验。
1.3 细胞处理HCAECs接种96孔板,分别给予不同浓度(5、15、25、50、75 μg/mL)的ox-LDL处理12、24 h。HCAECs接种于6孔板,加入ox-LDL(浓度25、50、75 μg/mL)处理24 h。
1.4 细胞活力检测ox-LDL分别处理细胞12 h及24 h加入MTT(20 μL/孔),37 ℃培养箱中孵育4 h,加二甲基亚砜150 μL溶解蓝紫色结晶甲臜,酶联免疫检测仪测A490nm波长吸收值。计算细胞活力公式如下:
细胞活力=(处理组A值-空白组A值)/(对照组A值-空白组A值)×100%
1.5 miRNA筛选采用生物信息学方式(网站http://www.mirbase.org)筛选文献证实靶向调节抗凋亡蛋白Bcl-xl的miRNA(miR-133a、miR-324、miR-133b、let-7c、let-7g、miR-491、miR-326、miR-608)。
1.6 细胞转染细胞传代至6孔板,生长至60%~70%融合时进行转染。按照Lipofectamine®RNAiMAX Reagent转染试剂说明书操作,应用Opt-MEM分别稀释miR-133a inhibitor、in NC、miR-133a mimics、NC(转染混合液A)及转染试剂Lipofectamine®RNAiMAX Reagent(转染混合液B),转染混合液A及转染混合液B按1∶1体积充分混匀,室温孵育5 min后滴入6孔板,轻摇均匀,放入细胞培养箱。转染48 h后分为:无义序列组(无义序列NC)、过表达组(过表达miR-133a mimics)、沉默无义序列+诱导组(in NC+ox-LDL诱导HCAECs)、miRNA沉默+诱导组(miR-133a敲减inhibitor+ox-LDL诱导HCAECs)。无义序列组、过表达组给予更换新鲜培养基继续培养24 h;沉默无义序列+诱导组、miRNA沉默+诱导组更换含ox-LDL终浓度为75 μg/mL的新鲜培养基温箱孵育24 h。
1.7 细胞凋亡检测应用Annexin V-FITC / PI双染试剂盒,严格按照试剂盒说明书操作,0.05%胰蛋白酶消化收集细胞,预冷PBS清洗2遍,1×结合缓冲液100 μL重悬细胞,分别加Annexin V-FITC及PI各5 μL室温避光轻轻震荡15 min染色,流式细胞仪检测。FlowJo 7.6软件定量分析,以Annexin V-FITC阳性为凋亡细胞(早期凋亡Q2及晚期凋亡Q3象限)。
1.8 qRT-PCR检测预冷PBS清洗细胞2遍,加入RNAisoplus试剂裂解细胞,混匀震荡后冰上裂解10 min;加入三氯甲烷200 μL,冰上静置15 min后,4 ℃离心机12 000×g,离心15 min;加入异丙醇500 μL,冰上静置10 min,4 ℃离心机,12 000×g,离心10 min,弃上清保留沉淀,75%乙醇清洗沉淀后应用DEPC水溶解。超微量分光光度仪检测RNA浓度及纯度(A260/A280比值在1.8~2.0 )。TaKaRa反转录试剂盒进行miRNA及mRNA反转录,扩增试剂盒进行实时定量PCR,检测miRNA、Bcl-xl表达,采用2-ΔΔCt法计算目的基因的相对表达量。
1.9 Western blot分析RIPA法提取总蛋白,BCA试剂盒检测蛋白浓度。等量上样,用12%的SDS-PAGE聚丙烯酰胺凝胶(20 μg/孔),15%的SDS-PAGE聚丙烯酰胺凝胶(30 μg/孔)进行电泳,转移至PVDF膜,5%脱脂奶粉室温封闭2 h。孵育以下抗体:兔抗Bcl-xl(稀释1∶2000)、兔抗caspase3(稀释1∶500)、鼠抗β-actin(稀释1∶2000),4 ℃孵育过夜。次日清洗PVDF膜后,室温孵育二抗(稀释1∶5000)1.5 h,化学发光凝胶成像分析系统成像显影,ImageJ软件进行灰度值分析。

2 结 果
2.1 MTT法检测细胞活力细胞处理12、24 h,ox-LDL低浓度(5、15 μg/mL)时对HCAECs活力无显著抑制(P>0.05),ox-LDL浓度增加至 25、50、75 μg/mL时细胞活力较0 μg/mL降低(P<0.05);细胞处理24 h, ox-LDL 75 μg/mL的细胞活力[(47.21±2.44)%]较0 μg/mL [(100±1.18)%]明显降低(P<0.001),见图1。
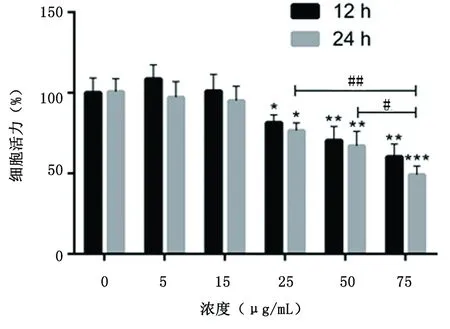
与0 μg/mL 比较, *P<0.05、**P<0.01、***P<0.001;50 μg/mL与75 μg/mL比较,#P<0.05;25 μg/mL与75 μg/mL比较,##P<0.01
2.2 qRT-PCR结果qRT-PCR结果显示miR-133a异常增高,见图2。ox-LDL 0 μg/mL的Bcl-xl mRNA表达水平(1±0.28)与25 μg/mL(1.22±0.18)、50 μg/mL(1.38±0.22)、75 μg/mL(1.19±0.16)比较差异无统计学意义(P>0.05)。过表达组细胞中miR-133a表达量(41.80±8.94)较无义序列组(1±0.31)明显增高(P<0.01)。miRNA沉默+诱导组细胞中miR-133a表达量(0.20±0.11)较沉默无义序列+诱导组(1±0.11)显著降低(P<0.001)。
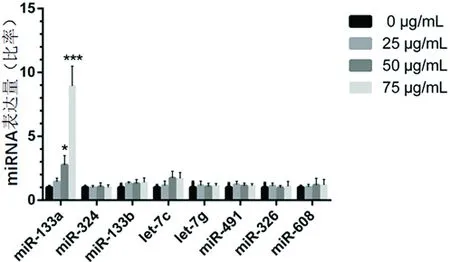
与0 μg/mL比较, *P<0.05、**P<0.01、***P<0.001
2.3 流式细胞仪检测细胞凋亡率ox-LDL 75 μg/mL的细胞凋亡率[(28.97±3.20)%]较0 μg/mL [(8.03±0.73)%]明显升高(P<0.01),见图3。miRNA沉默+诱导组细胞凋亡率(18.92±3.00)%]较沉默无义序列+诱导组[(27.1±2.01)%]明显降低(P<0.05),过表达组细胞凋亡率[(14.81±2.60)%]较无义序列组 [(8.02±1.22)%]显著增加(P<0.05)。ox-LDL诱导HCAECs的凋亡率随着miR-133a的沉默降低。见图4。

图 3 不同浓度ox-LDL处理HCAECs 24 h流式细胞检测结果

图 4 HCAECs细胞转染miR-133a后流式细胞检测结果
2.4Bcl-xl及cleaved-caspase3蛋白表达随着ox-LDL浓度(25、50、75 μg/mL)增加,抗凋亡蛋白Bcl-xl的表达量逐渐降低,cleaved-caspase3的表达量增加。见表1。过表达miR-133a之后其靶基因Bcl-xl表达量降低,而沉默miR-133a后ox-LDL诱导降低的Bcl-xl得到部分逆转。见图5。无义序列组Bcl-xl表达量(1.265±0.049)较过表达组(0.940±0.071)明显升高(P<0.05),沉默无义序列+诱导组(0.795±0.064)较miRNA沉默+诱导组(1.150±0.071)明显降低(P<0.05)。

表 1 各组间Bcl-xl、cleaved-casepase3表达量

1:0 μg/mL; 2:25 μg/mL; 3:50 μg/mL; 4:75 μg/mL
3 讨 论
内皮作为血液与血管的生理屏障,在AS发生发展中起重要作用。内皮细胞凋亡可增加平滑肌细胞增殖、迁移,促进血液凝固,参与AS发生[12]。斑块的不稳定及破裂与内皮细胞凋亡密切相关[13]。因此,内皮凋亡途径的探讨将为AS机制研究及治疗靶点提供可参数据。
在细胞凋亡信号传导中,抗凋亡蛋白Bcl-xl及Bcl-2可被凋亡启动蛋白Bid及其功能相近的因子结合隔离引起细胞色素c外流[14],进一步驱动多分子复合物激活caspase3及caspase7执行细胞凋亡[15]。Bcl-xl是Bcl-2-like1基因编码的蛋白质,为Bcl-2家族主要成员。在抗凋亡方面Bcl-xl优于Bcl-2和Mcl-1[16],过表达Bcl-xl可降低内皮细胞凋亡[17],因此,Bcl-xl在凋亡研究中更具有价值。本研究结果再次证明ox-LDL可降低内皮细胞Bcl-xl表达、激活caspase3,促进内皮细胞凋亡。
越来越多的证据表明miRNA参与AS形成的调节过程。miRNA-181b、miR-92a抗内皮炎症反应[18-19];miR-126-5p促进内皮损伤后修复[20];miR-26a阻止内皮细胞凋亡[21],均可保护内皮功能,抑制AS。本研究通过靶基因反向推导miRNA,筛选差异表达的miRNA,发现miR-133a异常增高,且呈浓度依赖性,即随着ox-LDL浓度(25~75 μg/mL)的增加miR-133a亦愈高。但是,靶基因Bcl-xl的mRNA水平各诱导组与对照组相比却未见明显差异,推测miR-133a可能通过结合Bcl-xl3′-UTR抑制蛋白翻译过程,而并非降解mRNA。
miR-133a是miR-133家族(包括miR-133a和miR-133b)一员,miR-133a和miR-133b位于不同的染色体上[22]。miR-133a是肌肉特异性miRNA,在骨骼肌及心肌正常发育和功能中发挥必不可少的作用[23]。另外,miR-133a可被神经紧张素上调,参与结肠炎的病理过程[24]。本研究首次发现过表达miR-133a可增加内皮细胞凋亡率、降低Bcl-xl表达,而沉默miR-133a后ox-LDL诱导细胞凋亡率的增高得到部分逆转。提示miR-133a参与内皮细胞凋亡过程,并有成为治疗As新靶点的可能。另外,研究还发现let-7c在各诱导组与对照组相比并不增高或降低,结果与文献报道[25]不同,文献报道所涉及的研究对象为人脐静脉内皮细胞,本研究为HCAECs,推测let-7c可能在不同组织内皮细胞中存在差异。
综上所述,本研究显示miR-133a可抑制抗凋亡蛋白Bcl-xl表达,引起内皮细胞凋亡,破坏血管内皮完整性,促进AS发生发展。
