CELL-SELEX筛选膀胱癌核酸适配体的细胞学研究
2020-08-14平秦榕梁剑伟刘杨文易王剑松颜汝平
平秦榕,李 翀,梁剑伟,刘杨文易,雷 容,王剑松,颜汝平
0 引 言
膀胱癌是泌尿系统最常见恶性肿瘤之一[1]。基于膀胱癌标志物的早期诊断和术后复发监测方法已成为目前的研究热点。核酸适配体是利用指数富集的配体系统进化技术(systematic evolution of ligand by exponential enrichment, SELEX)从人工体外合成的随机寡核苷酸序列库中筛选获得的单链DNA(或RNA)[2-3]。CELL-SELEX是指以细胞作为靶标展开的适配体筛选技术。文中报道了利用CELL-SELEX技术筛选、制备膀胱癌细胞特异性核酸适配体(aptamer)的方法,旨在为建立简便、可靠、无创、敏感性和特异性高的膀胱癌早期诊断方法提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1实验分组及细胞准备选取3种人膀胱癌细胞系(EJ细胞、T24细胞、BIU87细胞)为阳性质控组细胞,3种非膀胱癌细胞系(人正常尿路上皮细胞HCV29、人胚肾细胞293T、人肝癌细胞系huh7)为阴性质控组细胞,以上6种细胞均为中国科学院生物物理研究所感染与免疫重点实验室提供。
1.1.2单链DNA文库及PCR引物构建人工体外构建两端为21 nt的固定序列,中间为49 nt的随机序列,全长为91 nt的单链DNA文库(5′-GCC TGT TGT GAG CCT CCT AAC-N49-CAT GCT TAT TCT TGT CTC CCC-3′,文库量约1200 pmol)。根据文库序列设计相应的PCR引物,标记FITC的上游引物(5′-FITC-GCC TGT TGT GAG CCT CCT AAC-3′)和标记Biotin的下游引物(5′-Biotin-GGG AGA CAA GAA TAA GCA TG-3′)用于CELL-SELEX过程中适配体的筛选、制备,无标记的上、下游引物用于PCR扩增后的分子克隆测序。文库及PCR引物均由上海生工生物工程技术服务有限公司合成。
1.2实验方法
1.2.1 PCR反应体系确定和反应条件优化为保证PCR扩增效率最大化,筛选前需对PCR反应体系退火温度(55~65 ℃)以及循环数(7~25个循环)进行优化。PCR反应体系(50 μL):模板(ssDNA文库)2 μL、FITC-P1(10 μmol/L)2 μL、Biotin-P2(10 μmol/L)2 μL、2×Taq PCR Master MixddH2O 19 μL。PCR产物上样于3%琼脂糖凝胶电泳(100 V,30 min)后置于成像系统中观察,选择明亮度最高、弥散最少的条带为PCR最优反应条件。
1.2.2细胞准备将覆盖率达到80%~90%的细胞培养皿取出,消化、离心、重悬、计数,将所需的细胞悬液转移至15 mL离心管中备用。重复3次取平均值。细胞数计算公式如下:
细胞数(个/mL)=(计数池四个大格的细胞总数/4)×104×稀释倍数
1.2.3Cell-SELEX筛选①文库筛选:文库初始投入量为1200 pM,筛选过程中采用了3种阳性细胞进行阳性筛选,随筛选轮数增加,阳性细胞投入数量逐渐减少,孵育时间由60 min逐渐减少至30 min,洗涤次数逐渐增加。采用3种阴性细胞进行阴性筛选,随筛选轮数增加,阴性细胞投入数量逐渐增加,孵育时间由30 min逐渐增加至60 min。②PCR扩增:循环数优化:热力循环参数设置10个梯度,分别为7、9、11、13、15、17、19、21、23、25。琼脂糖凝胶电泳成像,选择DNA Marker 100 bp左右(91 bp)位置的明亮、清晰、弥散少的条带对应的循环数为最佳循环数进行PCR扩增。扩增完毕后电泳,凝胶成像验证产物。 回收PCR扩增产物,使用Gene JET PCR Purification Kit(K0701)试剂盒按步骤进行纯化。③ssDNA制备:生物素-链霉亲和素磁珠分离法制备ssDNA,用NanoDrop 2000/2000c 分光光度计对实验中FITC-ssDNA文库进行定量。计算所得FITC-ssDNA量,公式如下:
FITC-ssDNA量(pmol)=浓度(ng/μL)/[10×33(μg/OD)]×1200(pmol/OD)
调节FITC-ssDNA溶液的pH至7.5,缓冲液稀释后保存,用作下一轮的筛选。④流式细胞仪监测CELL-SELEX筛选进程 :从第3轮开始,每间隔3轮利用流式细胞仪对FITC-ssDNA分别与阳性质控细胞、阴性质控细胞的结合率进行一次检测,利用flow jo软件计算平均荧光强度值。原始ssDNA为对照。
1.2.4分子克隆测序分别选取与阳性细胞EJ、T24和BIU87结合率最高轮次的PCR模板(ssDNA),用无标记的PCR上、下游引物P1、P2进行扩增,扩增产物送交北京擎科新业生物技术有限公司进行分子克隆测序。
1.2.5适配体二级结构预测用Chromas软件对测序结果进行分析,选取富集度高的几条适配体序用Dnaman软件模拟其二级结构。
1.2.6适配体与靶细胞结合率检测分别选择与EJ、T24和BIU87亲和力最高的适配体,序列交由上海生工合成带FITC标记的ssDNA序列,通过流式细胞仪分别检测其与EJ、T24、BIU87、HCV29、293T、huh7的结合能力。
2 结 果
2.1流式细胞仪监测CELL-SELEX筛选进程结果
2.1.1 阳性筛选随筛选轮次的不断增加,FITC-ssDNA与阳性细胞的结合率不断增加。第15轮FITC-ssDNA与EJ细胞孵育后的荧光强度达最高,第18轮FITC-ssDNA与T24细胞、BIU87细胞孵育后的荧光强度达最高,继续筛选荧光强度反而降低。荧光强度最高轮次FITC-ssDNA(15轮、18轮)的平均荧光强度值明显高于对照组原始ssDNA,见图1。
2.1.2阴性筛选随筛选轮次的不断增加,FITC-ssDNA与阴性细胞的结合率不断减弱。第19轮FITC-ssDNA与HCV29细胞、293T细胞、huh7细胞孵育后的荧光强度明显低于对照组原始ssDNA,见图2。
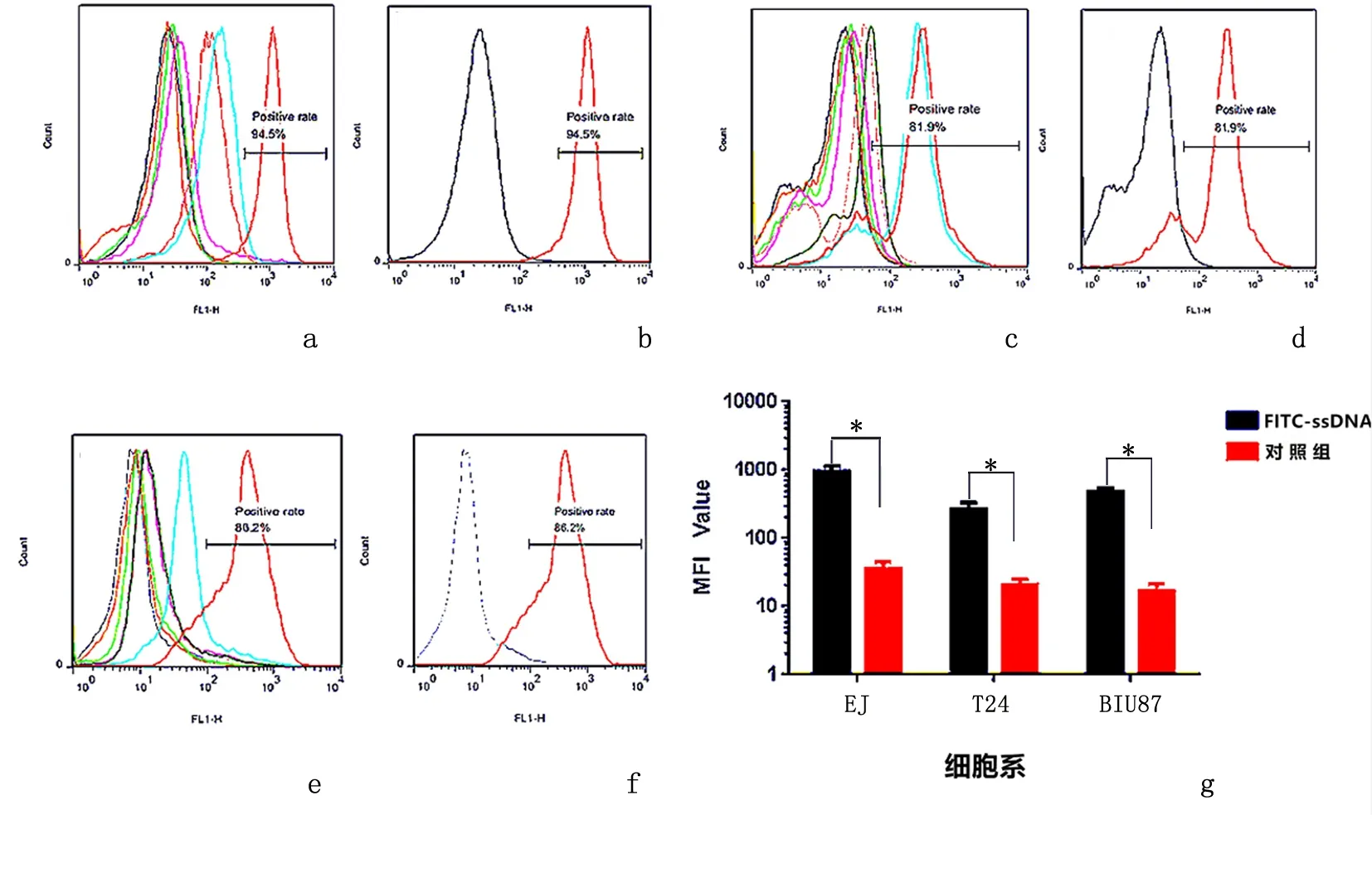
a:FITC-ssDNA与EJ细胞孵育后;b:第15轮FITC-ssDNA及对照组原始ssDNA与EJ细胞孵育后;c:FITC-ssDNA与T24细胞孵育后;d:第18轮FITC-ssDNA及对照组原始ssDNA与T24细胞孵育后;e:FITC-ssDNA与BIU87细胞孵育后;f:第18轮FITC-ssDNA及对照组原始ssDNA与BIU87细胞孵育后;g:荧光强度最高轮次FITC-ssDNA(15轮、18轮)平均荧光强度值对比(*P<0.05)
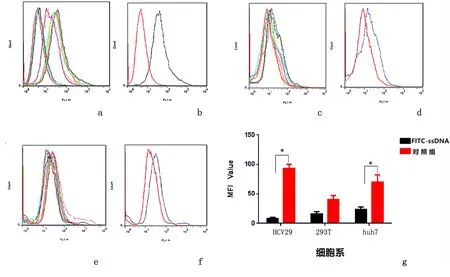
a:FITC-ssDNA与HCV29细胞孵育后;b:第19轮FITC-ssDNA及对照组原始ssDNA与HCV29细胞孵育荧光强度对比;c:FITC-ssDNA与293T细胞孵育后;d:第19轮FITC-ssDNA及对照组原始ssDNA与293T细胞孵育后;e:FITC-ssDNA与huh7细胞孵育后;f:第19轮FITC-ssDNA及对照组原始ssDNA与huh7细胞孵育后;g:第19轮平均荧光强度值对比(*P<0.05)
2.2ssDNA文库测序结果以第15轮、18轮FITC-ssDNA为模板,PCR扩增后电泳验证产物,见图3。用Chromas软件的测序结果显示第15轮ssDNA文库中共有43个不同序列,选取富集度最高的序列,命名为apt1;第18轮ssDNA文库中共有31个不同序列,选取富集度最高的序列,分别命名为apt2,apt3,见表1。利用Dnaman软件分别模拟apt1、apt2、apt3的二级结构,见图4。

表 1 ssDNA文库测序结果
2.3适配体验证流式检测结果示FITC-apt1可特异性识别EJ细胞,阳性率71.5%;FITC-apt2与T24细胞的结合率明显高于BIU87细胞;FITC-apt3与BIU87细胞的结合率明显高于T24细胞;FITC-apt2可特异性识别T24细胞,阳性率63.9%;FITC-apt3可特异性识别BIU87细胞,阳性率74.7%。见图5。
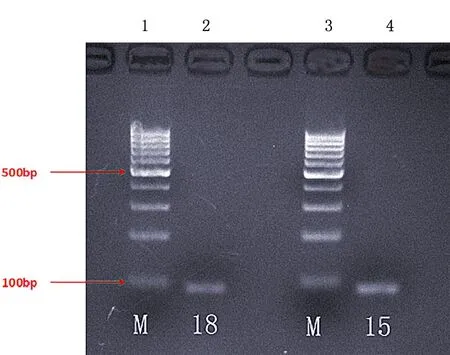
1、3:Mark;2、4:分别为第18轮和第15轮FITC-ssDNA条带
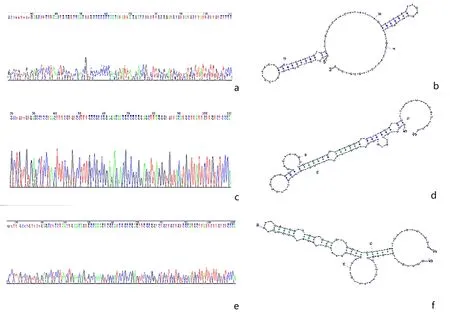
a、b:apt1测序峰图及二级结构预测;c、d:apt2测序峰图及二级结构预测;e、f:apt3测序峰图及二级结构预测
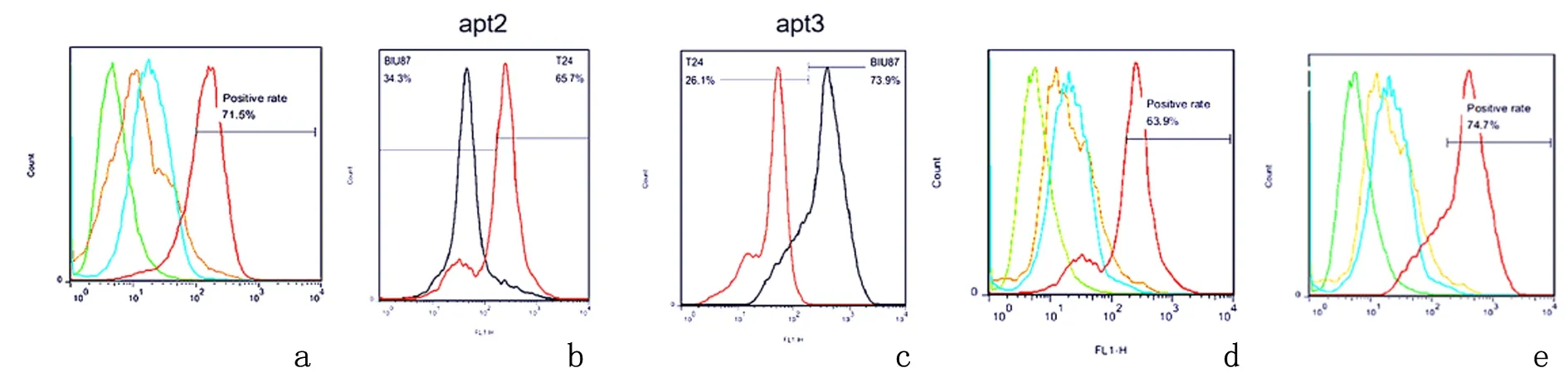
a:FITC-apt1与EJ细胞及阴性细胞孵育后;b:FITC-apt2与T24细胞、BIU87细胞孵育后;c:FITC-apt3与T24细胞、BIU87细胞孵育后;d:FITC-apt2与T24细胞及阴性细胞孵育后;e:FITC-apt3与BIU87细胞及阴性细胞孵育后
3 讨 论
膀胱癌具有多发、易复发、局部浸润和远处转移风险高的特点,早期诊断和发现肿瘤对膀胱癌的治疗和术后复发率的控制具有重要临床意义[4- 5]。
3.1核酸适配体的潜在临床应用价值核酸适配体是通过SELEX技术筛选到的一类能够特异性识别其靶物质的寡核苷酸序列(RNA或ssDNA)[6-8]。具有分子量小、稳定性好、易于修饰、无免疫原性、靶标范围广、对靶物质亲和力高、特异性强的特点[9]。近年研究表明,利用Cell-SELEX技术筛选、制备肿瘤细胞特异性的核酸适配体作为早期诊断或靶向治疗的分子探针,可为建立一种简便、无创、敏感性和特异性高的肿瘤筛查、早期诊断和术后监测方法提供实验依据,有望发掘新型的肿瘤标志物[10-12]。Rosenberg等[13]在一项II期临床实验中研究了AS1411(一种新型的DNA适配体)在转移性肾透明细胞癌中的治疗作用,发现AS1411对存在FGFR2和mTOR突变的患者具有明显的治疗作用,指出DNA适配体代表了一种可从分子水平直接靶向肿瘤细胞的新方法,进一步研发基于DNA适配体的肿瘤诊疗技术,有望在肿瘤靶向治疗和靶向成像中取得新的突破。
3.2CELL-SELEX技术筛选人膀胱癌细胞系核酸适配体本研究利用CELL-SELEX技术筛选可识别膀胱癌细胞系的适配体。其中适配体apt1可特异性识别EJ细胞,适配体apt2可特异性识别T24细胞,适配体apt3可特异性识别BIU87细胞。研究表明,控制CELL-SELEX流程的精确运行和进化是筛选获得所需核酸适配体的基本保障,筛选过程中需对各个步骤的反应条件进行优化,以保证CELL-SELEX的顺利推进[14]。本研究从细胞数量和状态、PCR反应体系、退火温度、循环数等方面对实验条件进行了优化和控制。
3.2.1细胞数量和状态的控制原始ssDNA文库中含有数量巨大的核酸适配体序列,但对靶细胞具有高亲和力的适配体群所占比例较低[15]。为防止目标核酸适配体在筛选过程中流失,去除亲和力较低的核酸适配体,本研究在筛选初期投入了大量的阳性质控细胞(9×106)和少量的阴性质控细胞(3×106),尽最大可能的将目标核酸适配体保留于文库中,以便进一步的扩增和次轮的筛选。随筛选进程的推进,阳性质控细胞的投入量逐渐减少,与ssDNA文库的孵育时间也逐渐减少;阴性质控细胞的投入量逐渐增加,与ssDNA文库的孵育时间也逐渐增加。究其原因在于,通过初期大量投入阳性质控细胞,保证目标核酸适配体被保留于文库中, PCR批量扩增后使得目标核酸适配体在文库中所占比例逐渐增加,随筛选轮数递增,减少阳性质控细胞数量和正筛的孵育时间,增加阴性质控细胞数量和反筛的孵育时间,并逐渐增加孵育后的洗涤次数,最终目的在于减少非特异性核酸适配体在文库中的数量,提高富集效率,加快筛选的进程。
细胞的状态也是影响CELL-SELEX进程的关键因素,而细胞培养的成功很大程度上取决于保护细胞免受细菌、真菌和病毒等微生物的污染,实验过程中需严格控制实验环境,熟练掌握细胞培养中的无菌操作技术[16]。
3.2.2PCR反应条件优化PCR是CELL-SELEX流程中极为关键的环节,为保证PCR扩增效率最大化,筛选前需对PCR反应体系中退火温度(55~65 ℃)以及循环数(7-25个循环)进行优化。退火温度决定PCR特异性与产量,退火温度的设计主要取决于引物的浓度、引物长度、引物自身碱基成分以及目的片段的长度等因素[17]。本研究中通过退火温度优化,最终选择58 ℃作为PCR反应体系中的最佳退火温度。
由于每一轮筛选所得ssDNA文库的浓度不同,且ssDNA文库的总体积有限(仅500 μL),为保证模板量的充足和扩增效率的最大化,本研究将每一轮筛选后所得ssDNA文库作为PCR模板进行扩增,琼脂糖凝胶电泳后置于成像系统中观察不同循环数下条带亮度,优化该轮PCR扩增的最佳循环数。
3.2.3次级ssDNA的制备由于PCR扩增所得产物为双链DNA,故扩增后需对PCR进行纯化、解链和分离。据文献报道[18],制备ssDNA的方法包括:生物素-链霉亲和素分离法、不对称PCR分离法、变性聚丙烯酰胺凝胶电泳分离法和核酸外切酶消化分离法,以上方法各有其优势和不足。本研究采用生物素-链霉亲和素分离法对纯化后的PCR产物进行解链、分离,其原理在于:实验中所用PCR上游引物带有FITC标记,下游引物带有生物素Biotin标记,碱性环境下,DNA双链解链,置于磁力架上后,Biotin标记的单链可被吸附于管壁,吸取上清即可获得FITC的单链DNA,用于次级筛选或流式细胞仪检测。
3.2.4筛选进程的监测本研究利用携带FITC标记的上游引物进行PCR扩增,经生物素-链霉亲和素分离法可获得FITC标记的ssDNA文库,FITC-ssDNA与靶细胞孵育后,可直接用于流式细胞仪和荧光显微镜监测筛选进程,评估FITC-ssDNA与靶细胞的结合率。
3.3核酸适配体的验证据文献报道,核酸适配体可形成茎环、假结、发夹、凸环、口袋等多种稳定的次级结构[19]。二级结构模拟对适配体结构分析、识别机制研究、肿瘤标志物发现具有重要意义。本研究根据流式细胞仪和荧光显微镜检测结果,选取与EJ细胞结合率最高的第15轮ssDNA文库,以及与T24、BIU87细胞结合率最高的第18轮ssDNA进行分子克隆测序,发现第15轮ssDNA文库中共有43段不同序列,其中适配体apt1富集度最高;第18轮ssDNA文库中共有31段不同序列,其中适配体apt2和apt3富集度最高;选取apt1、apt2和apt3作为目标适配体,用Dnaman软件模拟3种适配体的二级结构,结果显示apt1、apt2和apt3的二级结构均为茎环结构,是适配体与膀胱癌细胞系结合的基础,与文献报道相符[22]。
根据测序结果,人工体外合成FITC标记的适配体apt1、apt2和apt3,流式细胞仪检测证实: apt1可特异性识别EJ细胞,与阴性质控细胞无明显结合; apt2可特异性识别T24细胞,与阴性质控细胞无明显结合; apt3可特异性识别BIU87细胞,与阴性质控细胞无明显结合。
本研究以细胞学实验为基础,利用CELL-SELEX技术成功筛选到3种对人膀胱癌细胞系具有高特异性的适配体。研究结果可为建立一种简便、可靠、无创、敏感性和特异性高的膀胱癌早期诊断方法提供实验依据。FITC标记的适配体可直接经体外合成,合成后配合荧光显微镜、化学发光仪、流式细胞仪等检测仪器进行尿脱落细胞学检测,检测具有快速、无创、简便等诸多优点,具有较大的潜在临床应用价值。
