冷诱导RNA结合蛋白对浅低温治疗心跳骤停大鼠海马神经元及线粒体损伤的影响
2020-08-14周洁洁程慧娴周志强段满林
周洁洁,李 娟,张 洁,程慧娴,周志强,段满林
0 引 言
心跳骤停后的全脑缺血再灌注损伤是其致死率和致残率居高不下的主要原因,低温治疗是唯一公认有效的治疗方法,但其作用机制尚不明确[1]。冷诱导RNA结合蛋白(cold induced RNA-binding protein,CIRP)是一类富含甘氨酸的核蛋白,它在各种组织中微弱表达,并在温度降低时显著增强[2]。本课题组前期研究发现[3],心跳骤停脑损伤后神经元CIRP表达上调,浅低温治疗后CIRP表达进一步增加,且浅低温诱导的CIRP与线粒体凋亡相关蛋白具有高度的线性相关,提示CIRP在浅低温的抗凋亡作用中起着重要作用。线粒体是缺血再灌注损伤发生的重要环节,线粒体动力相关蛋白1(dynamin-related protein1,Drp1)介导的线粒体分裂与细胞凋亡的关系密切[4]。Wang等[5]研究显示,治疗性低温可以通过抑制Drp1表达,减少线粒体分裂改善心跳骤停复苏大鼠神经系统结局。本研究拟通过海马区注射腺相关病毒(adeno-associated virus,AAV)9型下调CIRP表达的方法,评估CIRP对浅低温治疗心跳骤停大鼠海马神经元和线粒体损伤效果的影响,并探讨其机制是否与线粒体分裂有关。
1 材料与方法
1.1 实验动物及材料清洁级健康雄性SD大鼠65只,体重180~220 g,6~8周龄,由上海西普尔-必凯实验动物有限公司提供,许可证号码:SCXK(沪)2018-0006,饲养于东部战区总医院比较医学中心。本实验通过我院动物实验伦理审核。饲养条件:温度23~25 ℃,湿度50~60 %,昼夜(12 h/12 h)交替,术前禁食12 h,自由饮水。AAV9病毒包装(上海吉凯基因化学技术有限公司),脑立体定位仪(深圳瑞沃德生命科技有限公司);BL-420F生物机能实验系统(成都泰盟科技有限公司),DW-3000B小动物人工呼吸机(北京众实迪创科技发展有限责任公司);CIRP抗体(美国Proteintech公司),Drp1抗体、Cyt-C抗体(英国Abcam公司),羊抗兔HR-IgG(美国Santa Cruz公司);荧光显微镜(日本尼康公司),透射电子显微镜(日本Hitachi公司)。
1.2方法
1.2.1 分组取5只大鼠用于海马区转染AAV9的检测,其余大鼠采用随机数字表法均分为5组:假手术组、模型组、浅低温组、浅低温+CIRP抑制组、浅低温+空载对照组,每组12只。
1.2.2AAV9海马区注射2% 戊巴比妥钠50 mg/kg腹腔注射麻醉,将大鼠固定在脑立体定位仪上,头部皮肤消毒,沿矢状缝作一3 cm长的切口,暴露前囟、人字缝及矢状缝。根据大鼠脑立体定位图谱提供的参数来定位双侧海马(前囟点向后 3 mm,旁开2 mm,自硬脑膜面向下3.5 mm),钻一小孔,垂直插入微量注射器进行病毒注射,病毒滴度为1.25×1012vg/mL,左右侧各注射1 μL,速度0.2 μL/min,完毕后留针10 min,使病毒充分浸润局部组织,按1 mm/min速度缓慢拔针,缝合头皮。浅低温+空载对照组用同样的方法注射等量空载体,其余组注射等量等渗盐水。
1.2.3荧光显微镜观察AAV9转染用于荧光显微镜观察的5只大鼠于海马区注射2 周后,2%戊巴比妥50 mg/kg腹腔麻醉,迅速取出脑组织后OCT包埋,冰冻切片机冠状位切片,片厚10 μm,DAPI染核后封固,荧光显微镜下观察海马区绿色荧光蛋白(green fluorescent protein,GFP)的表达,操作过程避光。
1.2.4模型制备和低温的实施海马区注射后2 周,参照文献[6]的方法采用经食道心脏起搏法诱发心跳骤停并行心肺复苏制备大鼠全脑缺血再灌注损伤模型。2%戊巴比妥50 mg/kg腹腔注射后经口气管插管,行左股动静脉穿刺置管术,监测血压、心电图和直肠温度。四极5F起搏电极经口插入食管电刺激诱发心跳骤停。心跳骤停的标准:正常的动脉搏动波消失伴有MAP<10 mmHg(1 mmHg=0.133 kPa),心电图示室颤、无脉电活动或心跳停止。心跳骤停4 min时开始机械通气和胸外心脏按压;复苏即刻静脉注射肾上腺素20 μg/kg,必要时重复给药。自主循环恢复标准:MAP > 50 mmHg并维持10 min,心电图示室上性节律。假手术组只行气管插管和股动静脉穿刺术,其余各组建立全脑缺血再灌注损伤模型。浅低温组、浅低温+CIRP抑制组、浅低温+空载对照组于自主循环恢复即刻行体表降温,15 min内将直肠温度降低至32~34 ℃,维持6 h,其余组维持直肠温度37.5~38.5 ℃。
1.2.5神经功能损伤(neurological deficit score,NDS)评分再灌注72 h,每组取6只大鼠,根据文献[7]使用NDS评分评估一般神经功能。NDS量表包括一般行为、脑干反射、运动和感觉评估、其他行为反射和癫痫发作。总分80表示大脑功能正常,而总分0表示脑死亡。
1.2.6HE染色再灌注72 h,腹腔注射2%戊巴比妥50 mg/kg麻醉,剪开右心耳,经左心室-升主动脉灌注4 ℃的等渗盐水200 mL。断头取出脑组织放入4%多聚甲醛中固定,石蜡包埋,常规制备海马组织切片,片厚4 μm,HE染色评价海马CA1区神经元损伤。光镜400倍视野下,连续选择3个视野,计数每个视野神经元存活数,取平均值。
1.2.7电镜标本的制作再灌注24 h时每组取6只大鼠,无痛处死后迅速冰上分离出两侧海马组织,取一侧海马组织放入液氮中保存,另一侧海马组织取CA1区约1 mm3组织,放入电镜固定液中4 ℃过夜,漂洗、后固定、脱水之后812包埋剂包埋,超薄切片机切片,片厚60 nm,2%醋酸铀饱和酒精溶液和枸橼酸铅双重染色。透射电子显微镜观察线粒体结构形态并拍照。
1.2.8Western blot法测定海马组织解冻、裂解、匀浆、离心后采用考马斯亮蓝法测定海马CIRP、Drp1和细胞色素 C (cytochrome C,Cyt-C)蛋白含量。行SDS-PAGE电泳,后转移至PVDF膜,5%脱脂奶粉封闭,加一抗CIRP抗体(1∶500)、Drp1抗体(1∶2000)和Cyt-C抗体(1∶1000),4 ℃孵育过夜。加二抗羊抗兔HR-IgG(1∶3000),室温下摇荡孵育30 min。漂洗后ECL发光、显影、定影扫描,采用Image-J图像分析软件分析条带灰度值,以目的蛋白条带灰度值与内参β-actin条带灰度值的比值反映目的蛋白表达水平。
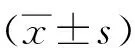
2 结 果
2.1一般资料本实验共使用大鼠85只,5只用于观察AAV9转染,10只因复苏失败死亡,复苏成功率88%,11只在标本采集之前死亡,其中模型组4只,浅低温组2只,浅低温+CIRP抑制组3只,浅低温+空载对照组2只,最终共60只进入结果分析。5组大鼠心跳骤停前体重、体温、心率、收缩压和舒张压等基本生命体征差异无统计学意义(P>0.05)。见表1。
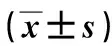
表 1 心跳骤停前各组大鼠的一般资料比较
2.2注射AAV9 2周后海马GFP表达荧光显微镜下海马CA1区绿色荧光较强,被AAV9 感染大量GFP 蛋白表达。说明脑立体定位仪定位海马区准确,注射2 周后AAV9 可以稳定、广泛表达于海马区,见图1。

图 1 镜下观察注射AAV9 2周后海马CA1区GFP表达( ×200)
2.3再灌注72 h大鼠NDS评分NDS评分显示,假手术组神经功能正常,其余四组较假手术组评分均降低(P<0.05);与模型组相比,浅低温组、浅低温+CIRP抑制组、浅低温+空载对照组均升高(P<0.05)。神经功能损伤减轻;浅低温+CIRP抑制组、浅低温+空载对照组、模型组组间差异无统计学意义(P>0.05)。见表2。
2.4再灌注72 h海马CA1区锥体细胞损伤光镜下,假手术组海马CA1区锥体细胞形态正常呈圆形,排列紧密,细胞质均匀,细胞核大而圆,可见核仁;模型组细胞排列紊乱稀疏,空泡出现,核固缩或碎裂,大量锥体细胞死亡;浅低温组和浅低温+空载对照组组排列紊乱程度减轻,核固缩、核碎裂及死亡细胞数减少;浅低温+CIRP抑制组与模型组表现相似,较浅低温组损伤加重,见图2。模型组、浅低温组、浅低温+空载对照组存活锥体细胞计数较假手术组比较明显减少(P<0.05),浅低温+CIRP抑制组存活细胞计数较浅低温组、浅低温+空载对照组少(P<0.05)。见表2。

表 2 再灌注72 h各组大鼠 NDS评分和海马CA1区锥体细胞计数
2.5再灌注24 h CA1区锥体细胞线粒体超微结构改变假手术组中线粒体呈短棒状或杆状,双层膜、嵴结构正常、清晰;其余组出现不同程度的过度分裂的点状线粒体,线粒体肿胀,双层膜、嵴结构模糊或者消失,基质中有空泡形成、包含物沉积;模型组、浅低温+CIRP抑制组线粒体结构改变较为严重,而浅低温组、浅低温+空载对照组相对较轻。见图3。
2.6再灌注24 h海马CIRP、Drp1和Cyt-C蛋白表达与假手术组相比,浅低温+CIRP抑制组CIRP蛋白含量显著降低(P<0.05);模型组、浅低温组和浅低温+空载对照组明显高于模型组(P<0.05),浅低温组与浅低温+空载对照组差异无统计学意义(P>0.05)。假手术组Drp1蛋白、Cyt-C蛋白含量较其余4组均明显增高(P<0.05),浅低温组、浅低温+空载对照组较模型组降低(P<0.05),浅低温+CIRP抑制组较浅低温组和浅低温+空载对照组明显升高(P<0.05),而模型组和浅低温+CIRP抑制组、浅低温组和浅低温+空载对照组之间差异无统计学意义(P>0.05)。见图4,表3。

a:假手术组; b:模型组;c:浅低温组;d:浅低温+CIRP抑制组;e:浅低温+空载对照组

a:假手术组; b:模型组;c:浅低温组;d:浅低温+CIRP抑制组;e:浅低温+空载对照组

1:假手术组;2:模型组;3:浅低温组;4:浅低温+CIRP抑制组;5:浅低温+空载对照组
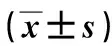
表 3 再灌注24 h后各组大鼠海马CIRP、Drp1、Cyt-C蛋白含量比较
3 讨 论
本研究评估了CIRP对浅低温治疗心跳骤停之后全脑缺血再灌注损伤的作用。 结果显示,下调CIRP后浅低温对心跳骤停大鼠脑复苏作用减弱,海马神经元存活明显减少及线粒体损伤增加。Drp1的表达增加,线粒体碎片化增加,表明CIRP对治疗性低温效果的影响可能与线粒体分裂有关。
心跳骤停会导致海马锥体细胞死亡,海马CA1区最易受缺血和缺氧影响[8]。因此,选择海马CA1区作为主要观察区域。AAV9宿主范围广,感染效率高,具有极低的免疫原性和毒性,介导外源基因长期有效表达[9-10],并且AAV9可以透过血脑屏障感染神经元和胶质细胞,局部注射相对整体注射对机体的生长和长期生存率影响更小[11]。本实验中病毒滴度达1.25×1012病毒颗粒/毫升(vg/mL),注射AAV9病毒转染2 周后,荧光显微镜下观察到海马区大量GFP表达,Western blot检测CIRP含量显著降低,注射病毒空载体不影响CIRP的表达,并且注射操作和AAV9对大鼠的基本生命体征等没有明显的影响,因此,海马区注射AAV9抑制CIRP表达的方法可行。
浅低温(32~34 ℃)可有效减轻脑缺血再灌注损伤,但其机制尚不明确[1, 12]。CIRP是第一个在哺乳动物细胞中发现的冷休克蛋白,对细胞生长和凋亡具有调节作用[13]。在低温下可发现大量CIRP mRNA,但在常温下几乎无法检测到,这表明CIRP mRNA受温度调节[14]。当体温过低或人工过表达CIRP时,过氧化氢诱导的神经元凋亡被显著抑制,这暗示了其潜在的神经保护作用[15-16]。本研究结果显示心跳骤停复苏后海马神经元中CIRP的表达上调,给予浅低温治疗后该蛋白表达进一步增加,改善了神经元存活和神经功能损伤评分,与本课题组前期研究结果一致[3],提示CIRP可能在浅低温减轻全脑缺血再灌注损伤中具有关键作用。而下调海马CIRP表达之后再采用浅低温治疗,与浅低温组相比,海马CA1区神经元病理改变加重,锥体细胞存活显著减少,甚至接近于未使用浅低温治疗的模型组,低温的促神经元存活作用减弱,提示CIRP是浅低温发挥治疗作用的一个关键靶点。
线粒体是脑缺血再灌注损伤的中心环节[17- 18]。线粒体通过融合和裂变维持自身稳态,Drp1是哺乳动物中介导线粒体分裂的主要蛋白,全脑缺血再灌注损伤后线粒体内稳态遭到破坏,Drp1从胞浆募集到线粒体外膜,引起线粒体过度分裂,线粒体膜通透性增加,线粒体肿胀,Cyt-C从膜间隙释放至胞浆,引起细胞凋亡[19- 20]。Wang等[5]研究显示,低温治疗可以通过抑制Drp1表达和线粒体分裂改善心跳骤停复苏大鼠神经系统结局。本实验发现浅低温能够降低全脑缺血再灌注损伤诱导的Drp1和促凋亡蛋白Cyt-C表达,保存线粒体结构,减少线粒体分裂,而下调CIRP表达之后使用浅低温,与浅低温组相比Drp1表达、Cyt-C释放增多,蛋白表达量接近于模型组,电镜观察发现线粒体结构损伤严重,线粒体碎片化增多,表明浅低温减少线粒体分裂、保持线粒体结构完整的效果与CIRP的表达密切相关,揭示了全脑缺血再灌注损伤之后浅低温维持线粒体功能的新的内源性机制。但是心跳骤停后脑损伤的病理生理机制复杂,无法仅通过单一的线粒体分裂机制来解释,且CIRP与线粒体分裂之间作用的信号通路与信使分子也有待进一步研究。
然而AAV9转染下调海马CIRP表达之后使用浅低温治疗,大鼠的NDS评分相比浅低温组差异无统计学意义。其可能原因如下:首先,NDS评分反映全脑神经功能,仅抑制海马区CIRP的表达,难以影响整个大鼠的神经系统结局;其二,AAV9转染仅下调CIRP表达,虽然抑制程度较高,但无法完全消除CIRP的影响,可以进一步采用基因敲除技术或外源性CIRP制剂验证CIRP的功能;其三,除调控CIRP表达之外,治疗性低温的效果还可能受其他因素影响。
综上所述,在本实验条件下,下调海马CIRP表达削弱了浅低温对心跳骤停大鼠神经元的保护作用。CIRP是浅低温治疗有效的关键靶点,其可能机制与线粒体分裂有关。
