一种商用固定化诺维信脂肪酶435的活性表征
2020-08-13田志美宋崇富卢若雨王标薄连震刘锐锐蒋雪月金晓艳
田志美,宋崇富*,卢若雨,王标,薄连震,刘锐锐,蒋雪月,金晓艳
(1.阜阳师范大学 化学与材料工程学院,安徽 阜阳 236037;2.安徽恒宇环保设备制造股份有限公司,安徽 阜阳 236626)
脂肪酶(Lipase),又叫甘油脂水解酶,它是属于羧基酯水解酶类的一种有机相酶,可以作用于甘油三酯的酯键,将甘油三酯水解成甘油和脂肪酸[1-3]。脂肪酶可以用来催化一些有机化学反应。脂肪酶的运用非常广泛,主要在食品加工、油脂改性、皮革与造纸工艺和有机合成等方面[4-13]。酶的固定化技术可以有效解决它们在反应中导致的一系列问题,而且通过这种技术可以有效提高脂肪酶的活性[14-16]。脂肪酶性质的研究主要是利用分光光度法[17]探究最适温度及温度耐受检测、最适pH、底物特异性、反复操作后的稳定性等方面。来自Candida antarctica的固定化诺维信脂肪酶435(简称为N435)是一种有吸引力的生物催化剂,用于从许多类型的含油种子植物生产生物柴油[18]。N435是一种白色或微黄色的颗粒,由经过基因改性的米曲霉(Aspergillus oryzae)微生物进行深层发酵并吸附于大孔丙烯酸树脂而制成。
为了更好的以N435作为催化剂催化餐厨废油制备生物柴油,本论文拟利用分光光度法[19-20]以对硝基苯酚月桂酸酯(p-nitropHenyl laurate,简称为C12)为底物溶液对一种商用的固定化脂肪酶(N435)进行活性表征。其中主要关注最适温度及pH、各种试剂对酶活的影响,操作稳定性等,以期为生物柴油的制备条件的控制提供可行的参数。
1 实验部分
1.1 仪器、材料的准备和试剂的配制
1.1.1 仪器
722G型分光光度计,pHS-3C计(上海仪电科学仪器股份有限公司);FA1004型分析天平(上海精密科学仪器有限公司);三孔三温水浴锅(金坛杰瑞尔电器有限公司);药匙;烧杯;玻璃棒;容量瓶;移液管;移液枪;量筒;石英微量比色皿;计时器;洗耳球;滤纸。
1.1.2 药品及试剂
N435(独伊生物科技上海有限公司);C12(天津希恩思生化科技有限公司);三羟甲基氨基甲烷(Tris)-HCl缓冲液;柠檬酸;柠檬酸钠;二水磷酸二氢钠碳酸钠;十二水磷酸氢二钠;十二烷基硫酸钠(SDS);苯甲基磺酰氟(PMSF);二硫苏糖醇(DTT);乙 二 胺 四 乙 酸(EDTA);吐 温 20(Tween20);曲拉通-100(Triton X-100);碳酸氢钠;碳酸钠;氯化钡;氯化钾;氯化镁:氯化锌;无水硫酸铜;氯化钠;氯化钙;六水合氯化铁;无水乙醇(西拢化工股份有限公司,分析纯)。
1.1.3 试剂的配制
(1)C12溶液(25 mmol·L-1):将 0.080 4 g C12晶体溶于10.00 mL无水乙醇中,避光保存。
(2)分别含 Zn2+,Na+,K+,Ca2+,Mg2+,Cu2+,Fe3+,Ba2+溶液(1.0 mol·L-1):分别准确称取 6.815 0 g 氯化锌,2.922 0 g氯化钠,3.727 5 g氯化钾,5.549 5 g无水氯化钙,10.165 0 g氯化镁,7.980 0 g无水硫酸铜,13.514 5 g六水合氯化铁,12.213 0 g氯化钡,用蒸馏水溶解,转移,然后定容至50.00 mL。
(3)混合磷酸盐标准缓冲溶液(pH=6.86)和邻苯二甲酸氢钾标准缓冲溶液(pH=4.00):分别将标准缓冲溶液试剂包加水稀释按照说明书配置。
1.2 实验仪器预处理
酸度计:用二次蒸馏水洗净两个50 mL的小烧杯放入烘箱中烘干,待烧杯彻底冷却以后,分别加入适量的pH=6.86的标准缓冲溶液和pH=4.00的标准缓冲溶液。用二次水反复清洗复合电极,将电极甩干,然后放进pH=6.86的标准溶液中,用温度计测量当前标液温度为20.0℃,在酸度计上设置此温度并保持不变,待pH读数稳定后定位校正至pH读数为6.86;再次用二次蒸馏水洗净复合电极甩干,放入pH=4.00的标液中,待稳定后定位校正pH为4.00。校正完成后洗净放置待用。
722G型分光光度计:使用时需要提前30 min打开预热,调整好波长,每次测量前要对黑体调T=0,参比溶液调T=100%(A=0)。
1.3 实验步骤及方法
1.3.1 N435的酶活测定
称取0.010 0 g N435于1.5 mL的离心管中,然后吸取 50 mmol·L-1的 Tris-HCl冲液(pH 8.0,65℃)900 μL 和 25 mmol·L-1的 C12溶液 100 μL,加到装有脂肪酶的离心管中,混匀后65℃水浴20 min,水域结束置于碎冰里1 min,然后将离心管放在离心机中用1 000 r/min的转速离心1 min,取上层清液在722G型可见分光光度计406 nm波长下测定其吸光值(A),以不加酶液的底物溶液做作为对照。一单位酶活定义为每分钟释放1 μmol·L-1对硝基苯酚所需要的脂肪酶的量[19]。
1.3.2 N435作用的最适温度及温度耐受检测
1)最适温度:改变温度(30℃,40℃,50℃,60℃,70℃,80℃,90℃),参照 1.3.1的方法,分别测定其酶活并及时记录数据。
2)温度耐受检测:称取若干份0.010 0 g N435加入1.5 mL的离心管中,再向其中分别加入50 μL的无水乙醇。将它们分别置于不同温度下(30℃,40℃,45℃,50℃,55℃,60℃,70℃,80℃,90℃)在三孔水浴锅中温热30 min,然后按照1.3.1测定残余酶活,对照组设置为不预先温浴的酶液。
1.3.3 N435作用的最适pH
配制不同 pH 的缓冲液(如 4,5,6,7,8,9,10,11),按照1.3.1依次加入不同的缓冲液和酶液,振荡3 s左右,分别置于三孔水浴锅中加热30 min,然后参照1.3.1的方法测定酶活。
1.3.4 金属离子对N435的影响
分别用移液枪加入浓度1 mol·L-1的金属离子溶液(K+,Ba2+,Cu2+,Mg2+,Ca2+,Zn2+,Na+及 Fe3+)1.0 μL,在 50 mmol·L-1的 Tris-HCl缓冲液(pH 8.0)中,对照组则用不加金属离子的溶液。参照1.3.1的方法(温度设置为50oC)测定酶活并准确记录数据。
1.3.5 抑制剂对N435的影响
配制 1 mol·L-1吐温-20,曲拉通-100,SDS,PMSF,DTT,EDTA,然后 25 mmol·L-1的 C12底物溶液中用移液枪分别加入各干扰试剂1.0 μL以及pH=8的缓冲液900 μL,加好以后将1.5 mL的离心管振动3 s左右。参照1.3.1的方法(温度设置为50oC)测定N435的酶活,及时并准确地记录数据。
1.3.6 操作稳定性的测定
将 0.010 0 g N435,900 μL 缓冲液,100 μL 25 mmol·L-1的C12溶液加入1.5 mL的离心管中,振荡3 s左右,在50oC水浴中温热30 min。参照1.3.1测定其吸光度并记录数据。每次测完酶活后,磁分离该酶,然后用1 mL Tris-HCl(pH=8.0)洗涤一次,再次按照测定酶活的方法测定吸光度,重复操作9次之后,准确记录10次的数据,然后作图判断N435的稳定性。
2 结果与讨论
2.1 N435测活工作曲线
由于脂肪酶酶活的测定是通过测量脂肪酶催化对硝基苯酚酯酯解释放的对硝基苯酚来定量的,因此要做对硝基苯酚浓度与406 nm波长处对应吸光度值的工作曲线。吸取不同浓度的对硝基苯酚标准溶液至比色皿中,在分光光度计上依次测定各个浓度溶液的吸光度。以横坐标为浓度,纵坐标为吸光度作出对硝基苯酚溶液的标准曲线,标准曲线方程见式(1),R2为 0.999 2。
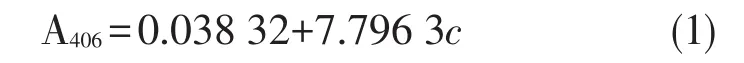
其中:A406表示在406 nm波长下测定的吸光度;c为对硝基苯酚的浓度。
2.2 N435作用的最适温度的确定
由图1(a)所示,在pH=8.0的缓冲液中,N435作用的最适温度约为40~60℃之间。但是该酶在60℃以后吸光度下降较快。以N435的50℃酶活为100%,从图1(b)中可以清晰地看出80℃,90℃时该酶失活约60%和80%。由此可以看出N435作用的最适温度为中低温阶段,高温下失活比较严重。经过实验得出:N435作用的最适温度为 40~60℃。
2.3 N435的温度耐受检测
由图2所示,在pH=8.0的缓冲液中,N435在经过不同温度温浴30 min后,只有在40~50℃温浴30 min后测定酶活时仍旧保持较高的活性。以50℃时的酶活为100%,那么酶在70℃水浴中加热30 min以后再次测定酶活时失活约65%,同样在水浴温度为80℃时失活达到约85%。由此可以看出N435的耐受温度大概在40~50℃,高温下水浴后失活非常严重。经过实验得出:在不同温度,pH缓冲液为8.0的条件下,N435的耐受温度为50℃。
2.4 N435最适pH的测定
由图3可以看出,50℃下,当缓冲液的pH为6.00时,所测吸光度值只有0.052。在pH逐渐增至9.00的过程中,吸光度有一定程度的上升,但是pH>9.00时吸光度开始逐渐下降。以pH为9.00时酶活为100%,那么在pH为6.00时酶失活约98%,在pH为7.00时酶失活约在70%,但是pH为11.00时活性仍维持在70%左右。由此可见N435属于碱性酶,它在酸性环境下酶的抗压能力下降,酶失活率上升。经过实验得出:N435的最适 pH 为 8.00~11.00。
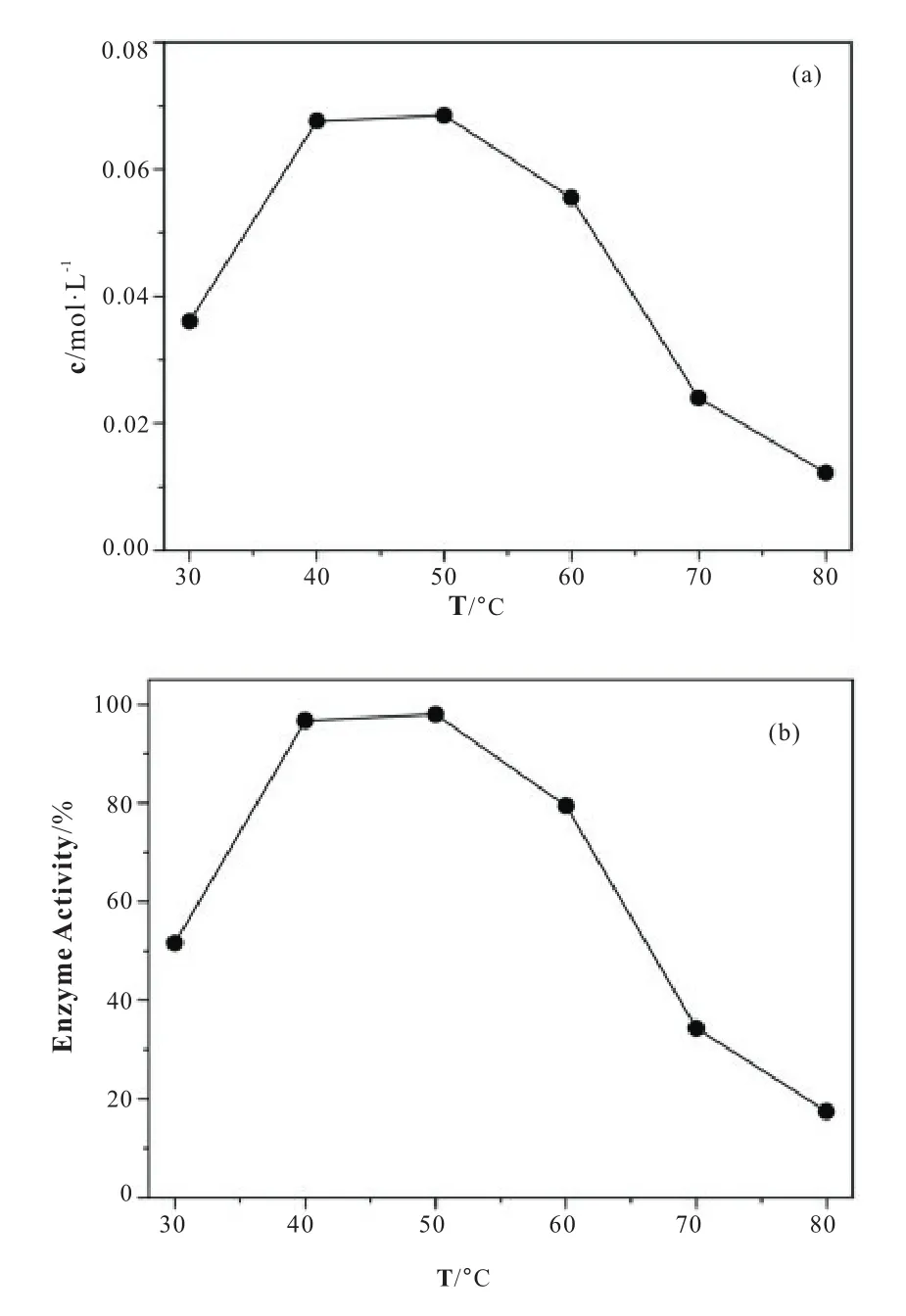
图2 N435的酶活耐受情况(a)浓度;(b)相对酶活性

图3 N435酶活受pH的影响(a)浓度;(b)相对酶活性
2.5 金属离子对N435酶活的影响
分别加入 1 mol·L-1的 Cu2+,Fe3+,Mg2+,Ba2+,Ca2+,Zn2+,Na+及 K+金属离子溶液 1.0 μL 至底物溶液中后,参照1.3.1的方法测出的酶活如图4。从图中可以看出K+、Ba2+可以在一定程度上提高N435 的酶活,而 Zn2+、Cu2+、Ca2+对该酶的酶活则具有一些抑制的作用。结果显示:以对照组的酶活为 100%,Zn2+、Cu2+、Ca2+降低的酶活约 40%和 16%和14%,而K+、Ba2+则使酶活上升了约为2.0%、3.0%。
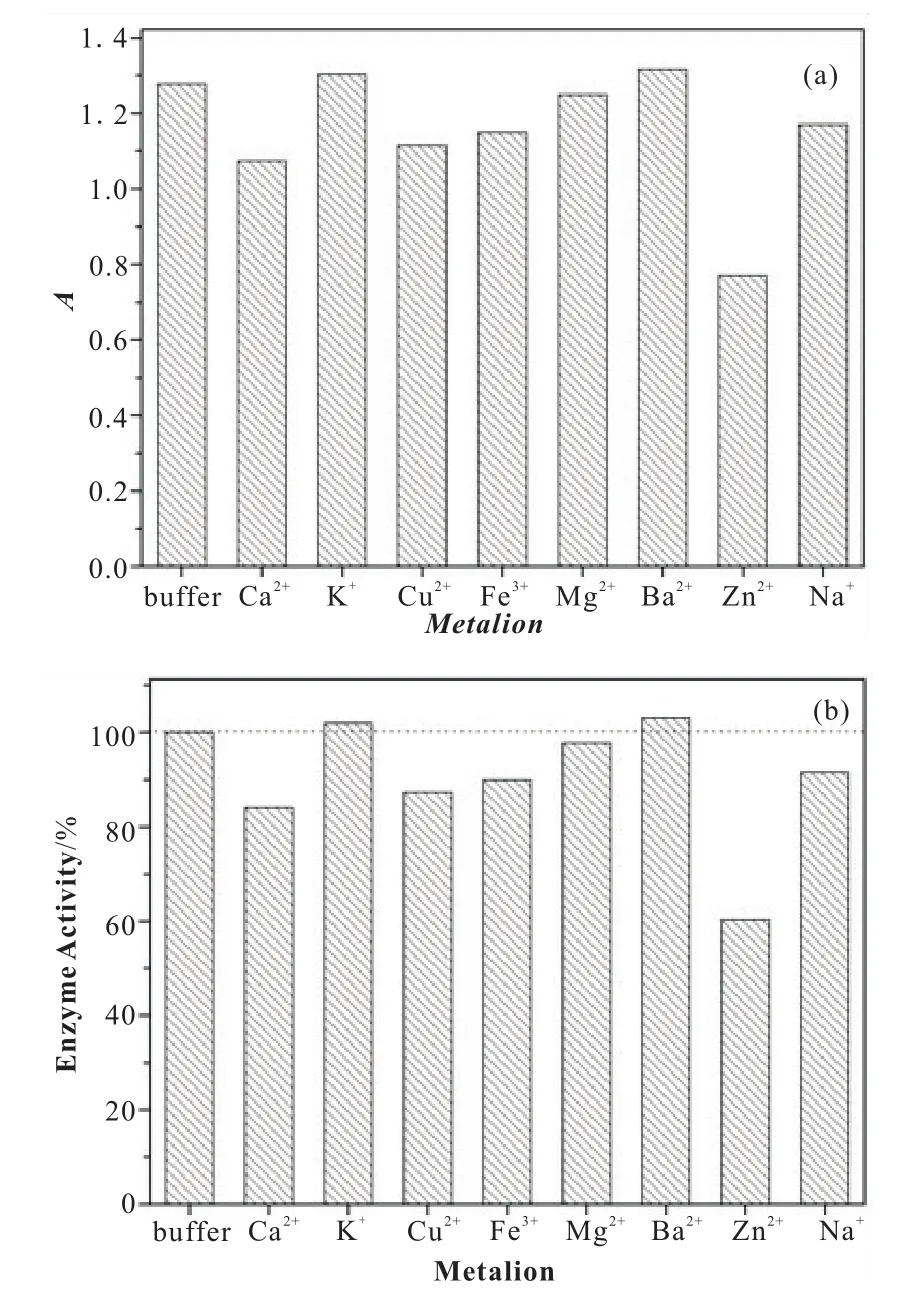
图4 金属离子对N435酶活的影响(a)吸光度;(b)相对酶活
2.6 抑制剂对N435的影响
如图5所示,在1.5 mL含有底物溶液的离心管中加入抑制试剂:曲拉通X-100、吐温-20、SDS、EDTA、DTT、PMSF 各 1.0 μL。其中曲拉通 X-100对酶活的抑制最大,而吐温-20,EDTA,PMSF对酶活有一定的促进作用,其余的抑制剂则没有明显的效果。以不加抑制剂溶液的酶活性为100%,从图6(b)可以明显的看出,Triton X-100具有显著的抑制效果,降低约40%,Tween-20对N435具有明显促进作用,增加约51%,剩余试剂对N435均有不同的促进效果。

图5 抑制剂对N435酶活的影响(a)吸光度;(b)相对酶活
2.7 N435的操作稳定性
固定化脂肪酶在工业运用中一个关键参数就是酶的操作稳定性。所以在50℃、pH缓冲液8.0的环境下,按照酶活测定的方法重复使用测定10次。我们以首次使用测定的的酶活为100%,由图6可以看出每次操作后酶活的略有下降,在反复操作10次以后,酶的活性仍然可以保持在80%左右,由此可以得出N435的操作稳定性较好;酶在反复操作后失活的原因可能是由于脂肪酶颗粒过小,我们在反复清洗N435时导致其少量损失,所以酶活有所下降,也有可能是N435的自身性质由于反复使用产生了变化,所以导致酶有一定程度的失活[19]。
3 小结
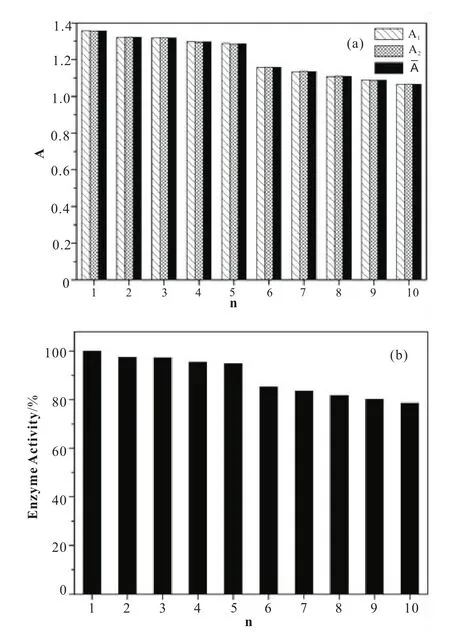
图6 N435的操作稳定性(a)吸光度;(b)相对酶活
本文利用分光光度法以对硝基月桂酸酯为底物溶液对N435进行活性表征。结果表明:温度在40~60℃和 pH 缓冲液为 8.00~11.00时,是 N435作用的最适条件。另外,在加入不同离子、不同抑制剂以后,在 50 ℃、pH 9.0 下,Ba2+、K+,Tween-20,EDTA和PMSF溶液都可以适当提高酶的活性,而去污剂 Triton X-100 以及 Cu2+、Ca2+、Zn2+则会使酶活性有不同程度的降低;重复使用10次以后,剩余酶活为第一次酶活的80%左右,这说明N435的重复操作性良好。该研究可以为该酶的在生物柴油制备等应用提供一定的数据参考。
