浅谈医疗器械行业100级洁净区的空调净化系统设计与实施
2020-08-13广州燃石医学检验所有限公司广东广州510000
广州燃石医学检验所有限公司 (广东 广州 510000)
内容提要:医疗器械生产车间洁净区主要包含100、10000、100000、300000四个洁净级别,其中100级洁净区更是生产车间工艺流程的核心,是无菌产品生产质量控制系统的重要组成,它对无菌产品能否实现安全有效具有至关重要的影响。随着各种新技术和新形式的出现,净化空调行业也取得了长足发展。通过采用新式的布局设计,可确保100级洁净区符合其实际生产所需。文章根据制药企业洁净厂房的生产特点,重点介绍目前实现100级洁净区的各种形式及其优缺点。
在GMP中,对无菌产品生产所需100级洁净区进行了细致严谨的描述——高风险的操作区,如:灌装区、配制区及无菌装配或连接操作的区域。因此,该区域作为无菌产品生产线的核心区域,直接影响产品质量,关乎患者的安全。
1.100级洁净区的要求及应用
1.1 洁净度要求
100级洁净区清洁度要求见表1。
1.2 100级洁净区的应用
100000级背景下的局部100级洁净区(最终灭菌的无菌产品生产)应用于容易长菌、灌装速度慢、灌装用容器为广口瓶、容器需暴露数秒后方可密封的产品灌装(或灌封)。
10000级背景下的100级洁净区(非最终灭菌的无菌产品生产):①处于未完全密封状态下产品的操作和转运。②灌装前无法除菌过滤的产品配制。③直接接触无菌产品的包装材料、器具灭菌后的装配以及处于未完全密封状态下的转运和存放。④无菌粉末的粉碎、过筛、混合、分装。

表1.100级洁净区清洁度要求
2.主流实现形式及其隐患
对于大部分医疗器械企业而言,采用FFU+洁净层流罩的系统方式来实现100级区是当前比较通行的一种方法,这是一种在电子洁净厂房内通常用来实现百级层流的方式,被大多数设计院和工程公司直接拿来当做解决方案用在医疗器械企业的100级区内。实际上电子厂内的100级和医疗器械行业内的100级洁净区是两种不同的概念,其实现的方式和设计的功能有很大的差别,需要达到的目的也很不相同。
随着使用时间的推移,用FFU系统的方式来实现100级区被发现有很多局限性,主要问题有以下5个:①由于FFU本身结构原因导致高效过滤器使用寿命比较短,而且安装和更换过滤器非常麻烦,有时甚至难以更换。②如果要对100级区进行验证,完整性验证和气流流型验证比较难以通过,同时送风风速也难以达到0.36~0.54m/s(离开高效过滤器出风面300mm处)的指导值。③FFU运行过程中,其电机发热量很大,容易造成100级区域室温超标。④若采用FFU数量较多,十几台甚至更多,则100级洁净区内的噪声难以达到规范的要求,总体造价也较高。⑤比较难以应用在需要防爆的区域。
3.解决方案
为了克服以上采用FFU系统设计的缺点,一般国外企业及国内的外资企业均采用液槽龙骨+刀口过滤器的形式,这能较好地解决以上问题。所谓的液槽龙骨即是将密封果冻胶现场灌装在龙骨上,龙骨可以是铝合金材料也可以是不锈钢焊接制作,高效过滤器上带刀口。安装时直接在100级区内将高效过滤器的刀口插在液槽龙骨内的密封果冻胶中,利用果冻胶的良好弹性来对接口进行密封,而且不需要固定螺丝。在系统设计中,根据每个生产厂厂房设置和功能的不同,按循环风机安装位置的不同,主要采用以下3种方案(见图1~3):方案1,循环风机组安装在回风夹层中。方案2,循环风机组安装在回风通道中。方案3,循环风机安装在设备层上。
从国内已经采用的厂家来看,这种液槽龙骨+刀口过滤器来实现100级区的方式可以达成以下目标:①比较容易通过美国FDA和欧盟标准的验证(主要参考标准为EN l 822—5:2000和IEST—RP—CC034.2:2005),包括PAO完整性验证、风速均匀性验证和气流流型验证,风速也很容易达到0.36~0.54m/s(离开高效过滤器出风面300mm处)的指导值标准。②高效过滤器的使用寿命大大延长,同时如果要更换高效过滤器也比较方便,在100级洁净区操作面即可完成。③总体投资比FFU系统方式低。④提供了解决100级区内噪音问题的一种方案。⑤如果该区域需要防爆,采用方案3即可较方便地实现。
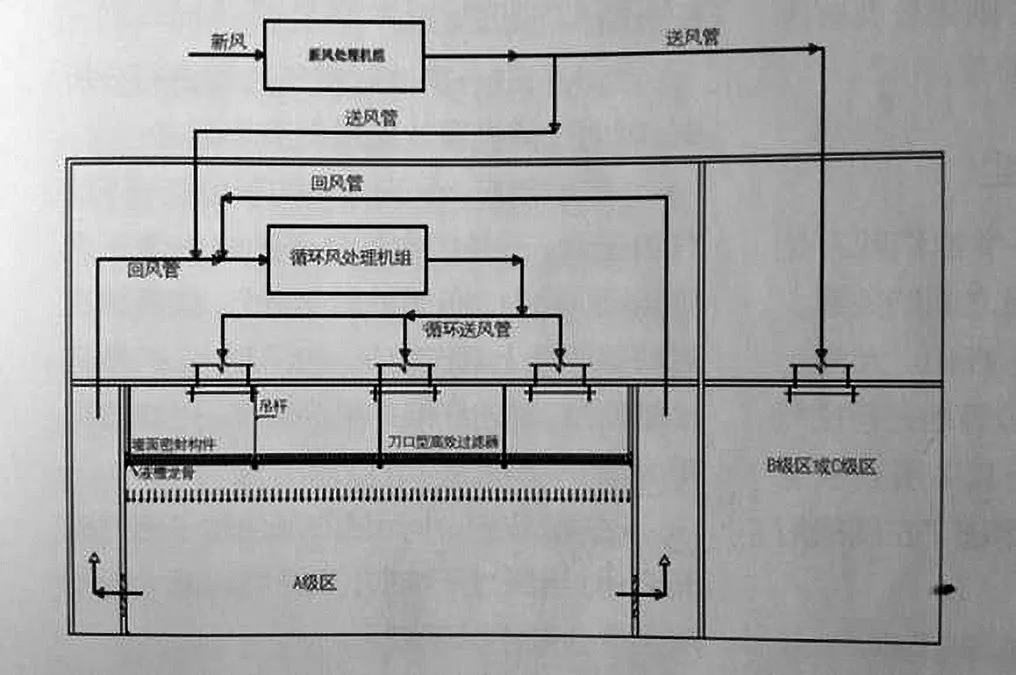
图1.循环风机组安装在回风夹层中
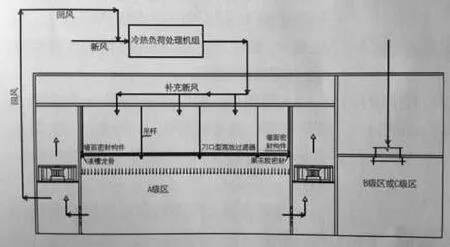
图2.循环风机组安装在回风通道中
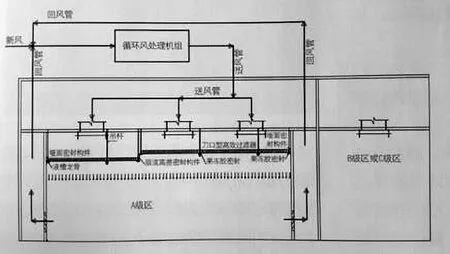
图3.循环风机安装在设备层上
4.小结
伴随着医疗器械行业的高速发展,各项技术推广应用也得以快速发展。在空调净化系统方面,由于引入了液槽龙骨+刀口过滤器密封的概念,对于实现单个送风风机+高效过滤器单元(即FFU)的液槽密封提供了解决方案,并且也完全可以满足现场验证和100级洁净区内更换高效过滤器的要求。凡此种种的进步,均为保证无菌产品安全提供强有力的支撑,进一步保证了无菌产品质量的安全、有效以及患者的利益。
