化学学科核心素养下的认知模型构建及其应用
2020-08-13侯帅帅姚成立
侯帅帅,姚成立
(合肥师范学院化学与化学工程学院,安徽合肥230601)
化学学科核心素养包括宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、科学探究与创新意识和科学态度与社会责任五个方面[1]。其中模型认知要求学生通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。人们在认识宏观世界或探究微观粒子的过程中,对问题模型化的思想,一直都在有意识或无意识地应用[2]。目前中学生的化学学习面临着繁重的任务以及各种升学考试的压力,显得很吃力,为此可以根据模型认知的特点让化学知识点模型化、解题题型化和知识点门类化,教师可在有限且较短的时间内教授大量的化学知识;学生可以对知识进行灵活的构建,做到举一隅不以三隅反,可以极大提高教师的信心和学生的学习热情。
1 模型认知与模型构建
1.1 气体溶于水可逆反应模型
当一些易溶于水的气体溶解在水里,气体分子会深入到水分子内部,条件合适的情况下,部分分子就会发生化学反应,生成新的化学物质。但是往往新生成的化合物极不稳定,在受热或压强增大的情况下,又会分解成相应的气体和水,也就是说它们的反应是不充分、不稳定的,可正向也可逆向反应,这就是典型的可逆反应。比如氨气极易溶于水,其中一部分氨气分子会与水分子作用生成NH3·H2O,而NH3·H2O又会分解成氨气和水,故用符号表征来表示这个化学反应过程:NH3+H2ONH3·H2O,同理氯气与水作用可以用符号表征为:Cl2+H2OHCl+HClO。生活中经常喝的碳酸饮料里含有大量的碳酸,如果用力振荡打开瓶盖时,便会产生许多气泡,该气体即为二氧化碳,其中碳酸是由二氧化碳溶于水制成的,该过程可用符号描述为:CO2+H2OH2CO3,那么套用这个写法模型,我们不难得出二氧化硫与水的反应方程式:SO2+H2OH2SO3。此即为一些关于气体与水可逆反应的模型,我们根据这些模型便可以举一反三得出一些未知气体和水作用的基本性质。学生们可以通过对比记忆记住这些相似的化学反应方程式,化复杂为简单,让学习更高效、更有趣。
1.2 工艺流程图模型
分析历年高考化学工艺流程题,包括各省市自主命题的模拟试卷的题目,基本都有一个化工生产流程图,其一般模型可用图1来表示。
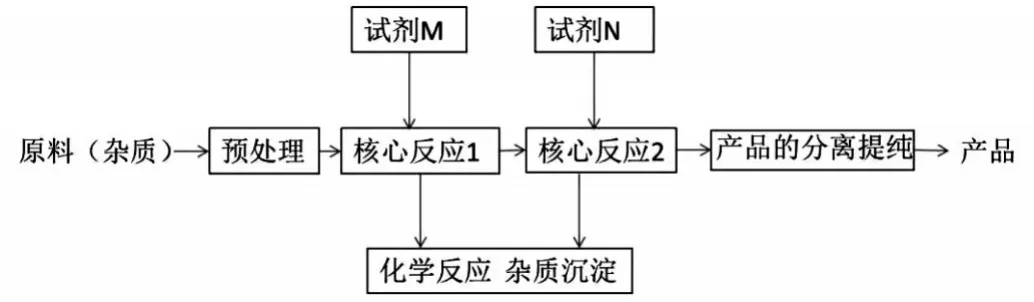
图1 工艺流程图题目模型
在解题的时候我们同样可以建模,如图2[3]。
几乎考试试题答案里均会涉及到这些化学解题术语,在此解题模型中,不难得出此答案。在原材料预处理中,将块状固体粉碎成小颗粒或研磨成粉末状,酸浸能让可溶性物质溶解,实现物质的转化分离。而在产品的分离提纯中,蒸发浓缩、冷却结晶、萃取分液则是经常需要的操作。
【典型案例】目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
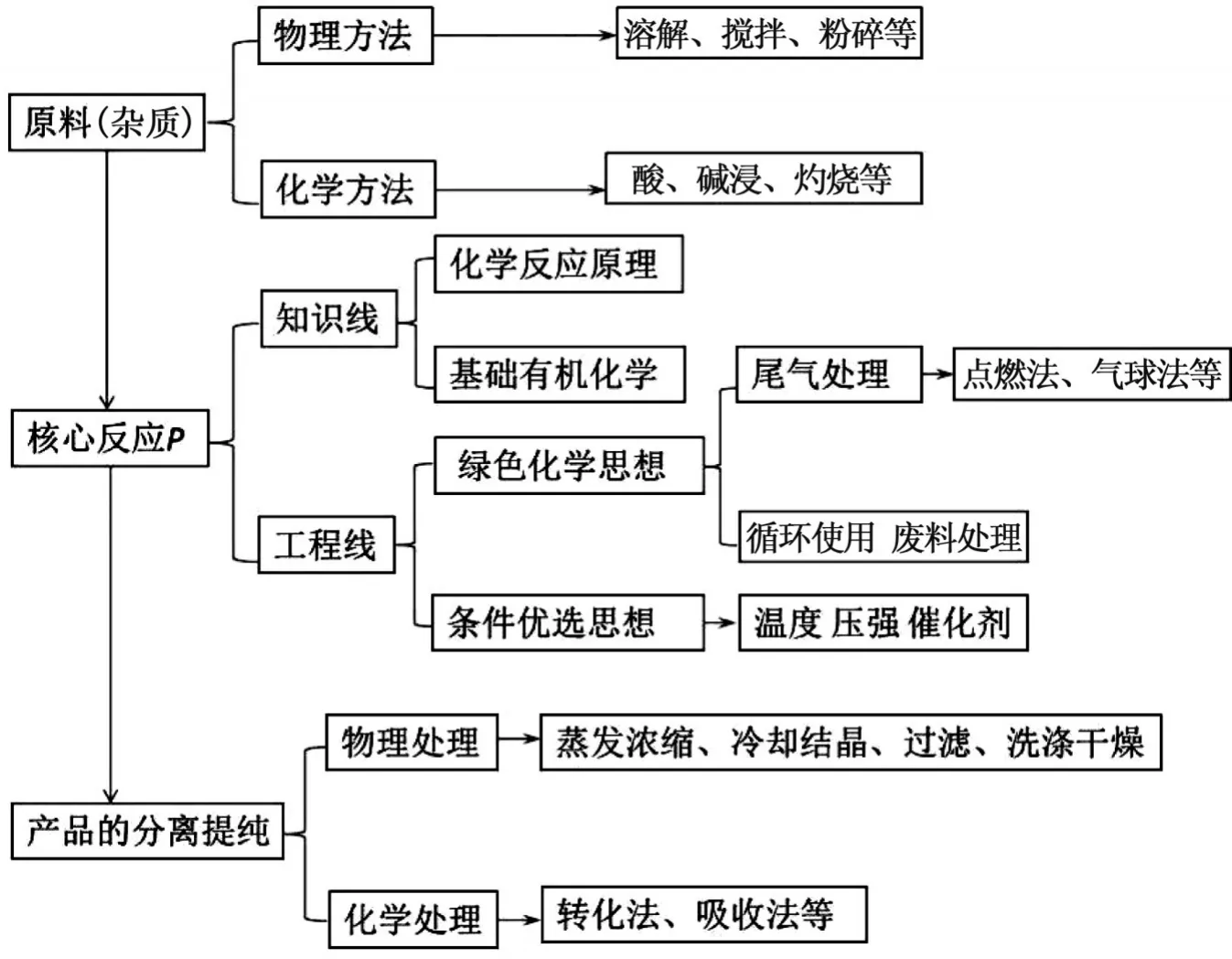
图2 解工艺流程图题的一般模型
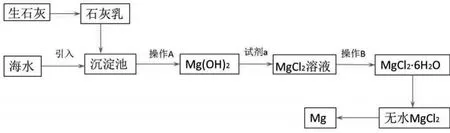
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 __________,写出在沉淀池的离子方程式__________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的__________。
(3)操作A是__________操作B是__________。
(4)加入的足量试剂a是 __________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_________。从考虑成本和废物循环利用的角度,副产物氯气可以用于_______。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?__________。
此题根据题型解法可以按如下思路解决:
核心步骤:首先海水中含镁离子,但浓度较低,所以首先向海水中加沉淀剂使Mg2+形成Mg(OH)2沉淀从而富集镁元素;其次把反应后生成的目标产物氢氧化镁和残余的杂质溶液分离开,普遍采用过滤的方法,过滤恰好适用于固液分离,同学们在见到这种组合方式的时候可迅速联想到过滤,从而写出答案。再次溶解固体比较常用的试剂就是蒸馏水、酸溶液、碱溶液。氢氧化镁显然不溶于水,且一方面考虑到Mg(OH)2为中强碱,一方面又考虑到后边的产物是氯化物,所以要选强酸氯化氢做溶解剂;再次若使溶液变成固体晶体,需要蒸发出大部分溶剂,采取加热浓缩、冷却结晶的方法析出晶体,但是晶体表面仍然残余较多的杂质,此时仍然需要采用过滤的方法除去晶体表面的残留物。其中2019年高考理综化学全国卷一的第27个题目就完全可以按照此模型很快地得出答案。
尽管从海水中提取物质很复杂,但要设计成考试题,则必须要简化处理,实际考查所涉及到单质及其化合物的性质。为了更方便地解决此类问题,图3是对海水的综合利用建模。
1.3 量筒量液读数模型
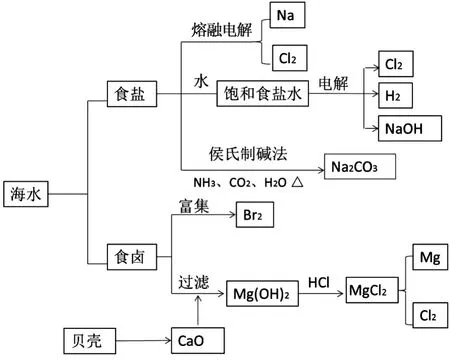
图3 对海水的综合利用建模
用量筒量取一定体积的液体,多数情况下,对于自然静置时上层液面为凹液面的液体,读数时视线应与液面的凹侧水平相切,此时方能正确读出液体的体积,而近些年来命题者往往围绕这一知识点出题目,通过仰视和俯视导致读数偏大或偏小的问题,那么怎么理解这种情况呢?比如说量筒内有40 mL水,正确的读法是视线与凹液面水平相切,读出的体积应为40 mL,但若俯视读数视线向下看到的点在液面以上,所以读数偏高而实际值则偏低,看到的刻度大于40 mL。若仰视的话,情况则相反,可以通过下图视线的变化(图4)[4]来表示。若教学时可以采用启发式教学,让学生按图索骥动手探索自然静置上层液面为凸液面液体读数大小的情况。
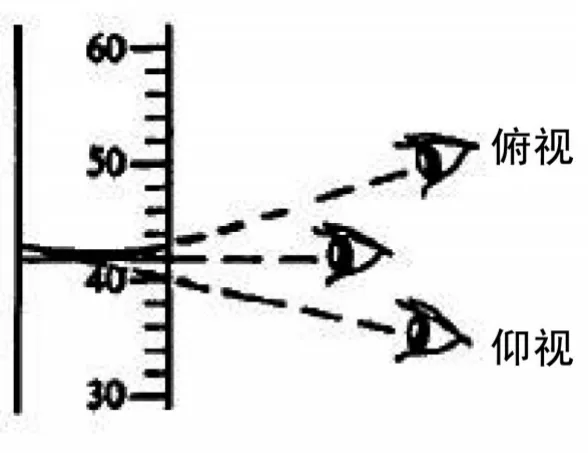
图4 视角变化对量筒读数大小的影响模型
1.4 电极反应方程式书写模型
在人教版模块一《化学反应原理》书中,介绍了化学反应与电能,其中情境素材建议中列出了铅蓄电池、锂离子电池等生活中常用的电池,欲解决电池内部反应原理问题,可以概括出4个步骤写出电极反应式,核心注意点分别如图5。
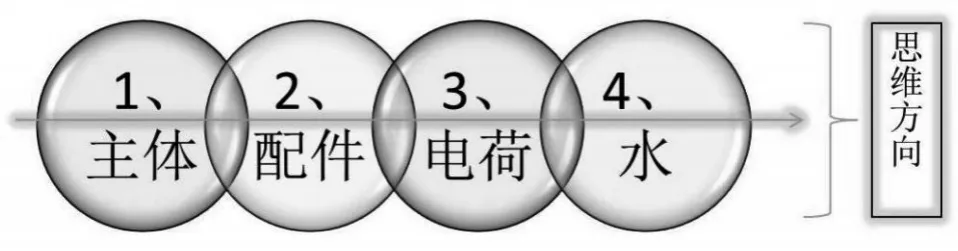
图5 电极方程式书写的四个核心注意点模型
解读:第1步,先确定好主体框架,主角原子(多数情况下为一些金属原子)要守恒,同时加上得失电子的数目;第2步,添加配件(多数情况下为一些酸根离子),此时不考虑氢元素和氧元素;第3步,查看电荷守恒,依决于反应的环境来搭配合适的氢离子或氢氧根离子;第4步,水到渠成,用左右边添水的方式来控制氢氧原子数目的守恒。
如已知铅蓄电池中发生的总反应式为:Pb(s)+PbO2+2H2SO4(aq)=2PbSO4(s)+2H2SO(1),请写出放电时正负极反应的方程式。
按照模型解题的方法解决正极反应的解题思维如下:首先主体是二氧化铅得到电子变成硫酸铅,左右各有一个主角铅原子已经守恒,硫酸铅里面的铅是正2价,故写成二氧化铅得到两个电子变成硫酸铅,即PbO2+PbSO4,这样就确定好了基本框架;其次容易观察到二氧化铅变成硫酸铅缺少个配件——硫酸根离子,所以在方程式的左面加上一个硫酸根离子,PbO2+2e-+PbSO4,然后观察方程式左边多出了4个负电荷,因此需要左边加上4个正电荷或者右边加上4个负电荷相抵消,又考虑到此环境溶液为酸性溶液,所以在左边加上4个氢离子就可以满足电荷守恒,即PbO2+2e-+4H++PbSO4,最后左边多了4个氢和2个氧,在右边配上两个水即水到渠成:PbO2+2e-+4H++PbSO4+2H2O。
于是得到:
正极:PbO(2s)+4H(+aq)+(aq)+2e-=PbSO(4s)+2H2O(l)
同理只需两步就可写出负极的反应方程式:
2 结束语
由于篇幅有限,在此只能介绍上述几个化学知识和模型,在初高中化学知识中还有很多模型,比如守恒、数轴、图像、元素周期表等就不一一列举了。把碎片化的知识分类整合能够使学习效果事半功倍。国内学者杨久民等阐述了图示在构建碎片化知识中的高效性,国外著名教育家夸美纽斯在其著作《大教学论》中提出要寻找一种方法,使教师少教,但是可以使学生多学,这种方法应该是以不变应万变的发散思维,运用多种灵活的方法进行教学,集思广益,对零散的化学知识进行系统化。模型构建正是基于以上教学理念的基础上在当今的课程教学中发挥举足轻重的作用。践行学科核心素养中的模型认知,可以让教学更高效,学生学习更轻松更有趣,同时也能提高学生的综合素质。
