罕见的外生性胃癌伴血清甲胎蛋白升高1例报告 *
2020-08-12杨含腾周辉年肖竞英程晓成焦作义
李 凡 杨含腾 周辉年 肖竞英 程晓成 焦作义
(兰州大学第二医院普通外科,兰州 730030)
外生性胃癌(gastric cancer,GC)是GC中特殊且极其少见的类型,系原发于胃壁向腔外生长的胃恶性肿瘤。临床表现有别于常见的腔内型GC,特点是对胃腔影响较小,故早期临床症状及体征不明显。此类GC对黏膜层影响较小或黏膜层基本正常,通过胃镜结合镜下活检往往不能明确诊断,极易与其他呈外生性肿物混淆。另外,由于其特殊的腔外型生长模式,极易早期侵犯周围器官,造成不良预后。目前,国内外关于外生性GC的文献甚少,多为个案报道。2018年12月我科收治1例外生性GC伴血清甲胎蛋白(alpha fetal protein,AFP)升高的罕见病例,报道如下。
1 临床资料
男,66岁,因上腹部疼痛不适伴腹胀2个月于2018年12月21日入院。患者既往体健,否认原发性高血压、糖尿病和冠心病等病史。查体:中上腹部可触及大小约60 mm×50 mm固定性肿块,压痛不明显,腋窝及锁骨上窝均未触及浅表肿大的淋巴结。外院腹部增强CT检查提示:胃体部胃壁增厚约15 mm,肝胃间隙可见团块状软组织密度灶,最大直径约62 mm,呈边缘环状强化,其内未见明显强化,肝胃间隙淋巴结肿大,恶性肿瘤可能性大(图1);肝脏大小、形态正常,表面轮廓光整,未见明显异常。外院胃镜检查提示:距门齿42~48 cm处后壁可见一隆起性巨大肿块,约50 mm×50 mm,表面坏死,质硬,接触易出血,取活检5块。活组织病理检查:(胃体)小块黏膜轻度慢性萎缩性炎伴轻度肠化,胃肠间质瘤(gastrointestinal stroma tumors,GIST)和GC待鉴别。肿瘤标记物:AFP 118.90 ng/ml(我院正常值:0.00~7.00 ng/ml),CEA 2.99 ng/ml(我院正常值:0.00~3.40 ng/ml),CA125 48.27 U/ml(我院正常值:0.00~35.00 U/ml),CA19-9 14.36 U/ml(我院正常值:0.00~27.00 U/ml)。在征得患者家属同意及排除手术禁忌证后于2018年12月24日行开腹探查术,术中见胃体小弯侧一直径约10 cm大小的外生性肿物,已侵犯浆膜,表面结节状、质硬、活动度欠佳,取小块组织送术中冰冻检查,结果为腺癌组织。遂决定立即行全胃切除术联合D2淋巴结清扫,上至食管下方距离贲门口约2 cm,下方距离幽门管约3 cm,完整切除全胃及肿瘤,并以Rou-en-Y重建消化道。手术时间4 h,术中出血量300 ml。术后标本与术中所见相符(图2A),切开外生性肿瘤标本,可见中心大片坏死,周围呈环状增厚(图2B)。病理检查(图2C):胃体部浸润性中-低分化腺癌(Lauren分型:混合型),浆膜面肿大瘤结节大小为60 mm×55 mm×50 mm,癌组织侵犯脉管,侵及浆膜层,两侧切缘未见癌残留;浆膜下淋巴结2枚,均见癌转移。免疫组化染色:癌细胞示MLH-1(+),PMS-2(+),MSH-2(+),MSH-6(+),EMA(+),CKP(+),CK7(灶+),CK19(+),CK20(-),LMP-1(-),C-erbB-2(0),Syn(-),PSA(-),Dog1(-),Vimentin(-),CD34(-),CD117(-),Ki67阳性细胞数40%。术后给予抗感染及营养支持等对症治疗,术后1周顺利出院。以21 d为周期,接受标准的6个FOLFOX6方案化疗周期。术后6个月门诊复查腹部增强CT示肝右前叶下段和左内叶上段可见10 mm×15mm和20 mm×15mm类圆形结节,边界清楚,增强后动脉期轻度强化,静脉期及延迟期强化幅度明显降低,考虑胃癌术后肝转移瘤。肿瘤标志物AFP术后降至正常范围,而后呈上升趋势,术后6个月升至12.47 ng/ml;CA125术后呈波动性变化,术后6个月降至24.75U/ml。向患者家属告知病情及相关风险,患者家属拒绝行转移灶病理诊断的相关操作。随访至2020年1月,患者未出现任何不适症状,且术后总生存期已超过1年。
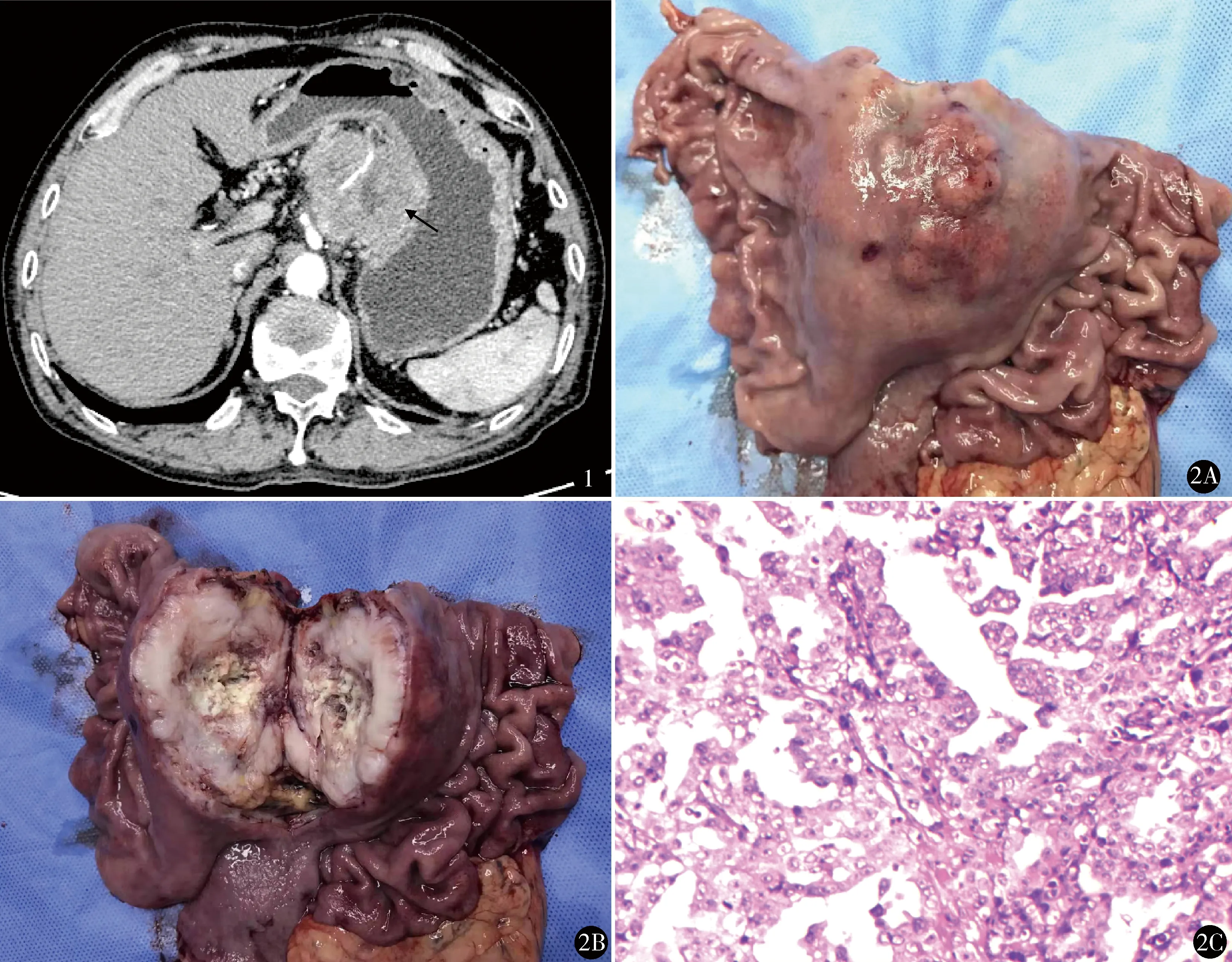
图1 胃体部胃壁增厚约15 mm,肝胃间隙可见团块状软组织密度灶,最大直径62 mm,呈边缘环状强化,其内未见明显强化 图2 A.术后标本可见胃体小弯侧一直径约10 cm大小的外生性肿物,侵犯浆膜,表面结节状;B.肿瘤切面观可见瘤体中心大片坏死,周围呈环状增厚;C.显微镜下可见癌细胞核大、深染、异型性明显,病理性核分裂像可见,腺体背靠背筛状排列,诊断:胃体部浸润性中-低分化腺癌(HE染色 ×100)
2 讨论
我国是GC高发区之一,总发病率约278.07/10万,死亡率167.89/10万,发病率和死亡率分别高居第2、3位[1]。GC发病率虽高,但目前关于外生性GC的国内外文献报道并不多,且多为个案报道,缺乏流行病学相关研究。
通常恶性肿瘤常以浸润性生长方式为主,良性肿瘤常表现为外生性生长或膨胀性生长。GC作为消化道常见恶性肿瘤表现为外生性生长模式并不多见,GIST通常表现为外生性或膨胀性生长模式。因此,仅靠影像学发现很难区分外生性GC和GIST。事实上,由于胃镜检查技术的成熟,GC的诊断并不困难。然而,本例术前胃镜及内镜下活组织检查并未发现腺癌细胞,一方面可能由于取材的位置不当所致;另一方面,由于胃腺癌表现为腔外型生长,胃镜取材的位置表浅,未触及癌灶所在。由于GIST常表现为黏膜下外生性肿瘤,因此,外生性GC极易与GIST混淆。当然,我们仍发现外生性胃腺癌和GIST在诊断上仍有一些细微鉴别点。GIST常表现肿瘤广泛的坏死、瘘管形成,较少出现邻近器官的侵犯、钙化、肠系膜脂肪浸润、淋巴结肿大及远处转移且瘤体多位于胃体[2];外生性胃腺癌常常表现为局灶性或弥漫性胃壁增厚、胃周淋巴结肿大及转移和梗阻症状,且瘤体多位于胃窦[3]。另外,术后可根据免疫组织化学染色加以鉴别,GIST的CD34和CD117常为阳性。本例术前外生性胃腺癌与GIST无法明确鉴别,此时,开腹探查术及术中冰冻活检是明确诊断和指导治疗行之有效的方法。由于进展期胃癌淋巴结转移率高达70%,手术时常规行D2淋巴结清扫;GIST很少出现淋巴结转移,手术的关键在于完整切除肿瘤,不必常规淋巴结清扫,且GIST由于对化疗药如甲磺酸伊马替尼敏感,预后较外生性胃腺癌更好[4,5]。由此可见,明确诊断对于指导治疗策略并预测患者预后极为重要。
值得注意的是,本例外生性胃腺癌血清AFP水平明显升高,CEA和CA19-9术前正常,CA125水平稍高但缺乏相关特异性,对外生性胃腺癌的诊断及鉴别诊断具有辅助参考价值。AFP是肝癌和卵黄囊肿瘤的特异性肿瘤标志物。为什么此类外生性GC患者的血清AFP水平会升高?在这里,我们必须提及甲胎蛋白阳性胃癌(alpha-fetoprotein-producing gastric carcinoma,AFPGC)的概念。AFPGC能在患者血清及癌灶产生AFP,通过血清学及术后免疫组化检查可发现。AFPGC具有更强的侵袭和增殖能力,诱导新血管形成,极易淋巴管浸润和远处转移,常常导致预后不良[6~8]。胃癌患者中AFPGC的发生率为1.95%,在明确诊断时常常已出现转移,主要是肝转移,占29.27%, 且AFPGC患者血清中AFP水平与肿瘤分化程度显著相关[9]。本例病理检查提示为中低分化腺癌且术后不久便出现肝转移灶,与上述观点一致。尽管该外生性GC表现出良性肿瘤生长模式的生物学行为,且已接受胃癌根治术及术后6个周期标准化疗,仍在术后6个月时出现肝转移灶。可见,血清AFP水平对于此类型外生性GC发生肝转移或许有一定预测作用。
外生性GC患者预后常常欠佳。张英豪等[10]报道12例外生性生长GC,4例总生存期超过1年,且最长1例生存期为3.5年。Oki等[11]报道1例巨大外生性胃腺癌同时侵犯横结肠和胰腺,根治性胰十二指肠切除术后总生存期超过5年且未发现肝转移和远处转移。本例接受根治性手术及术后标准化疗后虽出现肝转移灶,但总生存期已超过1年,且随访至2020年1月,患者并未出现不良结局。由此可见,即使外生性GC预后欠佳,积极的根治性手术联合标准化疗仍是改善预后或延迟肝或远处转移的主要手段,因为外生性肿瘤的大小有时不能精确映其浸润范围[11]。另外,外生性GC宏观体积通常较大,原因在于:一方面肿瘤向浆膜方向生长,对胃腔几乎较小,早期症状和体征不明显,无法及时早期明确诊断;另一方面,外生性AFPGC具有更强侵袭和增殖能力,诱导新生血管形成,为瘤体提供营养支持。同时,作为临床医生,我们需要注意血清AFP水平的升高,本例胃癌患者血清AFP水平为118.90 ng/ml,明显高于正常值水平,可见,AFP水平异常不仅与活动性肝炎、肝癌、卵黄囊肿瘤甚至胃癌密切相关。此外,此类胃癌患者血清中AFP水平可能与远处转移或预后不良有关。
综上所述,血清AFP水平和特殊的外生性生长模式两者皆有可能为影响胃癌患者预后。目前,积极根治性手术联合标准化疗仍是阻止和延缓外生性GC远处转移及改善预后的主要策略。
