陆川猪ANKRD1基因克隆及其表达差异分析
2020-08-11潘鹏丞焦迪谢婉陈宝剑关志惠谢炳坤
潘鹏丞 焦迪 谢婉 陈宝剑 关志惠 谢炳坤

摘要:【目的】克隆陸川猪心肌锚蛋白重复域1基因(ANKRD1),并进行生物信息学及组织表达谱分析,为研究ANKRD1在陆川猪机体内的功能作用提供参考依据。【方法】根据NCBI已公布的野猪ANKRD1基因序列(NM_213922.1)设计特异性引物,采用TRIzol法提取陆川猪心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪的总RNA,反转录合成cDNA,并以此为模板进行ANKRD1基因克隆,通过MegAlign、Protaram、Protscale、MHMM Server和SignalP等在线分析软件进行生物信息学分析,最后以实时荧光定量PCR检测ANKRD1基因在陆川猪各组织中的表达情况。【结果】陆川猪ANKRD1基因蛋白编码区(CDS)序列全长960 bp,编码319个氨基酸残基,与NCBI已公布野猪ANKRD1基因(NM_213922.1)的CDS序列存在4处碱基突变,但均为同义突变,二者的ANKRD1氨基酸序列同源性为99.6%。陆川猪ANKRD1基因编码蛋白分子量为36125.70 Da,理论等电点(pI)为7.09,属于稳定蛋白,其二级结构中α-螺旋占46.39%、无规则卷曲占39.81%、β-转角占9.09%、延伸链占4.70%;陆川猪ANKRD1蛋白不存在跨膜结构,也无信号肽,有多个磷酸化位点。陆川猪ANKRD1基因在其心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪等7个组织中均有表达,其中以心脏中的相对表达量最高,显著高于在其他组织中的相对表达量(P<0.05,下同),在脾脏中的相对表达量最低,显著低于在心脏、肝脏、肺脏和背最长肌中的相对表达量。【结论】ANKRD1基因在陆川猪的心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪等组织中均有表达,且存在明显差异,故推测ANKRD1基因在不同组织中发挥不同作用。
关键词: 陆川猪;ANKRD1基因;克隆;生物信息学;组织表达谱
Abstract:【Objective】The ankyrin repeat domain 1 gene(ANKRD1) of Luchuan pig was cloned and analyzed by bioinformatics and tissue expression profile, the purpose of this study was to provide a reference for studying the function of ANKRD1 in Luchuan pig. 【Method】The specific primers were designed according to the ANKRD1 gene sequence (NM_213922.1) published by NCBI. The total RNA of heart, liver, spleen, lung, kidney, longissimus dorsi and subcutaneous fat of Luchuan pig was extracted by TRIzol method, the cDNA was synthesized by reverse transcription, and the ANKRD1 gene was cloned using this template. The biological information was analyzed by online analysis software such as MegALign, Protaram, Protscale, MHMM Server and SignalP. Finally, the expression of ANKRD1 gene in various tissues of Luchuan pig was detected by real-time fluorescent quantitative PCR. 【Result】The protein coding region(CDS) of ANKRD1 gene of Luchuan pig was 960 bp in length and encoded 319 amino acid residues. There were four base mutations between Luchuan pig ANKRD1 gene and the CDS sequence of wild boar ANKRD1 gene(NM_213922.1) published by NCBI, but all of them were synonymous mutations. The homology of ANKRD1 amino acid sequence between Luchuan pig and wild boar was 99.6%. The molecular weight and theoretical isoelectric point(pI) of ANKRD1 gene of Luchuan pig were 36125.70 Da and 7.09 respectively, which was a stable protein. α-helix accounted for 46.39%, random coil accountedfor 39.81%, β-turn accounted for 9.09%, and extended strand accounted for 4.70%. The ANKRD1 protein of Luchuan pig had no transmembrane structure and signal peptide, and had multiple phosphorylation sites. The results showed that ANKRD1 gene was expressed in seven tissues including heart, liver, spleen, lung, kidney, longissimus dorsi and subcutaneous fat. The relative expression level of ANKRD1 in heart was the highest, which was significantly higher than that in other tissues(P<0.05, the same below), and the relative expression level in spleen was the lowest, which was significantly lower than that in heart, liver, lung and longissimus dorsi. 【Conclusion】ANKRD1 gene is expressed in heart, liver, spleen, lung, kidney, longissimus dorsi and subcutaneous fat of Luchuan pigs, and there are obvious differences. It is speculated that ANKRD1 gene plays a different role in different tissues.
Key words: Luchuan pig; ANKRD1 gene; cloning; bioinformatics; tissue expression profile
0 引言
【研究意义】陆川猪产于广西东南部的陆川县,是我国八大地方优良品种之一,具有体型小、早熟、肉质好、耐粗饲等优点(张家富等,2010),其开发潜能巨大。至今,国内已有许多学者针对陆川猪的生长性能和肉质性状等相关基因开展了系列研究。黄艳娜等(2014)研究认为,肌肉生长抑制素基因(MSTN)可作为研究陆川猪肌肉生长发育和脂肪沉积的候选基因;关志惠等(2017)研究发现陆川猪脂酰辅酶A氧化酶1基因(ACOX1)与其日增重、初生重、背膘厚和脂肪酸组成等重要数量性状遗传位点紧密相连,是一个与脂肪沉积相关的潜在候选基因;何剑雄(2018)研究表明,WFIKKN2基因启动子区的甲基化对其mRNA表达量有影响,进而影响陆川猪的生长发育;谢婉等(2018)研究证明G蛋白偶联受体1基因(GPR1)启动子甲基化对陆川猪肌肉脂肪有一定影响;焦迪等(2019)研究发现肌球蛋白调节轻链9基因(MYL9)磷酸化可能会影响陆川猪的肌肉生长。因此,挖掘并研究陆川猪的相关基因对开发利用其优良性状具有重要意义。【前人研究进展】心肌锚蛋白重复域1(Ankyrin repeat domain 1,ANKRD1)最早于1995年在体外培养的微血管内皮细胞中鉴定获得,属于MARP家族,在哺乳动物中高度保守(Zou et al.,1997;Kojic et al.,2010)。ANKRD1基因是胚胎基因,在胚胎和胎儿发育的过程中表达量较高,随着年龄的增长其表达量逐渐降低;但ANKRD1基因在肌肉萎缩和营养不良时可持续上调(Laure et al.,2009)。临床医学表明,心肌肥厚和心力衰竭的患者心脏中ANKRD1基因高表达,是其临床症状的主要标志之一(Ling et al.,2017;Wette et al.,2017),即ANKRD1对心脏的生长发育及心肌结构与功能的完善具有重要作用(Almodóvar-García et al.,2014)。此外,Park等(2005)研究证明ANKRD1基因对血管新生及组织修复发挥重要作用,对细胞凋亡也起双向调节作用。Ponsuksili等(2009)研究发现在显著的特征相关基因中ANKRD1基因是肉类品质的候选基因之一。Zhong等(2015)研究发现,ANKRD1通过招募GATA4和ERK1/2至肌节大分子复合物,促使GATA4磷酸化增强,之后ANKRD1复合物移位进入细胞核内,致使肥大基因诱导表达,最终促进心肌肥厚。王译晗等(2018)研究表明,miR-218能抑制AngⅡ诱导的心肌肥大,其原因可能是靶向抑制ANKRD1基因表达而发挥作用。【本研究切入点】ANKRD1基因虽然在机体心肌组织中表达量最高,但在肌肉里也高表达且与肉质和骨骼肌性状等相关,但该基因在生猪上的研究较少,尤其在陆川猪上的研究鲜见报道。【拟解决的关键问题】提取陆川猪心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪的总RNA,反转录合成cDNA,并以此为模板进行ANKRD1基因克隆,通过MegAlign、Protaram、Protscale、MHMM Server和SignalP等在线分析软件进行生物信息学分析,探究ANKRD1基因在陆川猪各組织中的表达情况,为研究ANKRD1在陆川猪机体内的功能作用提供参考依据。
1 材料与方法
1. 1 试验材料
3头2月龄的陆川猪由广西畜牧研究所提供,采集其心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪。酵母浸出物和胰蛋白胨购自Oxoid公司;TRIzol试剂、Premix Taq DNA聚合酶、pMD18-T载体、反转录试剂盒(PrimeScriptTM II 1st Strand cDNA Synthesis Kit)及定量试剂盒(PrimeScriptTM RT rea-gent Kit with gDNA Eraser)均购自TaKaRa公司;胶回收试剂盒购自杭州博日科技有限公司;大肠杆菌Trans 5α感受态细胞购自北京全式金生物技术有限公司;DNA Marker购自广州东盛生物科技有限公司;琼脂糖购自Biowest公司。
1. 2 试验方法
1. 2. 1 引物设计与合成 按照NCBI中已公布的野猪ANKRD1基因序列(NM_213922.1),利用Oligo 7.0设计陆川猪ANKRD1基因的克隆引物(ANKRD1-F1和ANKRD1-R1)和定量引物(ANKRD1-F2和ANKRD1-R2),以及内参引物(GAPDH-F和GAPDH-R)(表1)。所有引物均委托生工生物工程(上海)股份有限公司合成。
1. 2. 2 陆川猪ANKRD1基因克隆 采用TRIzol法提取陆川猪心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪的总RNA,并反转录合成cDNA,以ANKRD1-F1和ANKRD1-R1为引物进行PCR扩增。PCR反应体系10.0 ?L:Premix Taq DNA聚合酶5.0 ?L,cDNA模板1.0 ?L,上、下游引物各0.4 ?L,RNase free ddH2O 3.2 ?L。扩增程序:94 ℃ 30 s,59 ℃ 30 s,72 ℃ 90 s,进行30个循环。以2.0%琼脂糖凝胶电泳对PCR扩增产物进行检测,染色后对目的条带进行胶回收,胶回收产物与pMD18-T载体连接过夜,转化Trans 5α感受态细胞后经涂板、挑菌、扩大培养和菌液PCR验证,将阳性PCR扩增产物送至生工生物工程(上海)股份有限公司测序。
1. 2. 3 实时荧光定量PCR 以反转录试剂盒反转录合成的cDNA为模板、GAPDH基因为内参基因,检测ANKRD1基因在陆川猪各组织的表达量。PCR反应体系10.0 ?L:TB GreenⅡ5.0 ?L,上、下游引物各0.25 ?L,cDNA模板2.5 ?L,RNase free ddH2O 2.0 ?L。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行37个循环。每个样本重复3次,采用2-ΔΔCt法换算陆川猪ANKRD1基因的相对表达量。
1. 3 陆川猪ANKRD1基因生物信息学分析
采用MegAlign检测陆川猪与其他物种间的ANKRD1氨基酸序列同源性并构建系统发育进化树;运用ProtParam预测分析陆川猪ANKRD1基因编码蛋白的理化性质;利用SOPMA和SWISS-MODEL分别预测分析ANKRD1蛋白的二、三级结构;以ProtScale、MHMM Server 2.0和SignalP 4.1对其疏水性、跨膜结构和信号肽进行预测;采用NetNGlyc 1.0、NetOGlyc 3.1和NetPhos 3.1 Server分别预测ANKRD1蛋白的N、O糖基化位点和潜在的磷酸化位点及对应的蛋白激酶位点;运用WoLF PSORT进行亚细胞定位分析;并以NCBI中的CD-search在线预测陆川猪ANKRD1蛋白保守结构域。
2 结果与分析
2. 1 陆川猪ANKRD1基因克隆结果
PCR扩增产物采用2.0%琼脂糖凝胶电泳进行检测,结果在1000 bp附近观察到明亮清晰的目的条带(图1),与预期结果相符。
2. 2 陆川猪ANKRD1基因生物信息学分析结果
2. 2. 1 陆川猪ANKRD1基因测序分析 克隆获得的陆川猪ANKRD1基因蛋白编码区(CDS)960 bp,编码319个氨基酸残基,与NCBI已公布的野猪ANKRD1基因(NM_213922.1)CDS序列存在4处碱基突变(图2),但均为同义突变。经BLASTp比对分析发现,陆川猪ANKRD1氨基酸序列与NCBI已公布野猪(NM_213922.1)、绵羊(NM_001252178.1)、牛(NM_001034378.2)、人类(NM_014391.3)、灰仓鼠(NM_001246706.1)、褐家鼠(NM_013220.1)和小家鼠(NM_013468.3)的ANKRD1氨基酸序列同源性分别为99.6%、92.8%、92.5%、90.8%、86.6%、86.4%和86.1%(图3)。基于ANKRD1氨基酸序列同源性构建的系统发育进化树(图4)也显示,陆川猪与野猪的亲缘关系最近,但与灰仓鼠的亲缘关系最远。
2. 2. 2 陆川猪ANKRD1蛋白理化性质 ProtParam预测分析结果表明,陆川猪ANKRD1基因编码蛋白分子量为36125.70 Da,理论等电点(pI)为7.09,N端氨基酸残基为Met(蛋氨酸);其带负电荷的氨基酸残基(Asp+Glu)总数53个,带正电荷的氨基酸残基(Arg+Lys)总数也是53个。ANKRD1蛋白在哺乳动物体外的半衰期为30 h,不稳定系数为30.80,属于稳定蛋白。
2. 2. 3 陆川猪ANKRD1蛋白二、三级结构 利用SOPMA对陆川猪ANKRD1蛋白二级结构进行预测分析,结果发现其二级结构中α-螺旋占46.39%、无规则卷曲占39.81%、β-转角占9.09%、延伸链占4.70%(图5)。应用SWISS-MODEL预测陆川猪ANKRD1蛋白三级结构,结果显示陆川猪ANKRD1蛋白可能存在的三级结构有3种模型(图6)。
2. 2. 4 陆川猪ANKRD1蛋白亲/疏水性 采用ProtScale对陆川猪ANKRD1蛋白进行亲/疏水性预测分析,结果显示第在223位氨基酸的分值最大(1.656),在第98和99位氨基酸的分值最小,均为 -3.389。综合图7可知,陆川猪ANKRD1蛋白属于疏水性蛋白。
2. 2. 5 陆川猪ANKRD1蛋白信号肽和跨膜结构 采用SignalP 4.1对陆川猪ANKRD1蛋白信号肽进行预测,结果显示无信号肽存在(图8)。应用TMHMM Server 2.0对陆川猪ANKRD1蛋白跨膜结构进行预测分析,结果显示不存在跨膜结构(图9)。
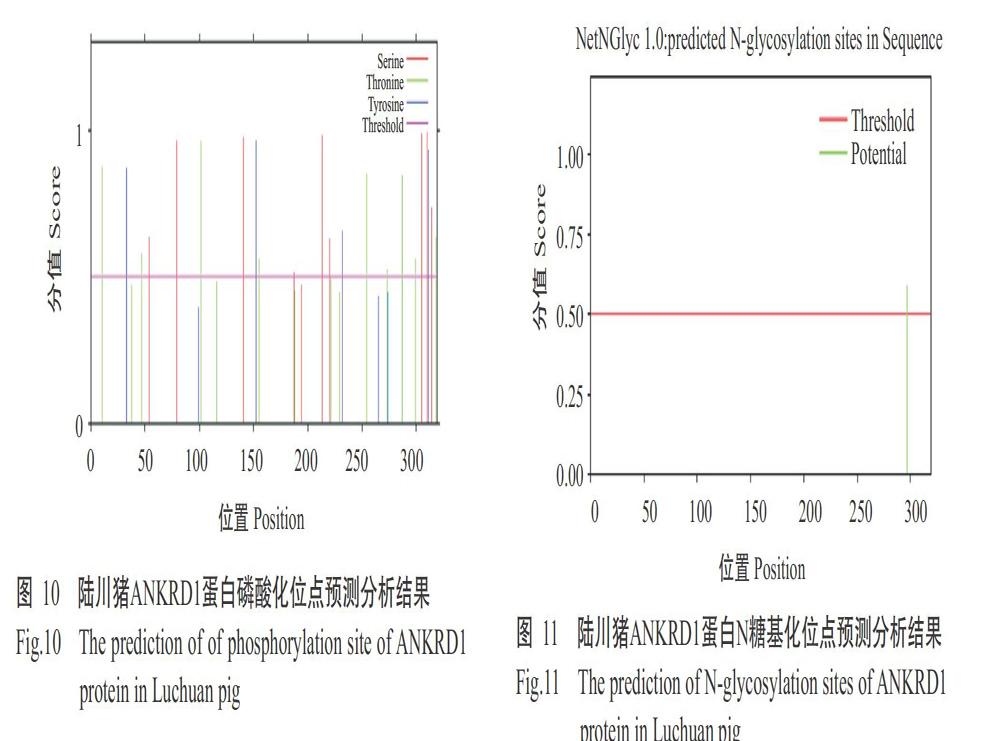
2. 2. 6 陆川猪ANKRD1蛋白磷酸化位点 利用NeTPhos 3.1 Server对陆川豬ANKRD1蛋白磷酸化位点进行预测分析,结果显示陆川猪ANKRD1蛋白可能有22个位点被磷酸化(图10),且预测发现该蛋白上存在PKC、RSK、GSK13、CaM-Ⅱ和PKG等16种蛋白激酶结合位点。
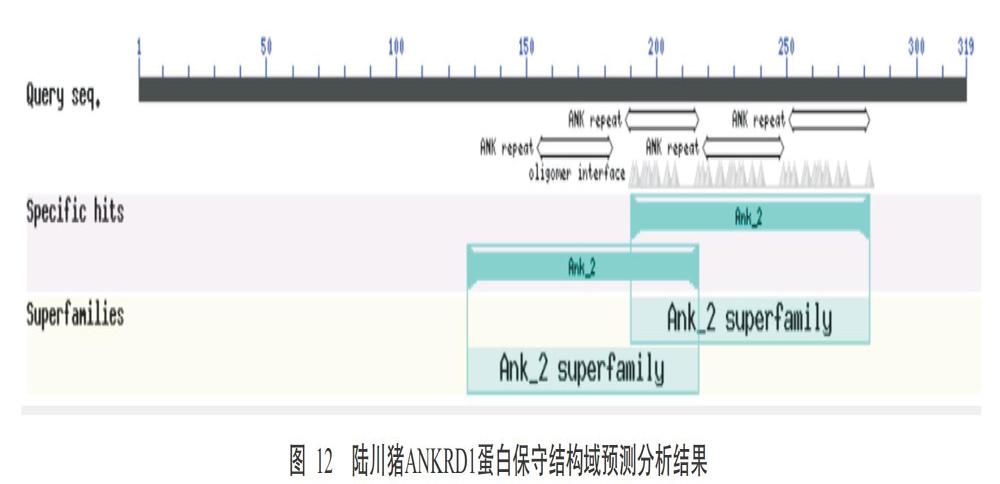
2. 2. 7 陆川猪ANKRD1蛋白糖基化位点 虽然NetNGlyc 1.0对陆川猪ANKRD1蛋白N糖基化位点的预测分析结果显示可能存在1个糖基化位点,但由于陆川猪ANKRD1蛋白无信号肽,是不可能被暴露在N-糖基化机制中,因此在体内可能不会被糖基化(图11)。
2. 2. 8 陆川猪ANKRD1蛋白保守域及亚细胞定位 利用NCBI中的CD-search在线预测分析陆川猪ANKRD1蛋白保守结构域,结果显示存在2个保守的结构域(图12)。同时运用WoLF PSORT对陆川猪ANKRD1蛋白进行亚细胞定位分析,结果显示,细胞质占65.2%,细胞核占17.4%,线粒体、液泡膜、细胞骨架和分泌系统小泡各占4.3%。
2. 3 ANKRD1基因在陆川猪不同组织中的表达情况
以GAPDH基因为内参基因,采用实时荧光定量PCR检测ANKRD1基因2月龄陆川猪心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪等7个组织中的表达情况,结果显示,陆川猪ANKRD1基因在各组织中均有表达,其中以心脏中的相对表达量最高,显著高于在其他组织中的相对表达量(P<0.05,下同),在脾脏中的相对表达量最低,显著低于在心脏、肝脏、肺脏和背最长肌中的相对表达量(图13)。
3 讨论
目前,有关ANKRD1基因在猪上的研究较少,针对人类的研究也主要集中在疾病方面,且该基因在其他物种上的研究也不多,因此,ANKRD1基因的作用与功能,以及能否用于性状选择尚需进一步探究。由于ANKRD1基因最先是在成人主动脉cDNA文库中克隆获得,也称CARP基因,主要在成年动物的心脏组织中表达,是诊断心肌肥厚的重要标志(Kuo et al.,1999;Aihara et al.,2000)。本研究成功克隆获得陆川猪ANKRD1基因,其CDS序列全长960 bp,编码319个氨基酸残基,陆川猪与野猪的ANKRD1氨基酸序列同源性最高(99.6%),亲缘关系最近;陆川猪ANKRD1蛋白不存在跨膜结构,也无信号肽,有多个磷酸化位点;其二级结构中α-螺旋占46.39%、无规则卷曲占39.81%、β-转角占9.09%、延伸链占4.70%;陆川猪ANKRD1基因在心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪等7个组织中均有表达,其中以心脏中的相对表达量最高,显著高于在其他组织中的相对表达量。综合前人的相关研究结果,可确定ANKRD1主要在心肌组织中发挥作用(Almodóvar-García et al.,2014)。但也有研究认为,ANKRD1对骨骼肌有一定影响,例如ANKRD1基因在杜氏肌营养不良和其他营养不良患者的肌肉组织中上调表达(Bakay et al.,2002;Nakada et al.,2003),是对急性抵抗运动或超负荷工作的应激反应(Carson et al.,2002;Chen et al.,2014)。本研究还发现,陆川猪ANKRD1基因在肌肉中的相对表达量也很高,且显著高于在脂肪组织中的相对表达量,故推测进一步研究ANKRD1基因对揭示猪背最长肌的生长具有重要意义。
有关ANKRD1基因分子功能的研究,已有文献报道该基因在转录调控、肌原纤维组装、拉伸感及肌浆与细胞核间的联系等方面发挥关键作用(Granzier and Labeit,2004)。此外,在肌肉萎缩过程中ANKRD1基因的差异表达进一步说明其参与骨骼肌的可塑性,即ANKRD1可作为骨骼肌病理重塑的标志物(Laure et al.,2009)。还有研究表明,ANKRD1主要定位在肌节和细胞核,且可在细胞核与细胞质间来回穿梭。当ANKRD1定位在细胞核时,主要对转录起辅助作用,可被IL-1和TNF-α激活(Kojic et al.,2010;Wu et al.,2013);定位在细胞质中时,ANKRD1可与肌靶蛋白和肌钙蛋白等多种蛋白结合,在维持许多病理或生理进程方面发挥重要作用(Samaras et al.,2015)。本研究运用WoLF PSORT对陆川猪ANKRD1蛋白进行亚细胞定位分析,结果显示,细胞质占65.2%,细胞核占17.4%,线粒体、液泡膜、细胞骨架和分泌系统小泡各占4.3%。但本研究仅对陆川猪ANKRD1基因编码蛋白进行基础的生物信息学预测分析,ANKRD1基因在陆川猪背最长肌中的作用机制尚有待进一步探究。
4 结论
ANKRD1基因在陆川猪的心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和皮下脂肪等组织中均有表达,且存在明显差异,故推测ANKRD1基因在不同组织中发挥不同作用。
参考文献:
关志惠,陈宝剑,潘天彪,覃兆鲜,刘嘉琪,马青艳,农素群,谢炳坤. 2017. 陆川猪脂酰辅酶A氧化酶1基因克隆及序列分析[J]. 中国畜牧兽医,44(3):628-634. [Guan Z H,Chen B J,Pan T B,Qin Z X,Liu J Q,Ma Q Y,Nong S Q,Xie B K. 2017. Cloning and sequence analysis of ACOX1 gene in Luchuan pig[J]. China Animal Husban-dry & Veterinary Medicine,44(3):628-634.]
何剑雄. 2018. 猪WFIKKN2基因启动子区甲基化及mRNA表达水平研究[D]. 南宁:广西大学. [He J X. 2018. The promoter region methylation status and mRNA expression of WFIKKN2 gene in pig[D]. Nanning:Guangxi University.]
黄艳娜,李莉,韦玲静,郭晓萍,梁明振,兰干球,蒋钦杨. 2014. 陆川猪肌肉生长抑制素基因的克隆与序列分析[J]. 南方农业学报,45(4):659-663. [Huang Y N,Li L,Wei L J,Guo X P,Liang M Z,Lan G Q,Jiang Q Y. 2014. Gene cloning and sequence analysis of myostatin in Luchuan pig[J]. Journal of Southern Agriculture,45(4):659-663.]
焦迪,谢婉,潘鹏丞,陈宝剑,关志惠,杨秀荣,兰干球,郭亚芬,谢炳坤. 2019. 陆川猪MYL9基因克隆及其表达差异分析[J]. 南方农业学报,50(3):454-460. [Jiao D,Xie W,Pan P C,Chen B J,Guan Z H,Yang X R,Lan G Q,Guo Y F,Xie B K. 2019. Cloning and differential expression analysis of MYL9 gene in Luchuan pig[J]. Journal of Southern Agriculture,50(3):454-460.]
王译晗,朱海英,骆海燕,陆彩玲,高小博. 2018. miR-218对血管紧张素II诱导的心肌细胞肥大的影响[J]. 中國计划生育学杂志,26(6):428-433. [Wang Y H,Zhu H Y,Luo H Y,Lu C L,Gao X B. 2018. The effect of miR-218 on ang II induced cardiomyocyte hypertrophy[J]. Chinese Journal of Family Planning,26(6):428-433.]
谢婉,焦迪,何剑雄,陈宝剑,关志惠,兰干球,郭亚芬,谢炳坤. 2018. 陆川猪GPR1基因启动子甲基化及其mRNA表达分析[J]. 黑龙江畜牧兽医,(17):1-4. [Xie W,Jiao D,He J X,Chen B J,Guan Z H,Lan G Q,Guo Y F,Xie B K. 2018. Methylation and mRNA expression analysis of GPR1 promoter in Luchuan pig[J]. Heilongjiang Animal Science and Veterinary Medicine,(17):1-4.]
张家富,何若钢,江永强,覃小荣,黄伟杰,刘丁健,刘桂武,罗丽萍. 2010. 陆川猪胴体品质及肉质的研究[J]. 养猪,(6):33-35. [Zhang J F,He R G,Jiang Y Q,Qin X R,Huang W J,Liu D J,Liu G W,Luo L P. 2010. Study on carcass quality and meat quality of Luchuan pig[J]. Swine Production,(6):33-35.]
Aihara Y,Kurabayashi M,Saito Y,Ohyama Y,Tanaka T,Takeda S,Tomaru K,Sekiguchi K,Arai M,Nakamura T,Nagai R. 2000. Cardiac ankyrin repeat protein is a novel marker of cardiac hypertrophy:Role of M-CAT element within the promoter[J]. Hypertension,36(1):48-53.
Almodóvar-García K,Kwon M,Samaras S E,Davidson J M. 2014. ANKRD1 acts as a transcriptional repressor of MMP13 via the AP-1 site[J]. Molecular and Cellular Bio-logy,34(8):1500-1511.
Bakay M,Zhao P,Josephine C,Hoffman E P. 2002. A web-accessible complete transcriptome of normal human and DMD muscle[J]. Neuromuscular Disorders,12(Suppl 1):S125-S141.
Carson J A,Nettleton D,Reecy J M. 2002. Differential gene expression in the rat soleus muscle during early work overload-induced hypertrophy[J]. FASEB Journal,16(2):207-209.
Chen C,Shen L,Cao S P,Li X X,Xuan W L,Zhang J W,Huang X B,Bin J P,Xu D L,Li G F,Kitakaze M,Liao Y L. 2014. Cytosolic CARP promotes angiotensin II-or pressure overload-induced cardiomyocyte hypertrophy through calcineurin accumulation[J]. PLoS One,9(8):e104040.
Granzier H L,Labeit S. 2004. The giant protein titin:A major player in myocardial mechanics,signaling,and disease[J]. Circulation Research,94(3):284-295.
Kojic S,Nestorovic A,Rakicevic L,Belgrano A,Stankovic M,Divac A,Faulkner G. 2010. A novel role for cardiac ankyrin repeat protein Ankrd1/CARP as a co-activator of the p53 tumor suppressor protein[J]. Archives of Biochemistry and Biophysics,502(1):60-67.
Kuo H,Chen J,Ruiz-Lozano P,Zou Y,Nemer M,Chien K R. 1999. Control of segmental expression of the cardiac-restricted ankyrin repeat protein gene by distinct regulatory pathways in murine cardiogenesis[J]. Development,126(19):4223-4234.
Laure L,Suel L,Roudaut C,Bourg N,Ouali A,Bartoli M,Richard I,Danièle N. 2009. Cardiac ankyrin repeat protein is a marker of skeletal muscle pathological remodelling[J]. The FEBS Journal,276(3):669-684.
Ling S S M,Chen Y T,Wang J,Richards A,Liew O W. 2017. Ankyrin repeat domain 1 protein:A functionally pleiotropic protein with cardiac biomarker potential[J]. International Journal of Molecular Sciences,18(7):1362. doi:10.3390/ijms18071362.
Nakada C,Oka A,Nonaka I,Sato K,Mori S,Ito H,Moriyama M. 2003. Cardiac ankyrin repeat protein is preferentially induced in atrophic myofibers of congenital myopathy and spinal muscular atrophy[J]. Pathology International,53(10):653-658.
Park J H,Liu L,Kim I H,Kim J H,You K R,Kim D G. 2005. Identification of the genes involved in enhanced fenretinide-induced apoptosis by parthenolide in human hepatoma cells[J]. Cancer Research,65(7):2804-2814.
Ponsuksili S,Murani E,Phatsara C,Schwerin M,Schellander K,Wimmers K. 2009. Porcine muscle sensory attributes associate with major changes in gene networks involving CAPZB,ANKRD1,and CTBP2[J]. Functional & Integrative Genomics,9(4):455-471.
Samaras S E,Almodóvar-García K,Wu N J,Fang Y,Davidson J M. 2015. Global deletion of Ankrd1 results in a wound-healing phenotype associated with dermal fibroblast dysfunction[J]. The American Journal of Pathology,185(1):96-109.
Wette S G,Smith H K,Lamb G D,Murphy R M. 2017. Cha-racterization of muscle ankyrin repeat proteins in human skeletal muscle[J]. American Journal of Physiology. Cell Physiology,313(3):C327-C339.
Wu Y,Ruggiero C L,Bauman W A,Cardozo C. 2013. Ankrd1 is a transcriptional repressor for the androgen receptor that is downregulated by testosterone[J]. Bioche-mical and Biophysical Research Communications,437(3):355-360.
Zhong L,Manuel C,Cadar A G,Lin A,Samaras S,Davidson J M,Lim C C. 2015. Targeted inhibition of ANKRD1 disrupts sarcomeric ERK-GATA4 signal transduction and abrogates phenylephrine-induced cardiomyocyte hypertrophy[J]. Cardiovascular Research,106(2):261-271.
Zou Y,Evans S,Chen J,Kuo H C,Harvey R P,Chien K R. 1997. CARP,a cardiac ankyrin repeat protein, is downstream in the Nkx2-5 homeobox gene pathway[J]. Deve-lopment,124(4):793-804.
(責任编辑 兰宗宝)
