木薯抗细菌性枯萎病生理特性研究
2020-08-11吴美艳罗兴录樊铸硼刘继忠金相宇
吴美艳 罗兴录 樊铸硼 刘继忠 金相宇

摘要:【目的】探討木薯抗细菌性枯萎病的生理特性,为木薯抗细菌性枯萎病品种选育提供依据。【方法】以木薯品种新选048为试验材料,采用桶栽方式室外种植木薯,在木薯苗期和块根形成期以针刺法接种细菌性枯萎病病原菌,以不接种病原菌的木薯叶片为对照,分别于接种后7和14 d采样测定脯氨酸(Pro)、丙二醛(MDA)、可溶性糖和可溶性蛋白含量及过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)活性,对比分析人工接种侵染后发病叶与健康叶的生理指标差异。【结果】细菌性枯萎病病原菌接种侵染后,木薯发病叶片的Pro含量及POD、PPO和CAT活性均高于对照。苗期接种7和14 d后,接种病原菌叶片的Pro含量分别较对照极显著提高83.3%和112.5%(P<0.01,下同),块根形成期接种7和14 d后,接种病原菌叶片的Pro含量分别较对照极显著提高110.2%和120.2%;苗期和块根形成期接种14 d后,接种病原菌叶片的MDA含量分别较对照显著降低30.9%和17.9%(P<0.05,下同),POD活性分别较对照极显著提高66.7%和96.4%,PPO活性分别较对照显著提高43.1%和30.4%,CAT活性分别较对照显著提高31.2%和28.9%。苗期和块根形成期2次接种侵染后发病叶片的可溶性糖含量、SOD活性和PAL活性多无显著差异(P>0.05)。【结论】木薯叶片的Pro和MDA含量及POD、PPO和CAT活性与木薯抗细菌性枯萎病有密切关系,这些指标可作为木薯抗细菌性枯萎病评价的生理指标。
关键词: 木薯;细菌性枯萎病;抗性;生理特性
Abstract:【Objective】The physiological characteristics of cassava resistance to bacterial wilt were studied to provide a basis for breeding of cassava varieties that were resistant to bacterial wilt. 【Method】In this experiment,cassava variety Xinxuan 048 as the research material,the cassava was grown outdoors in a barrel planting method. At the cassava seedling stage and the root formation stage, the bacterial wilt pathogen was inoculated by acupuncture, and the cassava leaves without inoculation were used as controls. 7 and 14 d after inoculation, samples were taken to determine the contents of proline(Pro), malondialdehyde(MDA), soluble sugar and soluble protein, activities of catalase(POD), polyphenol oxidase(PPO), superoxide dismutase(SOD), catalase(CAT) and phenylalanine ammonia-lyase(PAL), comparative analysis of physiological indexes of diseased leaves and healthy leaves after artificial inoculation was conducted. 【Result】The measurement results of physiological indexes after infection of bacterial wilt pathogens showed that the contents of Pro and the activities of POD, PPO and CAT in cassava diseased leaves after inoculation were higher than those of the control. After 7 and 14 d of seedling inoculation, the Pro in inoculated pathogenic leaves extremely increased by 83.3% and 112.5% compared to the control(P<0.01,the same below), and after 7 and 14 d of tuber inoculation, the Pro in inoculated pathogenic leaves extremely increased by 110.2% and 120.2%, respectively, compared to the control. At 14 d after ino-culation at the stage and the root formation stage, the MDA content of the leaves inoculated with pathogens significantly reduced by 30.9% and 17.9% respectively(P<0.05,The same below), and the POD activities of the leaves inoculated with pathogens were increased by 66.7% and 96.4% compared with the control. PPO activities significantly increased by 43.1% and 30.4% respectively, and CAT activities of pathogen-inoculated leaves increased by 31.2% and 28.9% respectively compared with the control. Soluble sugar content, SOD activity, and PAL activity of infected leaves inoculated twice at the seedling stage and tuber formation stage had no significant difference(P>0.05). 【Conclusion】It can be seen that the contents of Pro, MDA and the activities of POD, PPO and CAT in cassava leaves are closely related to the resistance to bacterial wilt. These indicators can be used as physiological indicators for the evaluation of cassava resistance to bacterial wilt.
Key words: cassava; bacterial wilt; resistance; physiological characteristics
0 引言
【研究意义】木薯(Manihot esculenta Crantz)为大戟科木薯属植物,亦称树薯,是世界三大薯类作物之一,是一种用途较广、经济价值较高的作物,也是一种发展潜力巨大的可再生能源作物(Fokunang et al.,2001;刘纪霜等,2013)。木薯细菌性枯萎病(Cassava bacterial blight,CBB)又名流胶病,由地毯草黄单胞菌属木薯萎蔫致病变种(Xanthomonas axonopodis pv. manihotis,Xam)引起(岑贞陆等,2006),该病主要危害木薯叶片和茎部,受害叶片出现病斑,枯黄萎蔫,受害嫩茎或枝条枯死,块根淀粉含量下降,可造成12%~90%的产量损失,严重时可导致全株死亡,是全球范围内威胁木薯产量和制约相关产业发展的重要因素之一(Ogunjobi et al.,2010;曾小荣和郑刚辉,2011;卢昕等,2013)。因此,研究木薯抗细菌性枯萎病的生理机制,对我国木薯抗枯萎病品种选育及病害防治具有重要意义。【前人研究进展】目前,国内已有一些关于植物抗枯萎病病原菌生理机制的相关报道。胡莉莉(2006)研究表明,香蕉接种枯萎病病原菌后,假茎部位的多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)等防御酶活性与抗病性呈极显著正相关,与丙二醛(MDA)含量和脯氨酸(Pro)含量呈极显著负相关。樊春俊等(2012)研究表明,不同木薯品种接种细菌性枯萎病病原菌后,POD和PPO活性显著升高后又下降,过氧化氢酶(CAT)活性无明显变化,而超氧化物歧化酶(SOD)活性呈下降趋势。潘存祥(2014)研究表明,SOD、POD、CAT、PPO和PAL等防御保护酶活性升高能增强西瓜对枯萎病的抵抗能力,是评价西瓜抗枯萎病的重要生理生化指标。吴超等(2015)研究表明,香蕉的CAT、POD和PPO活性与香蕉抗枯萎病呈正相关,可作为评價香蕉抗枯萎病的生理评价指标。张曼(2016)研究表明,香蕉接种枯萎病病原菌后,香蕉的抗病性与POD、PPO、几丁质酶和p-1,3-葡聚糖酶活性呈正相关,与PAL活性存在一定的相关性。时涛等(2017)研究表明,木薯抗细菌性枯萎病与氨基转移酶、葡萄糖—果糖氧化还原酶活性有关。李伯凌(2017)研究表明,木薯接种细菌性枯萎病病原菌后,木薯叶片可溶性糖含量无明显变化,抗病品种的POD、PPO和PAL活性均大于感病品种,Pro含量略高于感病品种,而接种前期可溶性蛋白含量呈下降趋势。李海明等(2019)研究表明,山苦瓜幼苗接种枯萎病病原菌后,POD、SOD和PAL活性与抗病性呈正相关,MDA含量与抗病性呈负相关。【本研究切入点】近年来,关于木薯抗细菌性枯萎病的研究主要集中在木薯品种的抗性鉴定及防治方面,而针对木薯抗病生理特性的研究较少。【拟解决的关键问题】采用桶栽方式室外种植木薯,在木薯苗期和块根形成期,以针刺法接种细菌性枯萎病病原菌,以不接种病原菌的木薯叶片为对照,分别于接种后7和14 d采样测定生理指标,对比分析人工接种侵染后发病叶与健康叶的生理指标差异,探讨木薯抗细菌性枯萎病的生理特性,为木薯抗细菌性枯萎病品种选育提供依据。
1 材料与方法
1. 1 试验材料
供试木薯品种为对细菌性枯萎病较敏感的新选048,由广西大学木薯课题组提供。
供试菌株为Cax-03,采自广西北海市合浦县农业科学研究所试验基地具有细菌性枯萎病症状的木薯病叶,由广西大学农学院分离鉴定。
1. 2 试验方法
试验于2018年在广西大学科研教学基地进行。采用桶栽法,塑料桶高39 cm,上底直径56 cm,下底直径40 cm,设有排水口。桶内装70 kg大田土壤,栽种前每桶施0.65 kg有机肥作基肥,肥料与土壤充分混匀后栽种木薯,木薯种茎砍成15 cm长的茎段,采用斜插法植入种植桶。
将菌株Cax-03在牛肉膏蛋白胨培养基(蛋白胨5 g、牛肉膏3 g、蔗糖10 g、琼脂15 g、水1000 mL)上平板涂布培养48 h,然后挑取1个单菌落放入150 mL的三角瓶,置于摇床(130 r/min、28 ℃)24 h,用液体培养基(无琼脂)配成浓度为108 CFU/mL的菌悬浮液(菌液浓度在OD600为0.6)供接种用。在木薯苗期和块根形成期,选择生长正常的木薯植株,采用针刺法在倒4叶进行接种病原菌处理,即通过针刺把菌液接到木薯的叶片上,同时以接种灭菌液体培养基(不接种病原菌)的木薯叶片为对照。每处理种10桶,3次重复。不同处理分开放置,其他栽培管理措施同常规桶栽。分别在苗期和块根形成期接种后的7和14 d(苗期6月21日、6月28日,块根形成期8月21日、8月28日)进行叶片采样,测定各项生理指标。
1. 3 测定项目及方法
Pro含量采用磺基水杨酸法测定(张宪政,1992),MDA含量采用硫代巴比妥酸法测定(李合生,2000);可溶性糖含量采用蒽酮比色法测定,可溶性蛋白含量采用考马斯亮蓝G-250染色法测定(孔祥生和易现峰,2008),POD活性采用愈创木酚比色法测定(李合生,2000),PPO活性采用碘量法测定(李合生,2000),SOD活性采用氮蓝四唑光化还原法测定(李合生,2000),CAT活性采用紫外吸收法测定(李合生,2000),PAL活性采用分光光度法测定(张福平和李秋红,2008)。
1. 4 统计分析
利用Excel 2007进行数据的整理分析及制图,以SPSS 18.0进行单因素方差分析和显著性检验。
2 结果与分析
2. 1 细菌性枯萎病菌侵染对木薯叶片Pro含量的影响
由表1可知,接种细菌性枯萎病病原菌后,发病叶片的Pro含量均高于对照,且差异均达极显著水平(P<0.01,下同),其中,苗期接种7和14 d后,接种病原菌叶片Pro含量分别较对照提高83.3%和112.5%,块根形成期接种7和14 d后,接种病原菌叶片Pro含量分别较对照提高110.2%和120.2%。可见,木薯被细菌性枯萎病菌侵染后,会刺激Pro合成,使叶片中Pro含量大幅度增加,推测木薯对细菌性枯萎病的抗性与Pro含量有密切关系。
2. 2 细菌性枯萎病菌侵染对木薯叶片MDA含量的影响
由表2可知,在苗期接种侵染7 d时,接种病原菌叶片的MDA含量较对照提高23.5%,而在苗期接种14 d时,接种病原菌叶片的MDA含量较对照降低30.9%,差异均达显著水平(P<0.05,下同)。在块根形成期接种侵染7 d,接种病原菌叶片的MDA含量与对照差异不显著(P>0.05,下同),而接种14 d时,接种病原菌叶片的MDA含量较对照显著下降17.9%。由此可见,木薯在接种后期随着细菌性枯萎病病原菌侵染时间的延长MDA合成会减少。
2. 3 细菌性枯萎病菌侵染对木薯叶片可溶性糖含量的影响
由表3可知,苗期接种后7和14 d,接种病原菌叶片的可溶性糖含量高于对照,但差异未达显著水平;块根形成期接种后7和14 d,接种病原菌叶片的可溶性糖含量低于对照,但差异也不显著。可见,细菌性枯萎病菌侵染对木薯叶片可溶性糖的合成无明显影响。
2. 4 细菌性枯萎病菌侵染对木薯叶片可溶性蛋白含量的影响
由表4可知,在苗期接种后7和14 d,接种病原菌叶片的可溶性蛋白含量均低于对照,且差异达显著水平;而在块根形成期接种后7和14 d,接种病原菌叶片的可溶性蛋白含量高于对照,其中接种后14 d两者差异显著。可见,木薯苗期遭受细菌性枯萎病菌侵染会抑制叶片可溶性蛋白的合成,而在块根形成期细菌性枯萎病菌侵染会刺激叶片可溶性蛋白的合成。
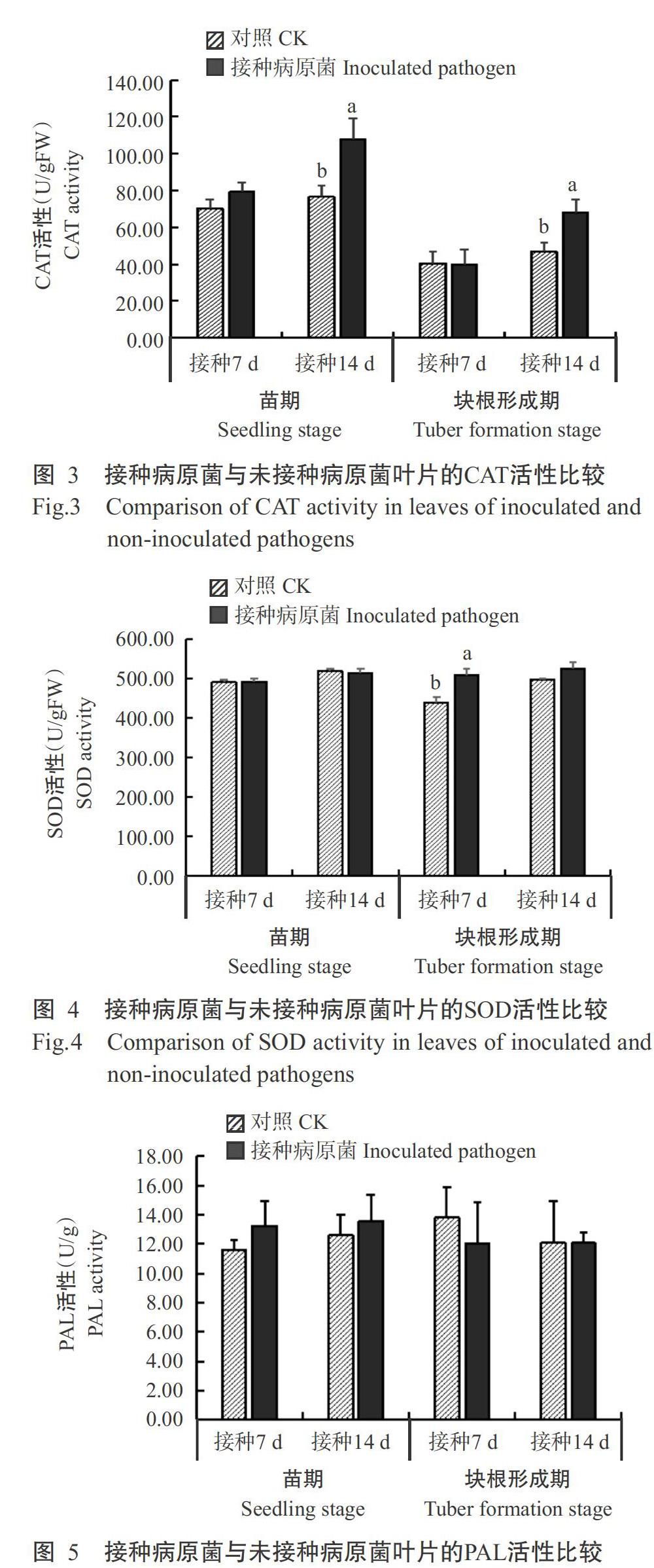
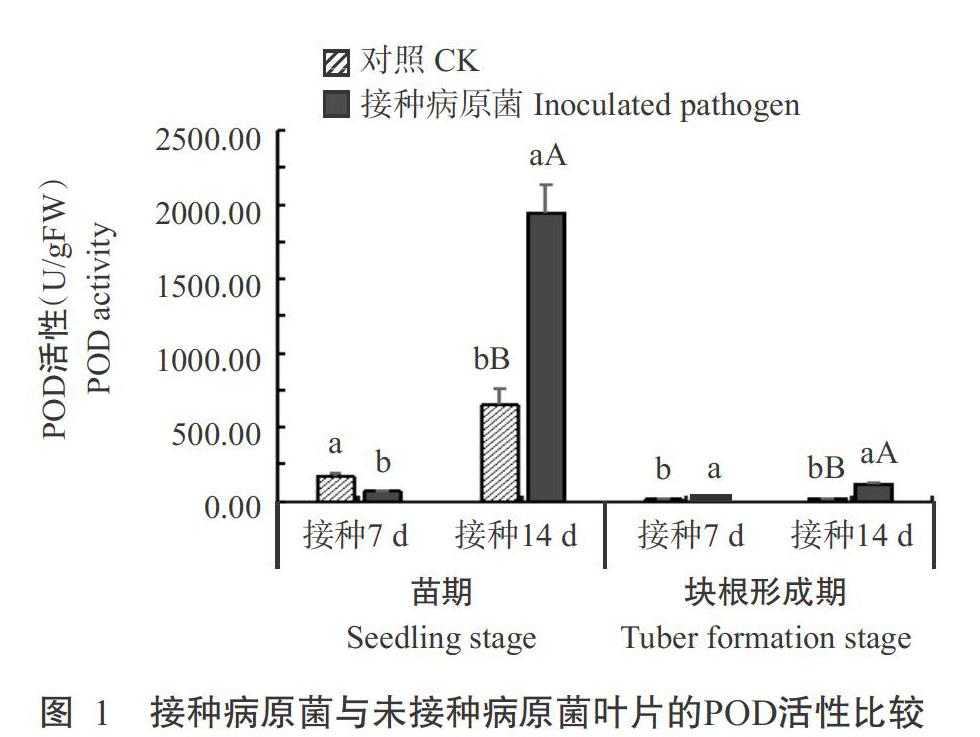
2. 5 细菌性枯萎病菌侵染对木薯叶片防御酶活性的影响
2. 5. 1 POD活性变化 由圖1可看出,在木薯苗期接种后7 d,接种病原菌叶片的POD活性低于对照,但接种后14 d接种病原菌叶片的POD活性迅速提高,较对照极显著提高66.7%。在块根形成期接种后7和14 d,接种病原菌叶片的POD活性分别比对照提高85.2%和96.4%,差异达显著或极显著水平。可见,木薯遭受细菌性枯萎病菌侵染后会刺激叶片POD活性提高,以抵御病菌的侵染。
2. 5. 2 PPO活性变化 由图2可看出,在苗期和块根形成期接种后7 d,接种病原菌叶片与对照叶片的PPO活性无显著差异;但苗期和块根形成期接种后14 d,接种病原菌叶片的PPO活性分别较对照显著提高43.1%和30.4%。可见,病原菌接种初期对木薯叶片PPO的刺激作用不明显,随着接种后时间的推移,木薯叶片PPO对病原菌侵染的反应增强,PPO活性迅速提高。
2. 5. 3 CAT活性变化 由图3可看出,在木薯苗期和块根形成期接种侵染后7 d,接种病原菌叶片的CAT活性与对照差异不显著,但接种侵染后14 d,接种病原菌叶片的CAT活性分别较对照提高31.2%和28.9%,达显著差异水平。说明接种侵染初期木薯叶片的CAT反应不强烈,但随着侵染时间的推移,木薯叶片CAT反应增强,使叶片CAT活性提高。
2. 5. 4 SOD活性变化 由图4可看出,块根形成期接种侵染后7 d,接种病原菌叶片的SOD活性显著高于对照,而其他时间点接种病原菌叶片的SOD活性均与对照无显著差异。表明木薯叶片SOD对细菌性枯萎病菌的侵染反应较迟钝,木薯对细菌性枯萎病的抗感与叶片SOD活性的关系不明显。
2. 5. 5 PAL活性变化 由图5可看出,无论是苗期还是块根形成期,接种病原菌叶片与对照的PAL活性均无显著差异。说明木薯叶片的PAL对遭受细菌性枯萎病菌侵染的响应不明显。
3 讨论
植物受到逆境胁迫时,体内系统会积累大量Pro来调节渗透压以防止细胞脱水(刘红亮和柏乐,2012)。郭红莲等(2003)利用灰斑病菌侵染6个不同抗、感性的玉米品种,发现Pro含量与品种的抗病性呈正相关。李伯凌(2017)在研究木薯抗细菌性枯萎病机制时发现,感病品种的Pro含量高于抗病品种。本研究结果显示,无论是苗期还是块根形成期,被细菌性枯萎病菌侵染后木薯叶片的Pro含量均显著提高,说明木薯遭受细菌性枯萎病菌侵染后,其叶片Pro合成量增加,以抵御病菌的侵染,叶片Pro含量与木薯抗细菌性枯萎病有密切关系。
MDA是细胞膜膜脂过氧化作用的最终产物之一,其含量可在一定程度上反映细胞膜的损坏程度和对逆境条件反应的强弱(张钰等,2008)。李伯凌(2017)研究发现,感病品种的MDA含量高于抗病品种。本研究结果发现,苗期木薯叶片受到病原菌侵染7 d后,接种病原菌处理的MDA含量高于对照,而苗期和块根形成期接种14 d的发病叶片MDA含量低于对照,说明苗期接种7 d后木薯叶片的细胞膜正受到伤害,而接种14 d后发病叶片MDA含量低于对照,可能是植物组织中各物质的互作对病原菌产生了抵抗作用,减缓了细胞膜膜脂过氧化作用,使细胞膜损害程度减轻。
可溶性糖不仅是维持植物体内渗透压平衡的碳水化合物,还是高等植物光合作用的主要产物(李赤等,2007)。但有学者发现,植物体内可溶性糖含量变化与植物抗逆性并无很明确的关系(李赤等,2007;王佳星等,2019)。本研究中,无论是苗期还是块根形成期,接种病原菌叶片的可溶性糖含量与对照均无显著差异,与李赤等(2007)研究得出的富贵竹中可溶性糖含量与抗病性无直接关系的结论相似,表明细菌性枯萎病菌侵染对木薯叶片的可溶性糖含量无直接影响。但本研究中苗期侵染后接种病原菌叶片的可溶性糖含量高于对照,而块根形成期侵染后低于对照,表明不同生育期接种病原菌对木薯叶片可溶性糖含量的影响存在一定差异,其具体原因有待进一步探究。
蛋白質是基因表达的产物之一,是所有生命活动的基础,植物生长发育过程中可溶性蛋白含量会发生变化,当植物组织受外界侵染时其可溶性蛋白含量也会有所变化(李跃建等,2003;王大平等,2006)。本研究结果表明,木薯苗期接种病原菌叶片的可溶性蛋白含量较对照呈下降趋势,但在块根形成期较对照呈上升趋势,可能是苗期接种时,蛋白质水解酶活性增强,蛋白质被降解,使得蛋白质含量降低;而块根形成期接种时,木薯叶片衰老速度减缓,蛋白质水解过程变慢,使可溶性蛋白参与到抗病的过程中。苗期和块根形成期中接种得到的可溶性蛋白含量趋势不一致,可溶性蛋白含量是否与木薯抗细菌性枯萎病有关系还需进一步研究。
在逆境胁迫或植物衰老过程中,植物体内会生成大量的自由基,而植物体内的保护酶系统会相应发生变化以抵御不良环境。POD具有代谢H2O2的功能,以H2O2为电子受体,将酚类化合物还原形成的自由基聚合物形成木质素(王荣娟等,2010)。PPO主要参与酚类氧化为醌及木质素前体的聚合作用,与植物抗病密切相关(胡瑞波和田纪春,2004)。POD和PPO在苯丙烷代谢途径中起重要作用,使植物对逆境或细胞组织衰老做出应激反应,其活性增加与植物抗病性呈正相关(张钰等,2008)。CAT和SOD也在防御酶系统里起重要作用,前者可催化H2O2分解为H2O和O2从而维持细胞膜系统的稳定性,后者可清除氧自由基(Ge et al.,2014;李伯凌,2017)。PAL是苯丙烷类代谢的关键酶和限速酶,其活性与酚类化合物的合成密切相关(黄锐,2007)。本研究结果表明,无论是苗期还是块根形成期,接种病原菌14 d后木薯叶片的POD、PPO和CAT活性均高于对照。说明病原菌与植物组织互作,相关酶机制开始启动,保护细胞不受病原菌侵害,从而起到抵抗作用。无论是苗期还是块根形成期,木薯叶片接种病原菌侵染后,发病叶的SOD活性(8月21日除外)和PAL活性多与对照无显著差异,说明SOD和PAL的作用机制相对较复杂,生理机制对其活性的影响是否能起到抗病作用还需进一步探究。
4 结论
木薯遭受细菌性枯萎病菌侵染后,叶片Pro含量升高,MDA含量降低,POD、PPO和CAT活性明显增强。表明叶片Pro和MDA含量及POD、PPO和CAT活性与木薯抗细菌性枯萎病有密切关系,这些指标可作为木薯抗细菌性枯萎病评价的生理指标。
参考文献:
岑贞陆,黄思良,任建国,谢玲,袁高庆,赖传雅. 2006. 木薯品种(组合)抗细菌性枯萎病性鉴定初报[J]. 广西农业生物科学,25(2):134-135. [Cen Z L,Huang S L,Ren J G,Xie L,Yuan G Q,Lai C Y. 2006. Preliminary report on resistance of cassava cultivars and combinations to bacterial blight[J]. Journal of Guangxi Agricultural and Biological Science,25(2):134-135.]
樊春俊,时涛,李超萍,郭涵,黄贵修. 2012. 4种防御酶在木薯—细菌性枯萎病菌反应中的活性变化[J]. 热带农业科学,32(5):31-34. [Fan C J,Shi T,Li C P,Guo H,Huang G X. 2012. Activity changes of four defensive enzymes in cassava resistant reaction to Xanthamonas axonopodis pv. manihotis[J]. Chinese Journal of Tropical Agriculture,32(5):31-34.]
郭红莲,陈捷,高增贵. 2003. 游离脯氨酸在玉米灰斑病抗性机制中作用的研究[J]. 玉米科学,11(1):83-85. [Guo H L,Chen J,Gao Z G. 2003. Study on the role of proline in resistance mechanism to gray leaf spot of corn[J]. Journal of Maize Sciences,11(1):83-85.]
胡莉莉. 2006. 香蕉抗枯萎病生理生化基础的研究[D]. 儋州:华南热带农业大学. [Hu L L. 2006. Studies on basic of physiological and biochemical resistance of banana to fusarium wilt[D]. Danzhou:South China University of Tropical Agriculture.]
胡瑞波,田纪春. 2004. 小麦多酚氧化酶研究进展[J]. 麦类作物学报,24(1):81-85. [Hu R B,Tian J C. 2004. Review on wheat polyphenol oxidase(PPO)[J]. Journal of Triticeae Crops,24(1):81-85.]
黄锐. 2007. 杂交稻及其亲本抗瘟性与几种酶活性及丙二醛含量的关系[D]. 雅安:四川农业大学. [Huang R. 2007. The relationship between blast resistance of hybrid rice or their parent and enzyme activities or MDA content[D]. Yaan:Sichuan Agricultural University.]
孔祥生,易现峰. 2008. 植物生理学实验技术[M]. 北京:中国农业出版社. [Kong X S,Yi X F. 2008. Experimental techniques in plant physiology[M]. Beijing:China Agriculture Press.]
李伯凌. 2017. 木薯抗細菌性枯萎病的生理机制研究[D]. 海口:海南大学. [Li B L. 2017. Research on the physiolo-gical mechanism of cassava resistance to bacterial blight[D]. Haikou:Hainan University.]
李赤,于莉,刘付东标,肖凌艳. 2007. 富贵竹中可溶性糖、蛋白质含量与细菌性茎腐病的关系[J]. 吉林农业大学学报,29(6):620-622. [Li C,Yu L,Liufu D B,Xiao L Y. 2007. Relation between contents of soluble sugar and protein in Dracaena sanderiana virens and bacterial stem rot[J]. Journal of Jilin Agricultural University,29(6):620-622.]
李海明,吴水金,林江波,邹晖,李跃森,戴艺民. 2019. 山苦瓜资源对枯萎病的抗性评价及理化分析[J]. 北方园艺,(5):21-26. [Li H M,Wu S J,Lin J B,Zou H,Li Y S,Dai Y M. 2019. Resistance evaluation to wilt and physiological germplasm resources of Momordica charantia[J]. Northern Hortculture,(5):21-26.]
李合生. 2000. 植物生理生化原理和技术[M]. 北京:高等教育出版社. [Li H S. 2000. Plant physiological and biochemical experimental techniques[M]. Beijing:Higher Education Press.]
李跃建,彭云良,高荣,刘世贵. 2003. 条锈菌侵染后小麦体内蛋白质的变化[J]. 西南农业学报,16(4):1-3. [Li Y J,Peng Y L,Gao R,Liu S G. 2003. Changes of protein in wheat after the infection of stripe rust disease(Puccinia striiformis)[J]. Southwest China Journal of Agricultural Scien-ces,16(4):1-3.]
刘红亮,柏乐. 2012. 不同抗病性油菜品种中脯氨酸和可溶性蛋白的动态分析[J]. 现代农业科技,(18):95-96. [Liu H L,Bai L. 2012. Dynamic analysis of proline and soluble protein in different disease resistant rape varieties[J]. Modern Agricultural Science and Technology,(18):95-96.]
刘纪霜,罗兴录,樊吴静,黄冬飞,杨鑫,曾文丹. 2013. 保水剂对土壤理化性状和木薯产量影响研究[J]. 中国农学通报,29(33):253-258. [Liu J S,Luo X L,Fan W J,Huang D F,Yang X,Zeng W D. 2013. Effects of water retai-ning agent on the physical and chemical biological character of soil and the root tubers yield of cassava[J]. Chinese Agricultural Science Bulletin,29(33):253-258.]
卢昕,李超萍,时涛,蔡吉苗,黄贵修. 2013. 国内木薯主产区细菌性枯萎病病原鉴定[J]. 广东农业科学,40(21):84-87. [Lu X,Li C P,Shi T,Cai J M,Huang G X. 2013. Pathogen identification of cassava bacterial blight from several main cultivation area in China[J]. Guangdong Agricultural Sciences,40(21):84-87.]
潘存祥. 2014. 西瓜抗枯萎病生理生化机理的研究[D]. 兰州:甘肃农业大学. [Pan C X. 2014. Research on physiological and biochemical mechanism of watermelon resistance to Fusarium wilt[D]. Lanzhou:Gansu Agricultural University.]
时涛,蔡吉苗,李超萍,陈奕鹏,李博勋,黄贵修. 2017. 7个木薯细菌性萎蔫病菌致病性相关突变体的鉴定及插入位点基因的分子分析[J]. 热带作物学报,38(9):1688-1693. [Shi T,Cai J M,Li C P,Chen Y P,Li B X,Huang G X. 2017. Identification and molecular analysis of integration flanking genesfrom seven Xanthomonas axonopodis pv. manihotis pathogenicity-related mutants[J]. Chinese Journal of Tropical Crops,38(9):1688-1693.]
王大平,曾明,朱鈞,李道高. 2006. 绿斑病藻寄生对夏橙叶片光合作用特性的影响[J]. 应用生态学报,17(6):1141-1144. [Wang D P,Zeng M,Zhu J,Li D G. 2006. Effects of Apatococcus lobatus parasitization on leaf photosynthesis characteristics of orange(Citrus cv. Olinda)[J]. Chinese Journal of Applied Ecology,17(6):1141-1144.]
王佳星,余国源,谢瑛,黄琛斐,廖飞勇. 2019. 土壤镉胁迫对紫金牛生理特性的影响[J]. 东北林业大学学报,47(5):25-29. [Wang J X,Yu G Y,Xie Y,Huang C F,Liao F Y. 2019. Effects of Cd stress on physiological characteristics of Ardisia japonica[J]. Journal of Northeast Forestry University,47(5):25-29.]
王荣娟,戚亚平,宋备舟,黄彬,王雷,姚允聪,姬谦龙. 2010. 苹果果实发酵液对草莓防御酶系活性及抗病性的影响[J]. 中国农学通报,26(16):250-255. [Wang R J,Qi Y P,Song B Z,Huang B,Wang L,Yao Y C,Ji Q L. 2010. Influences of apple fruit broth on activities of defense enzymes and disease resistance on strawberry[J]. Chinese Agricultural Science Bulletin,26(16):250-255.]
吴超,毕可可,黄华枝,何世庆. 2015. 香蕉枯萎病抗性防御酶的测定[J]. 安徽农业科学,43(3):107-109. [Wu C,Bi K K,Huang H Z,He S Q. 2015. Analysis of defensive enzymes activities of banana Fusarium wilt[J]. Journal of Anhui Agricultural Sciences,43(3):107-109.]
曾小荣,郑刚辉. 2011. 木薯主要病虫害的发生及防治[J]. 现代农业科技,(18):200. [Zeng X R,Zheng G H. 2011. Occurrence and control of main diseases and insect pests of cassava[J]. Modern Agricultural Science and Techno-logy,(18):200.]
张福平,李秋红. 2008. 温度对黄皮果实PAL、POD和PPO活性的影响[J]. 食品与发酵业,34(11):69-71. [Zhang F P,Li Q H. 2008. Effects of different storage temperatures on PAL,POD and PPO activity of wampee fruit[J]. Food and Fermentation Industries,34(11):69-71.]
张珏,吴小芹,施士争,瞿红叶. 2008. 溃疡病侵染对6个柳树无性系丙二醛及相关酶活性的影响[J]. 江苏林业科技,35(6):9-12. [Zhang J,Wu X Q,Shi S Z,Qu H Y. 2008. Effect of canker on malonaldehyde and its related enzyme activities of among the six willow clones[J]. Journal of Jiangsu Forestry Science and Technology,35(6):9-12.]
张曼. 2016. 抗香蕉枯萎病品种的抗性机理及对土壤微生物群落的影响[D]. 海口:海南大学. [Zhang M. 2016. The mechanism of disease-resistant varieties to banana Fusa-rium wilt disease and the effects on soil microbial community strucyuret[D]. Haikou:Hainan University.]
张宪政. 1992. 作物生理研究法[M]. 北京:农业出版社. [Zhang X Z. 1992. Crop physiological research method[M]. Beijing:Agriculture Press.]
Fokunang C N,Tomkins P T,Dixon A G O,Tembe E A,Salwa B,Nukenine E N,Horan L. 2001. Cyanogenic potential in food crop and its implication in cassava(Manihot esculenta Crantz)production[J]. Pakistan Journal of Biological Sciences,4(7):926-930.
Ge Y J,He X Y,Wang J F,Jiang B,Ye R H,Lin X C. 2014. Physiological and biochemical responses of Phoebe bournei seedlings to water stress and recovery[J]. Acta Phy-siologiae Plantarum,36(5):1241-1250.
Ogunjobi A A,Fagade O E,Dixon A G O,Bandyopadhyay R. 2010. Assessment of large population of cassava accessions for resistant to cassava bacterial blight infection in the screen house environment[J]. Journal of Agricultural Biotechnology and Sustainable Development,50:132-138.
(责任编辑 王 晖)
