动态演变的血清PCT、LPH对评估脓毒症患者病情及预后的临床价值
2020-08-11唐小刚梁滨琦陈治中秦文波
唐小刚,梁滨琦,黄 萍,陈治中,黄 寨△,秦文波,陆 政
广西壮族自治区人民医院:1.重症医学科;2.儿科;3.检验科,广西南宁 530001
脓毒症是重症医学科危重症患者死亡的主要原因之一[1],调查显示,在发达国家,如美国,每年有0.2‰~3.0‰的患者被诊断为脓毒症,约有1 000 000人死于脓毒症[2]。降钙素原(PCT)作为反映炎症严重程度的重要临床参数,目前已被广泛应用于临床。有研究表明,PCT可作为脓毒症的诊断性标志物之一,PCT水平的升高与疾病严重性、感染严重程度甚至病死率呈正相关。有研究发现,在感染的早期阶段,机体免疫系统被过度激活,引起“瀑布效应”和机体的细胞凋亡、免疫麻痹,是造成脓毒症的重要原因之一[3]。有研究表明,在死于脓毒症的患者体内可观察到其免疫效应细胞存在持续的感染及相应的功能障碍[2,4]。本文通过回顾性分析脓毒症患者入院时及治疗后PCT、淋巴细胞计数(LPH)的变化,探讨以上指标与脓毒症之间的关系及其评估脓毒症预后的临床价值。
1 资料与方法
1.1一般资料 根据入组标准,选取2017年1月至2018年6月本院重症医学科收治的48例重度感染患者作为研究对象,根据2016年最新脓毒症诊断标准[5]分为脓毒症组和脓毒症休克组。脓毒症组24例,其中男 15例,女 9例,平均年龄(69.25±14.44)岁;脓毒症休克组 24 例,其中男 18 例,女 6例,平均年龄(64.58±16.74)岁;2组患者性别、年龄差异无统计学意义(P>0.05),具有可比性。患者随访28 d后,根据是否发生死亡,分为存活组和死亡组。存活组40例,其中脓毒症组23例,脓毒症休克组17例;死亡组8例,其中脓毒症组1例,脓毒症休克组7例。
纳入标准:对于感染或疑似感染的患者,当脓毒症相关序贯器官衰竭(SOFA)评分较基线上升≥2分可诊断为脓毒症。由于SOFA评分操作起来比较复杂,临床上也可以使用床旁快速SOFA(qSOFA)标准诊断重症患者。qSOFA包括3个指标:呼吸频率(RR)、格拉斯哥昏迷评分(GCS评分)、收缩压(SBP)。如果符合qSOFA标准中的至少2项时,应进一步评估患者是否存在脏器功能障碍[6]。脓毒症休克为在脓毒症的基础上,出现持续性低血压,在充分容量复苏后仍需血管活性药来维持平均动脉压≥65 mm Hg及血乳酸水平>2 mmol/L[6]。排除标准:(1)年龄<18岁;(2)肿瘤;(3)急性胰腺炎,但明确无感染;(4)慢性疾病终末期;(5)器官移植;(6)免疫、血液系统疾病;(7)重度营养不良。
1.2观察指标 比较脓毒症组和脓毒症休克组患者入院时PCT、LPH、急性生理与慢性健康Ⅱ评分(APACHE-Ⅱ评分)、血小板计数(PLT)、肌酐(Cr)、乳酸之间的差异。比较存活组和死亡组入院治疗后第1、3、7天PCT和LPH之间的差异。分析PCT、LPH、APACHE-Ⅱ评分与预后转归的关系。
1.3检测方法 PCT:试剂为北京热景公司定量检测试剂盒,采用双抗体夹心免疫层析法;应用UPT-3AS型上转发光免疫分析仪测定PCT,PCT>0.5 μg/L为阳性。LPH:应用全自动五分类细胞分析仪测定LPH,LPH>3.2×109/L为阳性。

2 结 果
2.1脓毒症组和脓毒症休克组患者入院时PCT、LPH、PLT、Cr、乳酸、APACHE-Ⅱ评分比较 脓毒症休克组患者PCT、Cr、乳酸APACHE-Ⅱ评分均显著高于脓毒症组,LPH、PLT水平显著低于脓毒症组,差异有统计学意义(P<0.05)。见表1。
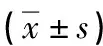
表1 脓毒症组和脓毒症休克组患者入院时PCT、LPH、PLT、Cr、乳酸、APACHE-Ⅱ评分的比较
2.2相关性分析 Pearson相关分析显示,脓毒症患者入院时PCT与APACHE-Ⅱ呈正相关(r=0.355,P<0.05),PCT与LPH呈负相关(r=-0.363,P<0.05),LPH与APACHE-Ⅱ无明显相关性(P>0.05)。
2.3死亡组与存活组患者在入院治疗第1、3、7天PCT、LPH的动态变化 死亡组患者入院治疗后第1、3、7天PCT均明显高于存活组(P<0.05),死亡组患者各时间点PCT水平不同但变化不大,差异无统计学意义(P>0.05),而存活组各时间点PCT水平呈下降趋势,差异有统计学意义(P<0.05)。死亡组患者入院治疗后第3、7天LPH均低于存活组患者(P<0.05),死亡组患者各时间点LPH水平不同但变化不大(P>0.05),存活组患者各时间点LPH水平呈上升趋势,差异有统计学意义(P<0.05)。见表2。
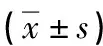
表2 死亡组与存活组患者入院治疗后第1、3、7天PCT、LPH水平比较
2.4PCT、LPH、APACHE-Ⅱ评分评估脓毒症患者28 d转归的ROC曲线分析 ROC曲线分析显示,当PCT最佳临界值为7.78 ng/mL时,PCT预测脓毒症死亡的曲线下面积(AUC)为0.956(95%CI:0.854~0.994),灵敏度为100.0%,特异度为92.5%;当APACHE-Ⅱ评分最佳临界值为35分时,预测脓毒症死亡的AUC为0.792(95%CI:0.651~0.896),灵敏度为87.5%,特异度为80.0%;当LPH最佳临界值为7.8×109/L时,预测脓毒症死亡的AUC为0.850(95%CI:0.717~0.937),灵敏度为75.0%,特异度为87.5%。
3 讨 论
脓毒症的疾病过程涉及多种组织器官,包括凝血功能异常、免疫抑制和多器官功能衰竭等。早期病原学结果是指导脓毒症诊治的导向性指标。同时,临床上SOFA评分及APACHE-Ⅱ评分能动态反映患者器官功能衰竭的程度。但由于血培养的时间限制性及SOFA、APACHE-Ⅱ相关评分项目的繁琐性,往往会增加重症监护室医生的工作负担,除了综合评估患者的临床指标,是否存在一项或多项便捷、灵敏的实验室指标来快速反映及评估脓毒症患者病情和预后成为目前脓毒症研究需解决的一项重要问题。本研究通过回顾性分析脓毒症患者入院时及治疗后PCT、LPH的变化,旨在观察以上指标与脓毒症之间的关系及其评估脓毒症预后的临床价值。
PCT是由甲状腺滤泡旁C细胞分泌的降钙素前体,是一种功能性蛋白,在人体机能运转正常、未受创伤或感染等正常情况下 PCT 不释放入血流,血液中几乎检测不到[7]。在机体受到感染、甚至蔓延至全身时,其他组织器官也释放 PCT,PCT明显升高时提示细菌感染且程度较重。而由于PCT本身的特性,病毒感染对患者血清PCT 水平无显著性影响,因此,利用此特性也可鉴别诊断细菌感染和病毒感染[4]。PCT水平与脓毒症、严重脓毒症及脓毒症休克所致的全身炎性反应的严重程度具有一定的相关性。本研究结果显示,脓毒症、脓毒症休克患者血清 PCT 水平具有显著差异。JOCHBERGER等[8]研究发现,重症监护室脓毒症患者血清PCT水平可随病情的变化而升高或减低。同时,也有研究显示,尽管进行了适当的临床干预,但预后不佳的患者仍可观察到PCT水平持续增高[9]。因此,PCT的趋势变化可能比诊断时单个测量值具有更大的指导意义[10]。本研究结果显示,存活组患者各时间点PCT水平呈下降趋势,提示PCT水平随疾病好转而减低,而死亡组患者各时间点PCT均显著高于存活组,且PCT水平无明显动态变化。一项荟萃分析结果显示,动态测量PCT与患者临床症状相结合有助于预后风险的评估[11]。本研究结果还发现,入院时PCT与APACHE-Ⅱ呈正相关,PCT对脓毒症患者28 d内转归有一定的预测价值。以上均证实PCT能够指导判断患者感染的严重程度,提示长期高水平的PCT可能预示患者预后不良。此外,脓毒症诊治最新指南也指出,诊断脓毒症之后应尽快(第1个小时内)使用抗菌药物治疗。一些关于以PCT为导向指导抗菌药物管理的临床试验提示,PCT可作为减少或停止使用抗菌药物的生物标志物,为临床决策提供一定的帮助[12-13]。有研究显示,PCT指导组接受的抗菌药物治疗天数明显少于对照组,但 PCT指导组的28 d内死亡率并不低于对照组[14]。随后的多项研究也提示,PCT指导抗菌药物治疗可缩短使用抗菌药物的持续时间,但与对照组相比具有相似的死亡率和复发感染率[15-16]。以上得出,PCT可监测感染进展程度,同时可帮助制订抗菌药物使用的持续时间[17],有利于指导脓毒症抗菌药物管理,从而减少抗菌药物的过度使用,降低不良反应的风险并控制新出现的细菌多重耐药性[18]。但在临床实践中,还必须仔细评估PCT检测的质量及结合目标患者群体的实际情况。因此,仍需进一步的研究来更准确地评价PCT在重症监护室脓毒症抗菌药物管理中的作用,从而限制并减少重症监护室内非必须的抗菌药物使用。
淋巴细胞是人体主要的免疫活性细胞,包括B淋巴细胞和T淋巴细胞,以及少数自然杀伤细胞(NK细胞)等,观察LPH变化有助于了解机体的免疫功能状态。近年来的研究发现,机体的免疫反应在脓毒症的进展过程中起着至关重要的作用[19]。在脓毒症的初始阶段,以大量分泌炎症介质为主要特征,促炎反应占主要地位,机体释放大量促炎因子,包括肿瘤坏死因子(TNF)-α、肿瘤坏死因子γ、白细胞介素33 和白细胞介素2[20]。随着脓毒症的进展,机体可能经历了一个免疫抑制阶段,使机体处在更易发生感染的环境,甚至导致多器官功能障碍综合征及死亡的发生[21]。有研究发现,死亡脓毒症患者体内存在明显的低淋巴细胞血症[22]。一些有关尸检的研究显示,在死于脓毒症的患者体内可观察到其免疫效应细胞存在持续的感染灶及相应的功能障碍[23],其机制可能是:当机体遭受到疾病打击时,Fas及其配体FasL基因发生调节紊乱引发细胞免疫信号的异常,导致体内淋巴细胞数量下降、比例失衡及功能障碍[24]。临床实践中大量的观察性研究也表明,脓毒症引起的持续性LPH减少提示脓毒症患者的不良预后,包括更高的死亡率和感染风险[22,25-26]。在本研究中,死亡组患者入院治疗后第3、7天LPH均较存活组明显下降,经治疗后存活组患者的LPH逐渐恢复甚至有升高趋势,而死亡组患者的LPH则无明显改变。尽管本研究在死亡组患者未能观察到LPH持续、明显减少的过程,但各时间点LPH水平无明显动态改变仍提示体内可能存在LPH生成不足及缓慢消耗的过程。本研究虽然未发现入院时LPH与APACHE-Ⅱ有一定的相关性,但脓毒症患者入院时低水平的LPH仍提示可能存在不良的临床结果,这与以往大多研究一致[25-26]。因而,监测 LPH变化可能在一定程度上反映脓毒症患者机体免疫应答的阶段,为评估机体免疫功能状态及免疫应答强度提供一定的临床依据。
综上所述,PCT、LPH均可用于临床上判断重症患者的感染严重程度,还能够及时反映脓毒症患者的病情变化趋势,动态监测PCT、LPH水平可有助于评估患者的预后,也可在一定程度上实时反映治疗措施对目前感染控制的有效程度。本研究经Pearson相关分析显示,脓毒症患者PCT与LPH呈负相关,推测PCT释放入血后可能参与调控脓毒症患者体内免疫应答反应,两者可能呈此消彼长的关系,但两者之间的研究仍需设计相关实验进一步探讨。本研究亦存在不足之处:本研究为回顾性研究,且为单中心,样本量有限,后期需通过多中心合作,增加样本量等方法来进一步验证研究结论,同时,需寻找其他临床指标,以期通过多指标的联合应用来提高预测脓毒症转归的准确性。
