白藜芦醇通过减弱线粒体损伤对高同型半胱氨酸血症大鼠所致心脏损伤的保护作用
2020-08-11付建平王雪张羽徐彬张慧晶郑群
付建平 王雪 张羽 徐彬 张慧晶 郑群
(哈励逊国际和平医院 1心内科,河北 衡水 053000;2制剂室;3科教科)
心肌细胞的凋亡与多种心血管疾病的病理进展相关,如冠状动脉粥样硬化心脏病、心力衰竭和糖尿病心肌病〔1,2〕。高同型半胱氨酸血症(HHcy),即血清中同型半胱氨酸(Hcy)浓度升高,是通过促进心肌损伤构成心血管疾病的一个新的独立危险因素,与心血管疾病的发生发展密切相关〔3〕。Hcy每升高5 μmol/L,心肌梗死的危险度就增加3~4倍〔4〕。高Hcy患者与冠心病的发病也呈正相关性〔5〕。研究发现,Hcy可能通过诱导细胞程序性死亡和氧化应激引起心肌细胞功能障碍〔6〕。氧化应激可进一步增加活性氧(ROS)的生成,加重心血管疾病的发展。心肌细胞因其工作特性,氧消耗相对较大,含有更多的线粒体,而氧化应激和ROS生成都在线粒体中完成,所以当心肌细胞的线粒体功能受到损伤后更易于发生氧化应激。白藜芦醇(RSV)是一种天然多酚化合物,目前被认为是最强的去乙酰化酶(SIRT)1激活剂之一,具有抗炎、抗氧化、抗肿瘤和调节葡萄糖/脂质代谢等生物学功能〔7〕。RSV可通过上调SIRT1促进线粒体生物合成功能减轻线粒体损伤〔8〕。然而RSV是否能通过保护心肌细胞线粒体功能逆转Hcy对心肌细胞的损伤目前还没有报道。本研究通过建立HHcy模型和选取新生大鼠心肌细胞作为研究对象,在体内外探讨RSV对HHcy心肌细胞的保护作用。
1 材料和方法
1.1实验试剂 苏木素-伊红(HE)染料、戊巴比妥钠、磷酸盐缓冲液(PBS)、免疫放射沉淀法(RIPA)裂解液、二喹啉甲酸(BCA)试剂盒和线粒体蛋白提取试剂盒购自中国碧云天生物科研公司;RSV购自中国伊奥生物科技有限公司;TUNEL试剂盒购自美国罗氏公司;同型免疫球蛋白(Ig)G二抗和Triton X-100购自美国Invitrogen公司;5%牛血清白蛋白购自美国Sigma公司;凋亡相关因子(NOX)4、细胞色素C、半胱氨酸-天冬氨酸蛋白酶(Caspase)-3和GAPDH抗体及辣根过氧化物酶(HRP)标记的二抗购自美国Cell Signaling Technology公司;Mitotracker试剂盒和JC-1试剂盒购自美国Abcam公司。
1.2HHcy模型的建立和实验分组 选取18只体重250~280 g健康成年Wistar大鼠随机分为对照组、HHcy组和HHcy+RSV组各6只,均自由进食。HHcy组大鼠予以溶解在2.5%淀粉的2 g/(kg·d)的L-蛋氨酸温水溶液灌胃,对照组予以同等剂量的2.5%淀粉灌胃处理。L-蛋氨酸灌胃后,每周测量血清总Hcy水平,超过16.0 mmol/L时可认为HHcy。连续灌胃8 w后测量血清Hcy浓度超过16.0 mmol/L,提示HHcy造模成功。而HHcy+RSV组在HHcy组基础上每天腹腔注射浓度为80 mmol/L的RSV。
1.3超声心动图对心功能的分析 采用超声心动图系统(VIVID710S,GE公司,美国)评估大鼠心脏功能。通过腹腔注射0.3 ml/100 g的10%水合氯醛麻醉下对自主呼吸的大鼠进行超声心动图检查。测量收缩末期容积(ESV)、收缩分数(FS)、射血分数(EF)、早期跨室舒张峰值流速(E)和早期舒张峰值组织速度(E′)。计算E与E′的比值来分析心脏舒张功能。所有参数代表6个连续心动周期的平均值。
1.4组织形态学分析 处死大鼠,把左心室的心脏组织固定于4%多聚甲醛并包埋在石蜡中进行组织学研究。石蜡包埋组织被切成约5 μm厚的切片,分别予以HE和Masson染色,在荧光显微镜(IX71,Olympus公司,日本)下观察心脏形态学变化。
1.5TUNEL法检测细胞凋亡 按照细胞凋亡检测试剂盒说明书步骤对心肌组织进行染色并在荧光显微镜下观察,凋亡细胞的百分比计算为TUNEL染色阳性细胞与细胞总数的比率。
1.6Western印迹检测蛋白表达水平 把取自各组的心肌细胞接种于细胞培养皿中,利用线粒体蛋白试剂盒萃取线粒体蛋白和细胞质蛋白。然后采用BCA法将各组蛋白样品定量至相同浓度后,取20 μg样品蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜和封闭。封闭后以1∶1 000的稀释比例孵育一抗[NOX4,细胞色素(Cyt)C,Caspase-3和GAPDH抗体],4℃过夜。次日用TBST洗涤后室温孵育相应的HRP标记的二抗1 h,再次洗涤,最后采用电化学发光成像仪显影。
1.7透射电镜观察线粒体形态 样品细胞通过乙酸铀酰和柠檬酸铅染色后制成切片,并用透射电子显微镜(Hitachi H-7650,日立公司,日本)对细胞线粒体形态进行观察。显微照片以2×104放大倍数拍摄。
1.8荧光共聚焦显微镜 把各组的样品细胞接种在细胞培养皿中并用PBS洗涤3次。根据TUNEL、Mitotracker和JC-1试剂盒中各自说明书对样品细胞进行染色孵育和4%多聚甲醛固定。最后在荧光共聚焦显微镜(FV3000,Olympus公司,日本)下对细胞荧光位置和荧光强度进行观察分析。
1.9统计学方法 采用Graphpad Prism软件进行正态分布和方差齐性检验、t检验和单因素方差分析。
2 结 果
2.1RSV对HHcy大鼠心功能的影响 HHcy组ESV和E/E′较对照组明显升高(P<0.01),而FS和EF较对照组显著降低(P<0.05)。HHcy+RSV组ESV和E/E′较HHcy组显著降低,而FS和EF则较HHcy组显著升高(均P<0.05)。见表1。

表1 各组心功能指标、NOX4、CytC、Caspase-3蛋白表达及线粒体检测相对强度及线粒体膜电位比值比较
2.2RSV减少HHcy对心脏组织的损伤作用 如图1显示,HHcy组心脏组织中的心肌细胞数量较对照组明显减少,并伴有心肌纤维化。HHcy组心肌细胞凋亡〔(14.0±2.5)%〕较对照组〔(1.8±0.6)%〕显著增加(P<0.001)。HHcy+RSV组心肌细胞数量较HHcy组明显增加,心肌纤维化程度较HHcy组降低,伴心肌细胞凋亡数量的显著减少〔(5.0±2.1)%,P<0.01〕。见图1。

图1 HHcy对心脏损伤程度的影响(×200)
2.3RSV通过减轻HHcy导致线粒体损害发挥抗凋亡作用 HHcy组的心肌细胞的线粒体NOX4蛋白含量明显高于对照组(P<0.05),伴随下游的CytC和Caspase-3的蛋白含量显著升高(P<0.05),提示HHcy可能通过升高线粒体NOX4蛋白,使更多的CytC蛋白渗漏到细胞质中,最终使细胞质Caspase-3表达明显升高,发挥促凋亡作用。而HHcy+RSV组NOX4-CytC-Caspase-3通路活性较HHcy组显著降低。见图2、表1。HHcy组细胞的线粒体体积明显增大,线粒体结构损害严重,而HHcy+RSV组细胞线粒体体积显著减少,线粒体结构相对正常。见图3。
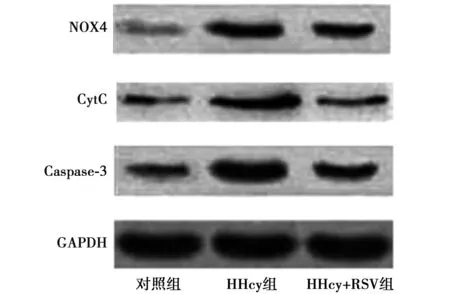
图2 Western印迹检测各组NOX4、CytC、Caspase-3蛋白表达

图3 透射电子显微镜中线粒体图像(×20 000)
2.4RSV抑制HHcy的促凋亡作用 如图4所示,与对照组〔(8.2±5.4)%〕比较,HHcy组心肌细胞凋亡数量〔(59.1±4.8)%〕显著增多(P<0.001),HHcy+RSV组心肌细胞的促凋亡作用明显减弱,心肌细胞凋亡数量〔(25.4±5.3)%〕较HHcy组显著减少(P<0.01)。

图4 RSV抑制高同型半胱氨酸对心肌细胞的促凋亡作用(×400)
2.5RSV逆转HHcy的心肌细胞线粒体膜电位抑制作用 与对照组比较,HHcy组的心肌细胞的Mitotracker红色荧光显著减弱,提示线粒体膜电位明显下降(P<0.001)。HHcy组心肌细胞的JC-1不能聚集在线粒体基质中,提示为JC-1单体 (显示为绿色荧光),HHcy组心肌细胞的线粒体膜电位明显降低(P<0.001)。HHcy+RSV组Mitotracker和JC-1荧光显微镜下均观察到线粒体膜电位的升高,显著高于HHcy组(P<0.01)。见图5、图6、表1。
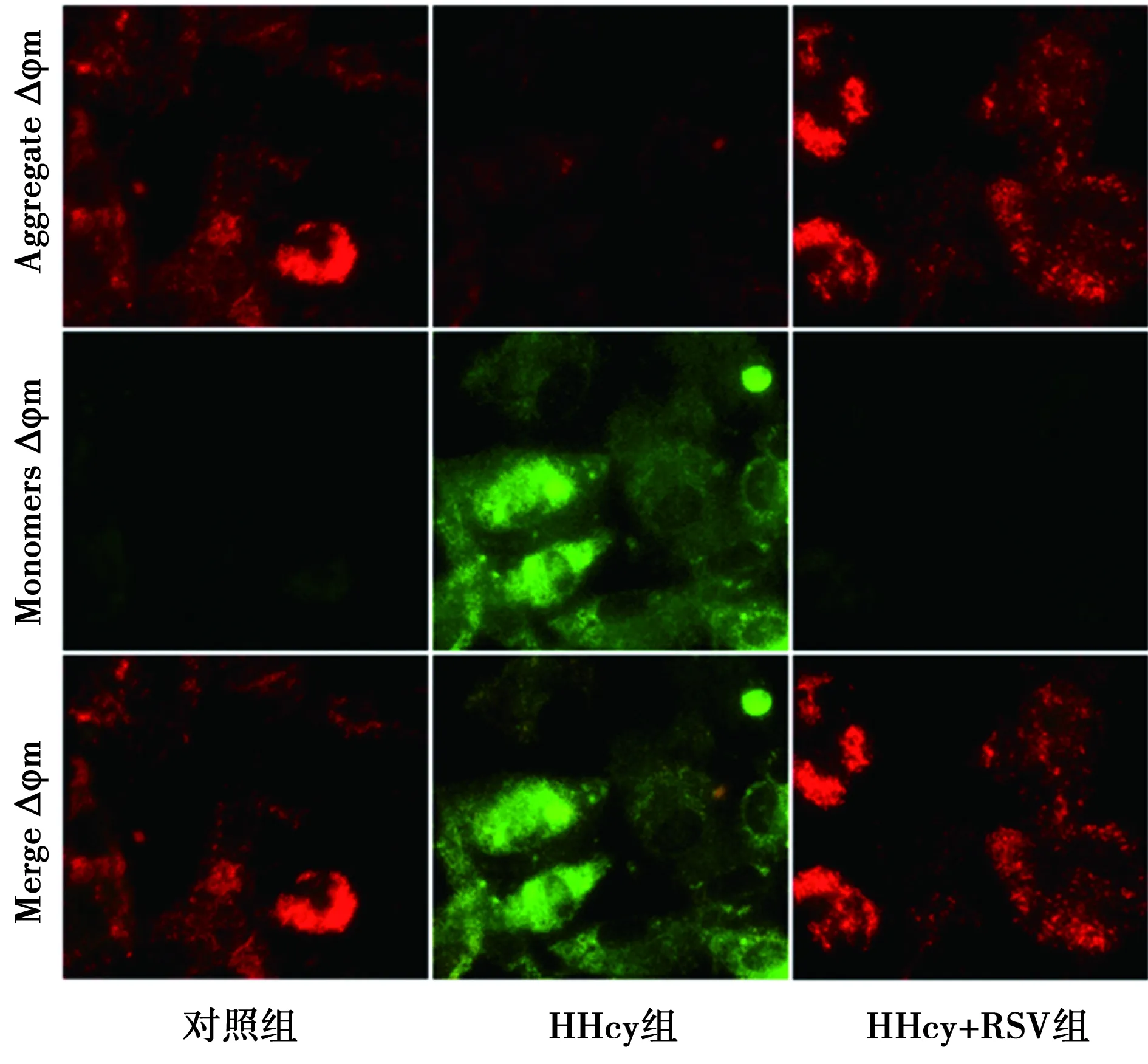
图6 RSV升高HHcy导致的心肌细胞低线粒体膜电位(×400)
3 讨 论
流行病学研究表明,血清Hcy浓度升高与心血管疾病的风险增加有关,且与经典的心血管危险因素无关〔3〕。研究表明HHcy参与心肌损伤的主要机制包括通过内质网应激增加ROS的形成和细胞凋亡〔9〕。ROS的增加可能导致线粒体解耦联,引起HHcy时心肌细胞能量代谢的破坏〔10〕。有研究结果发现线粒体ROS的产生局限于线粒体复合物Ⅰ和Ⅲ〔11〕,而另外有研究表明Hcy诱导的ROS的增加与烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶相关,而且NOX4表达升高可能在Hcy引起的线粒体相关凋亡机制中占有重要作用〔12〕。线粒体NOX4是最普遍的氧化酶之一,也是许多细胞类型和组织中ROS的主要来源〔13〕。然而,对于HHcy介导的线粒体损伤的具体机制却知之甚少。本研究发现HHcy的心肌细胞中线粒体NOX4表达明显升高,增加线粒体细胞色素C向细胞质的渗漏,激活下游的Caspase-3引起细胞凋亡反应。另外,HHcy还可通过降低心肌细胞线粒体膜电位作用破坏线粒体的结构和功能,进一步加重心肌细胞的凋亡。表明Hcy诱导的心肌细胞凋亡可能与心肌细胞NOX4升高和线粒体膜电位下降相关。
近年来对RSV的研究日益增多,发现其具有多种的药理作用,主要包括抗氧化、抗炎、细胞保护、抗肿瘤和调节物质代谢等。被应用治疗多种疾病,如心血管疾病、神经系统疾病、内分泌疾病和肿瘤等〔14~17〕。然而关于RSV介导的心肌线粒体保护在HHcy心肌损伤中的作用却未有相关研究报道。本研究发现RSV通过减轻HHcy对心肌细胞线粒体膜电位的抑制作用,减少线粒体中NOX4的表达,减轻线粒体细胞色素C的渗漏,最后抑制下游Caspase级联反应,减少心肌细胞的凋亡,在一定程度上逆转HHcy对心肌细胞的损伤作用。
尽管线粒体是氧化反应的中心,但线粒体相关的凋亡通路不是细胞损伤的唯一途径。还有其他的凋亡途径,如Caspase-8依赖性死亡受体途径和Caspase-12相关内质网反应通路参与细胞死亡和氧化应激损伤进展〔18,19〕。然而,这些相关机制是否在HHcy介导心肌细胞凋亡中起作用仍不清楚,需要开展相关的实验进一步探讨和证明。
综上,HHcy通过升高线粒体氧化酶NOX4表达,增加线粒体细胞色素C向细胞质的渗透,激活下游的Caspase凋亡通路,促进心肌细胞的凋亡。此外HHcy能通过降低心肌细胞线粒体膜电位,增加线粒体膜通透性,进一步加重心肌细胞的损伤。而RSV通过抑制上述两方面的损伤作用在一定程度上逆转HHcy对心肌细胞的损伤作用,对心肌细胞发挥保护作用,为其未来临床应用提供理论依据。
