不同干制温度与时间对槟榔果皮挥发性成分的影响
2020-08-11袁源刘洋洋龚霄周伟李积华
袁源,刘洋洋,龚霄,周伟,李积华,*
(1.中国热带农业科学院农产品加工研究所农业农村部热带作物产品加工重点实验室,广东湛江524001;2.海南省果蔬贮藏与加工重点实验室,广东湛江524001)
槟榔(Areca catechu L.),为棕榈科槟榔属常绿乔木槟榔的果实。别名槟榔子、大腹子、橄榄子、青仔等,有“洗瘴丹”之称,在我国主要分布于海南省。其用途广泛,主要用于食用,在亚洲的许多地区,均有嚼食槟榔的习惯[1-2]。槟榔主要食用部位是槟榔果皮(pericarpium arecae,PA),约占果实三分之二以上的重量,又名大腹皮、槟榔衣、槟榔壳等[3-4]。作为理气药,挥发性成分是槟榔果皮中主要活性成分。挥发性化合物是评价中药理气药质量的重要指标之一,挥发性成分不仅作为其药理基础,还直接影响加工品的感官品质[5]。
由于植物挥发性组分非常复杂,无法逐个组分采用标准物质进行对比鉴定,而且各仪器性能和分离柱的柱效差异明显,组分分离效果大有不同,这对质谱产生许多干扰因素,而且其中的同分异构体化合物因结构相似,质谱图差别小。因此,仅选用质谱检索高匹配度来确定相应峰组分的化学结构存在极大不确定性。保留指数(retention index,RI)是化学物质在相应类型分离柱中对应正烷烃的一种比较稳定的性质。只要用于分离的色谱柱性质相同,色谱条件相近,同组分在不同仪器上所得RI值通常为常数。因此,同时考虑质谱匹配度和RI匹配度可极大提高鉴定准确性。在挥发性复杂组分鉴定中,该方法在国际上得到普遍认可并大量使用[6-8]。
以往涉及槟榔果皮挥发性成分的研究,仅仅使用质谱检索进行简单定性以及面积归一化法进行简单相对定量[9-10],为了更客观的评价干制温度与时间对槟榔果皮挥发性成分的影响,本研究采用顶空固相微萃取-气质联用技术(headspace-solid phase micro extraction-gas chromatography-mass spectrometry,HS-SPMEGC-MS)结合保留指数RI进行分析,为其进一步开发利用提供参考依据。
1 材料与仪器、试剂
1.1 试验材料
槟榔青果:广东省湛江市越泰试剂仪器公司采购,经除杂、洗净、除核留皮备用。原植物标本经中国热带农业科学院农产品加工研究所李积华研究员鉴定确认为棕榈科植物槟榔(Areca catechu L.)。
1.2 仪器与试剂
GCMS QP2010-Plus气相色谱-质谱联用仪、AOC-5000三合一自动进样器、GCMS Real Time Analysis色谱工作站:日本岛津公司;SPME萃取头divinylbenzene-carboxen-polydimethylsiloxane(DVB/CAR/PDMS)(50/30 μm):美国 Supelco公司。
α-蒎烯标准品、正己烷、甲醇(均为色谱级):德国Sigma公司;正构烷烃(C7~C30)标准品:美国 Supelco公司。其余试剂均为分析纯。
2 试验方法
2.1 槟榔果皮样品的制备
同批槟榔果皮分为5个部分,一部分(50 g)为不做任何处理的鲜品(A),粉碎备用;余下4部分(各50 g)分别经 40℃,6 h(B)、60℃,4 h(C)、80℃,2 h(D)、100℃,1 h(E)烘干至水分低于10%,粉碎备用。
2.2 固相微萃取条件
萃取头在使用前,预老化1 h。分别称取A 4.0 g,B~E 1.0 g,分别加入内标溶液(α-蒎烯 900 μg/mL)100 μL置于20 mL顶空进样瓶中。首先将进样瓶放置在90℃温度控制搅拌器中以250 r/min转速动态平衡10 min;再在上述条件下将萃取头插入进样瓶动态萃取20min;然后GC-MS进样,解吸温度250℃,解吸时间5 min,平行进样3次。
2.3 GC-MS条件
GC条件为色谱柱:Rtx-5ms毛细管色谱柱(30 m×0.25 mm,0.25 μm);升温程序:70 ℃保持 2 min,以10℃/min升至130℃,保持2 min,再以15℃/min升至280℃,保持 2 min;进样口温度 280℃;载气(He)流速1 mL/min;压力57.4 kPa;不分流进样。
MS条件为电子轰击(EI)离子源;离子源温度230℃;接口温度280℃;溶剂延迟3 min;数据采集方式Scan;质量扫描范围m/z 35~550;检测器增益电压1.34 kV。
2.4 挥发性成分的定性与定量分析
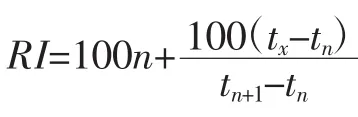
式中:RI为被分析组分的保留指数;tx为被分析组分流出峰的保留时间,min;tn为碳原子数为n的正构烷烃流出峰的保留时间,min;tn+1为碳原子数为n+1的正烷烃流出峰的保留时间,min;tn<tx<tn+1。所得 RI值与文献对应物质的保留指数相比较进行定性分析。
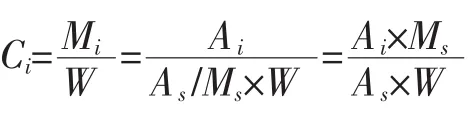
式中:Ci为每个有效挥发性成分的相对含量,μg/g;Mi为待测物的质量,μg;W 为样品的去水干重,g;Ai和As分别为待测物和内标物的峰面积;ms为加入内标物的质量,μg。
对每一个有效挥发性成分的相对含量进行数据处理。采用分析软件IBM SPSS Statistics 21进行方差分析(ANOVA)和邓肯多重比较法(Duncan′s Multiple Range Test)在p=0.05的水平下进行检验,结果以相对含量(平均值±标准误)表示。
3 结果与分析
3.1 槟榔果皮干制后的挥发性成分定性分析
图1表示的是槟榔果皮经烘干后的挥发性成分的HS-SPME-GC-MS检测总离子流图。

图1 烘干槟榔果皮的挥发性成分GC-MS总离子流图Fig.1 GC-MS total ion chromatogram of the volatile components in dried PA
图中数字标注的色谱峰为经过质谱谱库相似度匹配检索和保留指数计算得到槟榔果皮的典型挥发性成分,与表1中列出的化合物一一对应。所有这23种典型挥发性成分均先经谱库检索,相似度大于88%,包括12种酯类、4种有机酸类、2种醛类、2种醇类、2种生物碱类和1种酮类,然后计算出每一种物质的保留指数,并且与文献中极性相似的色谱柱分离得到相同物质的保留数值进行比对,由于样品测试条件差异,因此试验值与文献值存在少许差异[11]。
3.2 槟榔果皮不同温度时间干制后挥发性成分定量分析
表1列出了槟榔果皮经不同温度和时间干制至水分含量低于10%后,挥发性成分的相对含量的比较。
随着干制温度升高和时间增长,挥发性成分的总含量呈递减的趋势,相对含量由1 128.46 μg/g降至730.82 μg/g~751.97 μg/g,中温长时(C)、中高温中时(D)和高温短时(E)所得挥发性成分含量间无显著性差异,均对槟榔果皮挥发性成分有明显影响。
3.2.1 酯类物质
酯类物质占槟榔果皮挥发性成分种类一半以上,相对含量占总体挥发性成分含量近半(51.55%)。周大鹏等[12]报道槟榔青果皮中的主要成分是醛类;与本次试验挥发性成分研究有所差别,其差别的主要原因有可能是选取的材料产地、成熟度不同等;胡延喜等[13]报道槟榔果皮挥发油中主要成分是有机酸类和酯类化合物,本次试验挥发性成分研究部分与此吻合,但由
于挥发性成分提取方式的不同,因此挥发性化合物种类与含量存在较大差异。C、D、E 3组的酯类总相对含量,显著低于A、B两组,组间无显著差异;A、B两组差异显著,各组挥发性酯类化合物总体趋势与总挥发性成分含量趋势相同。槟榔果皮中的大部分挥发性酯类物质含量随干制温度的上升呈下降趋势,随着温度的升高,部分酯类物质如反式油酸乙酯(21)、亚麻酸乙酯(22)等物质甚至低于响应无法检出;然而1-甲基-1,2,5,6-四氢吡啶-3-羧酸甲酯(5)的相对含量呈现随温度升高而升高的趋势,该化合物是槟榔碱(学名N-甲基-2,5,6-三氢吡啶-3-甲酸甲酯)的一种衍生物[14],可能由高温下槟榔碱受热后所得;以及亚油酸乙酯(20)呈现随加热时间增加而降低的趋势。
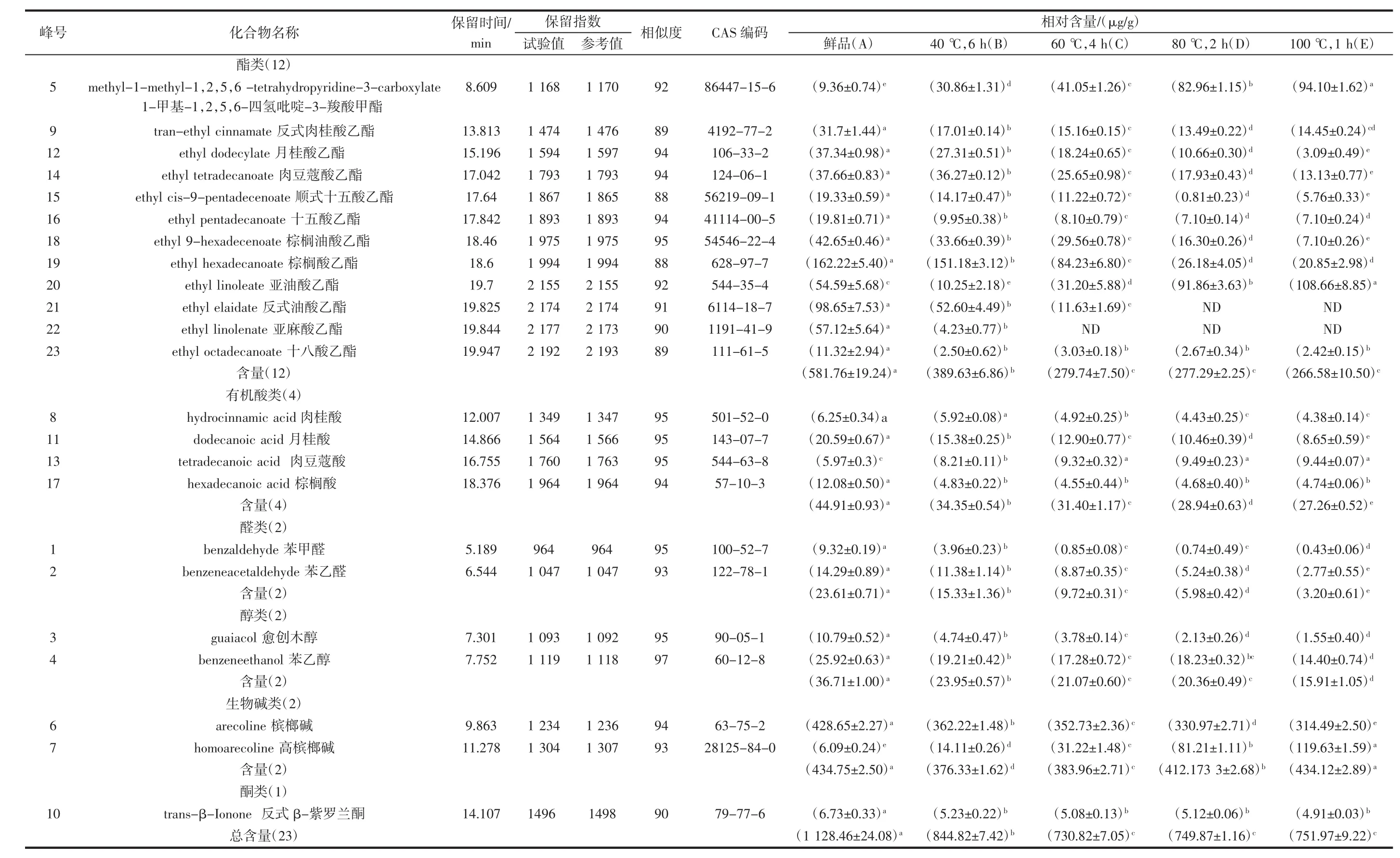
表1 干制槟榔果皮挥发性成分的定性鉴定结果及其相对含量Table1 Chemical content identified in the volatile components of dried PA
3.2.2 有机酸类物质
有机酸类物质各组之间差异显著,总有机酸类化合物含量随干制温度的上升呈下降趋势。张海德等[15]报道槟榔中含量较高的有机酸为肉豆蔻酸、油酸、亚油酸、棕榈酸、月桂酸,本次试验挥发性成分研究部分相似,可能由于提取方式不同,种类存在一定差异。其中苯丙酸(8)和月桂酸(11)含量变化趋势与总有机酸类趋势相同,差异显著;肉豆蔻酸(13)的相对含量呈现随温度升高而升高的趋势,但在60℃以后的含量差异不显著;棕榈酸(17)的相对含量呈现受热即降低的现象,但组间差异不显著。
3.2.3 醛类和醇类物质
醛类和醇类物质各组总含量和单物质含量之间差异显著,均呈现随干制温度上升而含量下降的趋势。
3.2.4 生物碱类物质
目前生物碱类物质被认为是槟榔主要生理活性成分,主要为槟榔碱等。何晓燕等[16]报道加热对槟榔碱含量影响较大,加热时间越长,槟榔碱下降越多,本研究中所测得的槟榔碱(6)相对含量随着加热温度升高而下降,这与文献“经火无力”、“急治生用、缓治略炒”[17]一致。在本研究中所测得的生物碱类挥发性物质中除槟榔碱外还能检测出高槟榔碱,然而大部分文献并未对高槟榔碱等其它次要生物碱进行报道。本研究中所测得的高槟榔碱(7)相对含量随干制温度升高而升高,高槟榔碱(C9H15NO2)较槟榔碱(C8H13NO2)多一个甲基,可能由于随着温度升高,槟榔碱发生甲基化的高温转化反应,需要进一步试验进行验证。李凯悦等[18]报道通过固态反应模型高温时美拉德反应会抑制槟榔碱的去甲基化,温度足够高时有可能促进槟榔碱的甲基化。挥发性生物碱类物质总相对含量呈现的是加热时间越长含量下降的趋势,鲜组(A)和高温短时组(E)间无显著性差异,与其他3组组间差异性显著。
3.2.5 酮类物质
各干制组与鲜组酮类物质呈显著性差异,但各干制组组间差异不显著,加热温度和时间对此类挥发性酮类物质均有影响,但影响不呈线性相关。
4 结论
顶空-固相微萃取(HS-SPME)作为一种目前较为先进的在线前处理技术,集采样、萃取、富集、进样为一体,对挥发性类物质有较好的收集,且无需溶剂提取,符合当前绿色环保、快捷迅速的检测发展方向。与气质联用(GC-MS)结合使用能够实时在线对食品加工过程中品质和工艺进行监测,对药品处理过程中活性物质和工艺进行跟踪。本研究通过在不同干制温度下研究槟榔果皮的挥发性物质,采用气质联用的谱库检索相似度结合保留指数定性分析,该方法误差小,能实现对槟榔果皮挥发性未知物质的准确定性,弥补常规气质联用谱库检索定性方法的不足,提高分析准确性,使定性结果更加客观和可靠。
本研究中,通过鉴定得到23种典型的挥发性物质,较以往的文献能更准确的定性,包括12种酯类、4种有机酸类、2种醛类、2种醇类、2种生物碱类和1种酮类,这些挥发性物质赋予了槟榔果皮作为理气药的药理特性。作为理气药,干制时间对槟榔果皮的相对影响要远小于干制温度,因此在后续深入研究槟榔果皮的各种干制工艺中,应考虑较低温的工艺,因此,通过对槟榔果皮干制品挥发性物质的准确定性与相对定量,有利于对工艺整体进行评价和判断,并为其进一步开发利用提供理论基础。
