山药交联淀粉的制备与表征
2020-08-11刘燕王璐颖郑晓卫王向红孙纪录
刘燕,王璐颖,郑晓卫,王向红,孙纪录,*
(1.河北农业大学食品科技学院,河北保定071001;2.中粮营养健康研究院有限公司营养健康与食品安全重点实验室,北京102209)
山药在世界上是排在木薯、马铃薯和甘薯之后的第四主要的薯类[1],在中国许多地区种植发展迅速[2]。山药营养丰富,含有淀粉、蛋白质、氨基酸等营养素[3],以及许多生物活性成分,如黏蛋白、薯蓣皂甙、尿囊素、胆碱、植物甾醇、低聚糖等[4]。
抗性淀粉(resistant starch,RS)是一类在人体小肠中不能被消化而在大肠中被微生物发酵的淀粉[5]。抗性淀粉有利于抑制腐败菌的生长并增加益生菌的数量[6],降低肠道的pH值,有益肠道健康,减少结肠癌;有助于控制餐后血糖、体重及平衡能量[7-8]。近年来,还发现抗性淀粉能够显著影响肠道菌群的多样性[9-10]。
山药原淀粉中抗性淀粉含量较低。为了提高抗性淀粉含量,可以对原淀粉进行改性。在淀粉改性的不同方法中,化学方法较为常见。交联淀粉是一种重要的化学改性淀粉,其中,淀粉的醇羟基与交联剂的多元官能团形成醚键或酯键。我国淀粉种类多,但目前国内对淀粉改性的研究主要限于玉米淀粉、马铃薯淀粉、木薯淀粉等,对山药淀粉的研究很少。因此,本文拟采用交联化学法处理山药淀粉,优化交联淀粉制备工艺,提高抗性淀粉得率,并系统分析所得交联淀粉的理化性质、稳定性与结构特性,为其在食品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
山药:棒药,产自河北保定蠡县。
三偏磷酸钠(分析纯):阿拉丁试剂(上海)有限公司;三聚磷酸钠(分析纯):天津市科密欧化学试剂开发中心;淀粉葡萄糖苷酶(100 000 U/g)、α-淀粉酶(3 700 U/g):北京索莱宝科技有限公司;猪胰腺α-淀粉酶(13 U/g):上海源叶生物科技有限公司;3,5-二硝基水杨酸(分析纯):上海尚宝生物科技有限公司。
1.2 仪器与设备
EVOLSI5扫描电子显微镜:卡尔蔡司(上海)管理有限公司;XD6多晶X射线衍射仪:北京普析通用仪器有限责任公司;Spectrum 65傅里叶变换红外光谱:铂金埃尔默仪器有限公司;EZTEST质构仪:日本岛津公司;NDJ-5S数字式黏度计:上海佑科仪器仪表有限公司;DSC8000差示扫描量热仪:美国PERKINELMER公司;Viscograph-E黏度仪:德国布拉班德公司;WSC-2B便携式精密色差仪:上海仪电物理光学仪器有限公司。
1.3 方法
1.3.1 山药原淀粉的提取
山药清洗,切块,榨汁,200目筛过滤。用蒸馏水洗涤滤渣多次,合并滤液,静置2 h。弃去上清液,用水重复洗涤沉淀,至上清液无色。淀粉层反复用95%乙醇洗涤,至上清液无色。将淀粉层离心(3 000 g,10 min),得到白色的湿淀粉。将湿淀粉60℃干燥24 h,粉碎,过200目筛,制得山药原淀粉。
1.3.2 山药交联淀粉的制备工艺优化
1.3.2.1 单因素试验
1)反应pH值的影响
配制40%的山药淀粉乳,加入占淀粉干基的10%的Na2SO4,搅拌混匀;用1 mol/L的NaOH调pH值分别至 8、9、10、11、12;加入占淀粉干基的 10%的三偏磷酸钠/三聚磷酸钠(质量比为99∶1);45℃反应4 h;用1 mol/L的HCl调pH值至6.5;洗涤、烘干、粉碎、过筛,制得交联淀粉。测定其抗性淀粉含量,获得最适pH值。
2)反应时间的影响
配制40%的山药淀粉乳,加入占淀粉干基的10%的Na2SO4,搅拌混匀;用1 mol/L的NaOH调pH值至11;加入占淀粉干基的10%的三偏磷酸钠/三聚磷酸钠(质量比为 99 ∶1);45 ℃分别反应 1、2、3、4、5 h;其余步骤同1),获得最佳反应时间。
3)反应温度的影响
配制40%的山药淀粉乳,加入占淀粉干基的10%的Na2SO4,搅拌混匀;用1 mol/L的NaOH调pH值为11;加入占淀粉干基的10%的三偏磷酸钠/三聚磷酸钠(质量比为 99 ∶1);分别在 35、40、45、50、55 ℃反应4 h;其余步骤同1),获得最适反应温度。
1.3.2.2 响应面法试验
在单因素试验的基础上,以反应pH值、反应时间、反应温度为响应因子,以抗性淀粉含量为响应值,根据Box-Behnken试验设计原理,采用三因素三水平的响应面分析法,对数据进行回归分析和显著性检验,得到多元二次回归方程,确定最佳工艺条件。试验因素水平设计见表1。

表1 Box-Behnken中心组合试验设计Table 1 Box-Behnken center combination experiment design
1.3.3 抗性淀粉含量的测定
参照美国分析化学家协会AOAC(Association of Official Analytical Chemists)(2002.02)[11]。
1.3.4 结合磷含量测定
参照GB/T 22427.11-2008《淀粉及其衍生物磷总含量测定》淀粉及其衍生物磷总含量测定[12]。
1.3.5 溶解度和膨胀力测定
将淀粉样品配成2%(g/mL)的淀粉乳,分别在不同温度(55、65、75、85、95℃)的水浴中加热搅拌 30 min;3 000 g离心30 min;取上清液,于105℃烘至恒重[13]。溶解度和膨胀力分别用(1)式和(2)式计算。
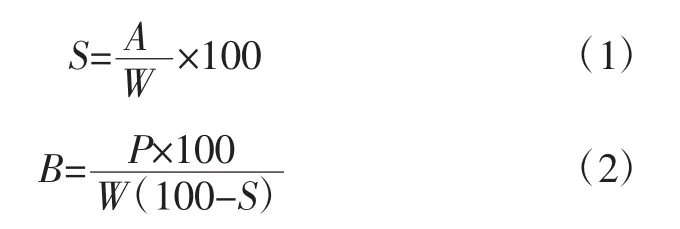
式中:S为溶解度,%;A为上清液干重,g;W为淀粉样品的质量,g;B为膨胀力,%;P为离心后淀粉质量,g。
1.3.6 糊透明度测定
配制质量分数为1%的淀粉乳,调pH值至6.5,在沸水浴中加热30 min,冷却至25℃,以蒸馏水作参比,测定在650 nm处的透光率[14]。
1.3.7 稳定性测定
1.3.7.1 耐酸性测定
配制质量分数为3%的淀粉乳,置于水浴锅中,升温至95℃,保持30 min;冷却至25℃,测其黏度;然后,加盐酸调pH值至3.0,再用NDJ-5S数字式黏度计测其黏度[15]。比较加酸前后黏度的降低率。
1.3.7.2 剪切稳定性测定
配制3%(g/mL)的淀粉乳,在95℃水浴中加热30 min;冷却至25℃,测其黏度;再用磁力搅拌器以200 r/min搅拌淀粉糊5 min,测其黏度;计算剪切后黏度的降低率[15]。
1.3.7.3 冻融稳定性测定
配制3%淀粉乳,置于沸水浴中糊化20 min,冷却至25℃;然后将淀粉糊等分成4份,分别倒入4个离心管中;冰箱中冷冻24 h;取出,自然解冻6 h;取1管于3 000 g离心20 min,弃去上清液,称重。其余3管再冷冻、解冻,至 4管做完,按(3)式计算[16]:

式中:m1为离心管的质量,g;m2为离心前离心管加淀粉糊的质量,g;m3为离心弃上清液后离心管加淀粉糊的质量,g。
1.3.8 消化性测定
参照Englyst等的方法[5]。
1.3.9 DSC热特性测定
参照马丽苹等的方法[17]。
1.3.10 糊化性质测定
配制10%的淀粉乳,充分搅拌后放置到Viscograph-E黏度仪中,由25℃升至50℃并保持1 min,3.67 min内上升到95℃,保持2.5 min,然后下降到50℃,保持2 min,记录这一过程的糊化温度、峰值黏度、最低黏度、消减值、最终黏度与回生值[18]。
1.3.11 颜色值测定
使用色差仪测量,自动比较样板与样品之间的颜色差异,输出L*、a*、b*3组数据和比色后的ΔL、Δa、Δb。通过覆盖零校准来校准仪器[19]。
1.3.12 质地分析
将50 mL 10%的淀粉悬浮液置于100 mL烧杯中,加热至95℃,保持15 min,冷却至25℃,然后在4℃下储存24 h。将烧杯中形成的凝胶直接用质构仪进行质地分析,每个凝胶用P35/L圆柱形探针穿透4 mm。在穿透循环期间,以1.0 mm/s的速度获得时间曲线。所得曲线用于计算凝胶硬度、最大黏附力、黏附性、弹性、胶黏性和咀嚼性[13]。
1.3.13 结构特征观察
1.3.1 3.1 傅里叶变换红外光谱
称取2 mg样品在红外灯的照射下,置于研钵中研磨,然后与约150 mg干燥的溴化钾粉末充分混合,继续研磨后压片,置于红外光谱仪内,在4 000 cm-1~400 cm-1波长处扫描,绘制红外光谱图[19]。
1.3.1 3.2 X射线衍射
使用粉末X射线衍射仪获得淀粉样品的X射线衍射图案。检测散射辐射,角度范围从3°(2θ)到60°(2θ),扫描速度为 8°(2θ)/min。利用 MDI Jade 6 对样品的结晶度进行定量分析[19]。
1.3.1 3.3 扫描电镜
使用EVOLSI5扫描电子显微镜,工作电压10 kV,将样品铺在导电胶上,并固定在电镜样品托上,10 mA喷金40 s,抽真空并扫描拍照[19]。
2 结果与分析
2.1 山药交联淀粉制备的单因素试验
2.1.1 反应pH值的影响
考察不同的反应pH值对制备山药交联淀粉的影响,结果见图1。

图1 反应pH值对交联淀粉中抗性淀粉含量的影响Fig.1 Effect of reaction pH on RS content in cross-linked starch
由图1可见,在受试pH值范围内,随着pH值提高,所得交联淀粉中的抗性淀粉含量先升高后降低;pH 10时抗性淀粉的含量最大,为35.64%。交联反应的本质在于淀粉中的羟基与交联剂酯化,碱性条件能活化羟基,但过高的pH值对淀粉颗粒破坏较大,反而不利于抗性淀粉形成。
2.1.2 反应时间的影响
考察不同的反应时间对制备山药交联淀粉的影响,结果见图2。

图2 反应时间对交联淀粉中抗性淀粉含量的影响Fig.2 Effect of reaction time on RS content in cross-linked starch
由图2可见,当反应4 h时,抗性淀粉的含量最大,为35.56%。反应时间过久,交联剂分子之间会相互作用,产生空间位阻,从而使得抗性淀粉含量降低。
2.1.3 反应温度的影响
考察不同的反应温度对制备山药交联淀粉的影响,结果见图3。
当反应温度为45℃时,抗性淀粉的含量最大,为35.13%。当反应温度达到一定程度时,淀粉在碱性条件下会发生部分淀粉糊化,使淀粉颗粒结构破坏,从而阻止抗性淀粉的生成。
2.2 山药交联淀粉制备的响应面试验
2.2.1 响应面试验设计与结果
在中心组合设计试验中,主要考察反应pH值、反应时间和反应温度对所得交联淀粉中抗性淀粉含量的影响,从而找出最佳制备工艺,试验设计方案及结果如表2所示。
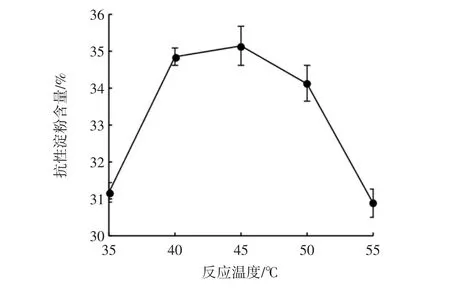
图3 反应温度对交联淀粉中抗性淀粉含量的影响Fig.3 Effect of reaction temperature on RS content in cross-linked starch
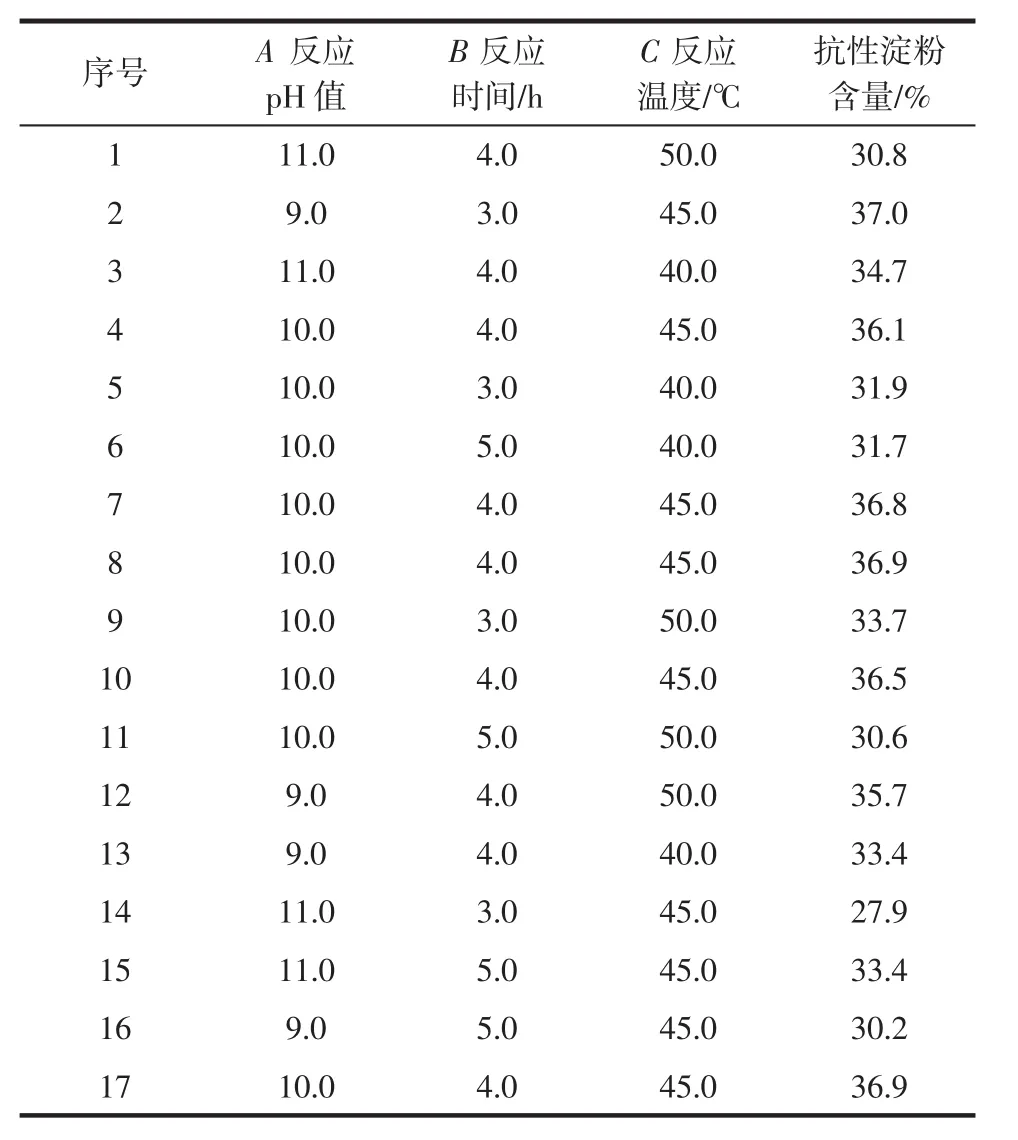
表2 Box-Behnken试验设计方案和结果Table 2 Box-Behnken experimental design and results
通过分析表2数据,得到各因素与响应值之间的多元二次回归方程为:Y=36.64-1.19A-0.58B-0.11C+3.08AB-1.55AC-0.73BC-1.42A2-3.10B2-1.57C2。利用Design-Expert软件对表2中数据进行分析,得到方差分析及回归方程显著性检验结果,见表3。
由表 3 可知,模型的 F=43.56,P<0.01,该模型是显著的。失拟项P值为0.073 7>0.05,相关系数R2=0.982 5,模型失拟项不显著,表明该模型具有极显著的统计学意义;该模型拟合程度良好,因此可用此模型对试验进行模拟和预测。由回归模型系数显著性检验结果可知,反应pH值影响极显著(P<0.01),反应时间影响显著(P<0.05),而反应温度无显著影响。对二次变量而言,AB、AC、A2、B2、C2对 Y 值影响极显著(P<0.01)。
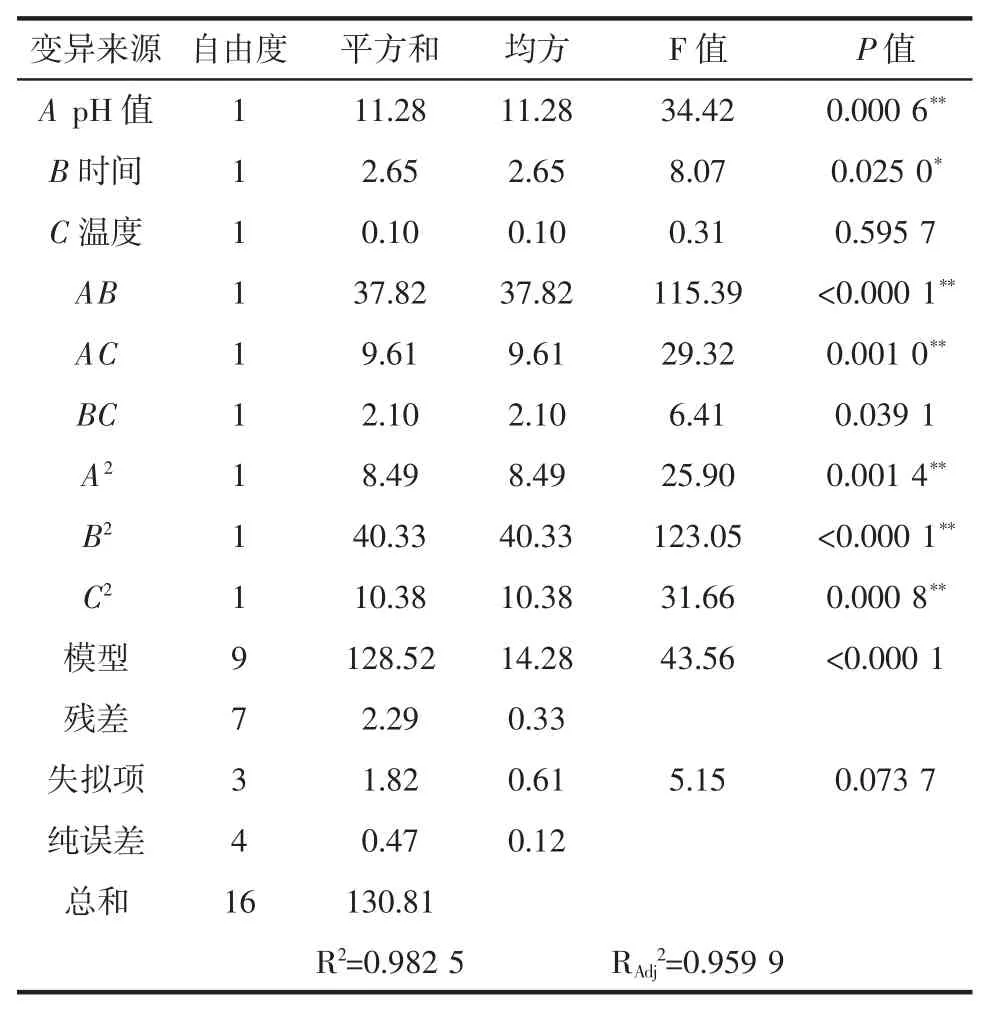
表3 回归方程系数显著性检验Table 3 Test of significance for regression equation coefficients
为了进一步研究相关变量间的交互作用并确定最优点,采用Design Expert软件绘制响应面曲线图,结果如图4所示。


图4 各因素交互作用对抗性淀粉含量影响的响应面图Fig.4 The response surface graph of the effects of interaction of various factors on RS content
从各因素之间两两相互作用的影响面图形观察,AB、AC、BC曲线较陡,且等高线为椭圆,所以反应pH值和反应时间、反应pH值和反应温度、反应时间和反应温度均存在显著的交互作用,这与表3的方差分析结果一致。
2.2.2 最佳条件预测及验证
通过响应面分析,确定最佳反应条件为:反应pH值为10.0,反应时间为3.34 h,反应温度为48.05℃,抗性淀粉含量的预测值为38.05%。为了试验操作的方便,选择交联反应最佳的反应条件为:反应pH值为10.0,反应时间为3.3 h,反应温度为48℃。在此条件下进行3次平行试验进行验证,取平均值,最终为38.17%。该结果与原淀粉中抗性淀粉含量(20.32%)相比提高了17.85%,说明该模型可以有效预测最优工艺条件。
2.3 山药交联淀粉的结合磷含量
根据GB 29926-2013《食品安全国家标准食品添加剂磷酸酯双淀粉》规定,淀粉中结合磷含量上限为0.4%。本试验所制备的交联淀粉中结合磷含量为0.38%,达到合格要求。
2.4 山药交联淀粉的溶解度与膨胀力
溶解度与膨胀力是衡量淀粉与水之间作用大小的一个重要指标。山药原淀粉(对照)和交联淀粉的溶解度和膨胀力分别见图5和图6。
随着温度升高,淀粉颗粒结构不断被破坏,溶解度不断增加。与原淀粉相比,交联淀粉的溶解度降低,这可能是由于淀粉分子间通过交联键变得更加稳固。
在较高温度下,淀粉微晶束开始松动[20]。由图6可见,山药交联淀粉的膨胀力小于原淀粉。这可能是由于原淀粉达到糊化温度后颗粒大量吸水膨胀,而交联淀粉未达到糊化温度,因此只能产生有限的膨胀[21]。
2.5 山药交联淀粉的糊透明度

图5 山药原淀粉与交联淀粉在不同温度下的溶解度Fig.5 Solubility of yam raw starch and cross-linked starch at different temperatures
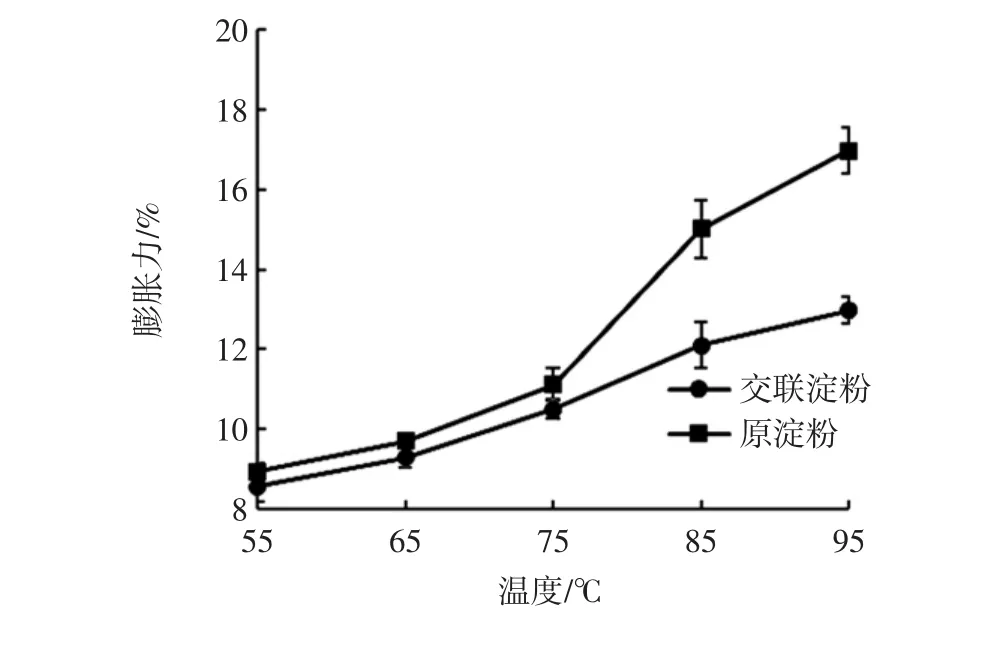
图6 山药原淀粉与交联淀粉在不同温度下的的膨胀力Fig.6 Swelling power of yam raw starch and cross-linked starch at different temperatures
糊透明度是指淀粉经糊化、冷却后,光线穿过淀粉糊的能力。它可以通过不透明性和光泽影响食品的色泽。山药原淀粉与交联淀粉的糊状透明度见图7。

图7 山药原淀粉与交联淀粉的糊透明度Fig.7 Paste transparency of yam raw starch and cross-linked starch
图7表明,与原淀粉相比,交联淀粉的糊透明度较低。这是由于交联处理使淀粉的平均分子质量增大,导致交联淀粉颗粒分散程度降低[22]。
2.6 山药交联淀粉的稳定性特征
2.6.1 耐酸性
在酸性条件下,淀粉分子会部分降解,分子链变短,从而黏度降低。山药原淀粉和交联淀粉的耐酸性如表4所示。

表4 山药原淀粉与交联淀粉的耐酸性Table 4 Acid resistance of yam raw starch and cross-linked starch
由表4可见,相比于原淀粉,交联淀粉的黏度变化较小。这是因为交联淀粉存在交联键,使淀粉分子的平均分子质量增加,并增强了淀粉分子之间的作用力。
2.6.2 耐剪切性
山药原淀粉和交联淀粉的耐剪切性如表5所示。
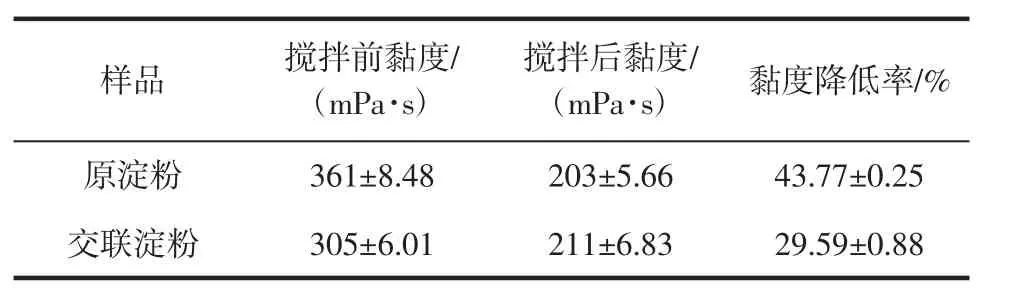
表5 山药原淀粉与交联淀粉的耐剪切性Table 5 Shear stability of yam raw starch and cross-linked starch
与山药原淀粉相比,交联淀粉的耐剪切性增强。交联键的存在,增强了淀粉颗粒结构的稳定性。
2.6.3 冻融稳定性
冻融稳定性的程度由析水率表示,山药原淀粉与交联淀粉的冻融稳定性见表6。

表6 山药原淀粉与交联淀粉的冻融稳定性Table 6 Freeze-thaw stability of yam raw starch and cross-linked starch
由表6可见,交联淀粉的析水率小于原淀粉,表现出了良好的冻融稳定性,特别适于在冷冻食品中应用。
2.7 山药交联淀粉的体外可消化性
淀粉酶的亲和力与淀粉的来源、颗粒大小、直链淀粉与支链淀粉的比例以及晶体结构有关[23]。山药原淀粉和交联淀粉的体外可消化性如表7所示。
由表7可见,交联淀粉中RDS含量降低,SDS和RS含量分别升高了17%和87%。交联淀粉分子内部结构发生改变,从而限制了淀粉酶的作用,适于制备降血糖功能性食品。

表7 山药原淀粉与交联淀粉的体外可消化性Table 7 In vitro digestibility of yam raw starch and cross-linked starch
2.8 山药交联淀粉的DSC特性
山药原淀粉和交联淀粉的差示扫描量热(differential scanning calorimetry,DSC)特性如表8所示。
由表8可见,交联淀粉的起始糊化温度较高为81.6℃,Tc-To的温度也较大为7.9℃,表明交联处理使得淀粉难以糊化。交联淀粉的驻H提高到了15.12,表明交联淀粉发生相变时所需能量提高。驻H与淀粉的晶体形状、双螺旋结构等有关。交联处理后淀粉的磷酸基团能够通过负电荷产生诱导斥力,从而延缓淀粉链的缔合作用[24]。

表8 山药原淀粉与交联淀粉的DSC特性Table 8 DSC characteristics of yam raw starch and cross-linked starch
2.9 山药交联淀粉的糊化性质
山药淀粉与交联淀粉的糊化特性参数如表9所示。
由表9可见,交联淀粉的峰值黏度低于原淀粉,这是由于交联淀粉分子间形成较强的共价键,淀粉颗粒不易吸水膨胀,使得峰值黏度降低[25]。交联淀粉的糊化温度提高到86.43℃。原淀粉的消减值较大为1 328 mPa·s,表明其不稳定性较大;原淀粉的回生值也较大为2 975 mPa·s,表明原淀粉的抗老化性弱。这与Gunaratne等的试验结果相一致[26]。

表9 山药原淀粉和交联淀粉的糊化特性Table 9 Gelatinization characteristics of yam raw starch and cross-linked starch
2.10 山药交联淀粉的颜色
淀粉的颜色值降低会影响其质量,从而降低其可接受性,因此,淀粉需要高亮度值和低色度值。山药原淀粉和交联淀粉的颜色值如表10所示。

表10 山药原淀粉和交联淀粉的颜色值Table 10 Color values of yam raw starch and cross-linked starch
从表10可见,原淀粉比交联淀粉白,驻L*为2.64。两样品的总色差相比,原淀粉的驻E*较大,为2.64。
2.11 山药交联淀粉的质地分析
山药原淀粉和交联淀粉的质地分析如表11所示。
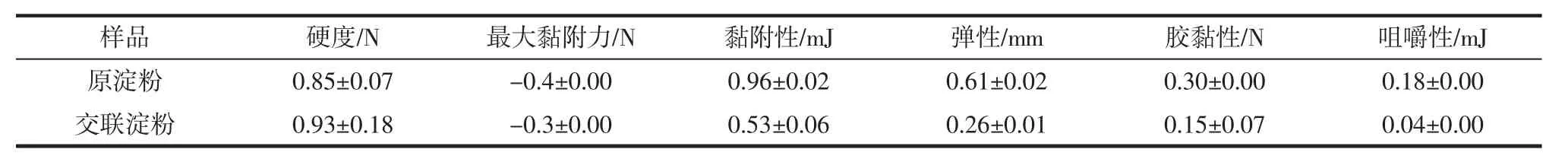
表11 山药原淀粉和交联淀粉的质地Table 11 Texture of yam raw starch and cross-linked starch
表11表明,交联淀粉的硬度提高,原因可能在于淀粉分子通过交联处理而聚集,凝胶组织较大。但是,交联淀粉黏附性、弹性、胶黏性与咀嚼性都有所降低。
2.12 山药交联淀粉的结构特征
2.1 2.1 傅里叶变换红外光谱观察
山药原淀粉与交联淀粉的傅里叶变换红外光谱如图8所示。
由图8可见,原淀粉与交联淀粉的化学键基本相同,在吸收峰波数方面差别较大。在1 642 cm-1处的峰由分子内氢键形成,原淀粉中较强,而交联淀粉减弱,这是由于交联后化学键增多和分子内氢键减少所致[27]。与原淀粉相比,交联淀粉在1 017cm-1处的吸收峰增强,但峰的强度很小。995 cm-1~1 050 cm-1是P-O-C伸缩振动吸收带,这表明反应生成的淀粉磷酸酯含量比较少。

图8 山药原淀粉与交联淀粉的傅里叶变换红外光谱Fig.8 Fourier transform infrared spectroscopy of yam raw starch and cross-linked starch
红外光谱吸收峰的强度可用于定量分析。通过淀粉结晶区的有序特征峰和非结晶区的无序特征峰计算两个特征峰的强度比值,从而得到结晶区和非结晶区的含量比例。1 045 cm-1附近的吸收峰对应淀粉的有序结构,1 022 cm-1附近的吸收峰对应淀粉的非晶区[28]。1 045 cm-1/1 022 cm-1的比值可以反映淀粉的有序程度,比值越大,说明淀粉的有序程度越高。
山药原淀粉与交联淀粉的1 045 cm-1/1 022 cm-1的峰强度比值见图9。

图9 山药原淀粉与交联淀粉的1045cm-1/1022cm-1的峰强度比值Fig.9 Absorbance ratio of yam cross-linked raw starch and crosslinked starch at 1 045 cm-1/1 022 cm-1
由图9可见,交联淀粉的吸光度比值较小,为1.09,这是由于交联处理小幅度地破坏了淀粉的有序性。
2.1 2.2 X射线衍射图谱观察
山药原淀粉与交联淀粉的X射线衍射图如图10所示。
原淀粉与交联淀粉的结晶结构几乎保持原状,仍然为A型,表明交联反应主要发生在淀粉的无定形区域。衍射角的数值应在结果中反映出来。山药原淀粉和交联淀粉的相对结晶度如表12所示。

图10 山药原淀粉与交联淀粉的X射线衍射图谱Fig.10 X-ray diffraction pattern of yam raw starch and crosslinked starch

表12 山药原淀粉与交联淀粉的相对结晶度Table 12 Relative crystallinity of yam raw starch and cross-linked starch
从表12可见,交联淀粉的相对结晶度与原淀粉相比,由25.3%上升到29.1%,这可能是由于经过交联后,磷酸基团以架桥的形式将淀粉分子结合起来,形成多维的空间结构,分子之间结合得更加紧密,无定型区的有序性增加。
2.1 2.3 扫描电子显微镜观察
山药原淀粉与交联淀粉的扫描电镜图如图11所示。

图11 山药原淀粉与交联淀粉的扫描电镜图Fig.11 SEM graph of yam raw starch and cross-linked starch
由图11可知,山药原淀粉颗粒较完整,没有裂缝和破损,表面较光滑,颗粒的大小差别不大,而交联淀粉颗粒之间有连接,表面变得粗糙,一些小淀粉颗粒附着在较大颗粒表面,一些小淀粉颗粒之间相互聚集形成较大的粒团。这说明,通过与交联剂的多个官能团发生反应,在淀粉分子之间形成架桥,将分子连接起来。
3 结论
在本研究中,确定了制备山药交联淀粉的反应条件:反应pH值为10,反应时间为3.3 h,反应温度为48℃,所得交联淀粉中抗性淀粉含量为38.17%。与山药原淀粉相比,交联淀粉的溶解度、膨胀力、糊透明度、体外可消化性(缓慢消化淀粉和抗性淀粉含量分别升高了17%和87%)、颜色值、黏附性、弹性、胶黏性与咀嚼性降低,耐酸性、耐剪切性、冻融稳定性、糊化温度、抗老化性和硬度升高。交联淀粉的有序程度下降;晶体结构仍为A型,相对结晶度有所提高;颗粒形态发生明显变化,少许淀粉颗粒发生聚集。因此,可以根据山药交联淀粉与原淀粉的特点,将其有针对性地应用于不同食品中。
