白藜芦醇对钛颗粒诱导小鼠巨噬细胞形成的破骨细胞数量及F-actin环面积影响观察
2020-08-11刘子歌宋国瑞张晨李燕刘心蕊陈德胜
刘子歌,宋国瑞,张晨,李燕,刘心蕊,陈德胜
1 宁夏医科大学临床医学院,银川750004;2 宁夏医科大学基础医学院;3 生育力保持教育部重点实验室/宁夏生殖与遗传重点实验室;4 宁夏医科大学总医院
人工关节无菌性松动是人工全关节置换术后主要的长期并发症之一,也是导致翻修手术最常见的原因[1],而骨溶解是无菌性松动最突出的生物学表现。大量研究[2~4]表明,假体周围的骨溶解是由假体部件之间的重复摩擦产生的磨损颗粒被巨噬细胞吞噬所导致的炎症引起的。磨损颗粒激活的巨噬细胞可分泌多种促炎细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6、前列腺素E2等,由此引起的炎症反应被认为是假体周围骨溶解及随后发生的无菌性松动的主要原因,即所谓的“颗粒病”,进而需要进行二次翻修手术,这也是导致植入物失败的主要原因之一。研究[5]显示,TNF-α、IL-1β等炎症因子会引起炎性骨吸收,抑制骨形成,最终导致骨溶解和无菌性松动。白藜芦醇是一种多酚,存在于葡萄、浆果和花生等多种饮食来源物中,有抗氧化、抗炎和抗肿瘤等多种功能。有研究[6]证明,白藜芦醇能够促进成骨细胞的形成和功能,抑制破骨细胞的生成。研究[7]发现,白藜芦醇对软骨细胞有保护作用,可以延缓骨关节炎退变。在此基础上,我们推测白藜芦醇可以抑制假体磨损颗粒引起的假体周围骨溶解和无菌性松动。为了验证这一假设,2018年10月~2019年12月,我们观察了白藜芦醇对磨损颗粒诱导的体外破骨细胞生成及功能的影响,并探讨其机制。
1 材料与方法
1.1 白藜芦醇、钛颗粒、细胞及试剂 白藜芦醇(C14H12O3,纯度≥99.5%)购自美国MCE公司,商品纯化钛颗粒购自美国Alfa Aesar公司,小鼠巨噬细胞株RAW264.7购自中国科学院上海细胞库,DMEM高糖培养基、胎牛血清购自美国Gbico公司,TNF-α、IL-1β ELISA试剂盒购自北京博奥森生物技术公司,抗酒石酸酸性磷酸酶(TRAP)染色试剂盒购自美国Sigma公司,内毒素检测鲎试剂盒购自厦门市鲎试剂实验厂有限公司,CCK-8试剂盒购自江苏凯基生物技术公司,Prime Script RT reagent Kit Perfect Real Time RNA反转录试剂盒、Ultra SYBR One Step RNA PCR Kit荧光定量PCR试剂盒购自日本TaKaRa生物公司,β-actin、p-p65、p-IκBα抗体购自美国Cell Signalling公司,鬼笔环钛染色试剂购自武汉塞维尔公司,荧光显微镜、IX71光学显微镜购自日本OLYMPUS公司。
1.2 实验材料处理及浓度确定
1.2.1 钛颗粒去除内毒素 将钛颗粒在180 ℃条件下焙烤6 h,加入75%乙醇,水平摇床晃动48 h,离心后收集钛颗粒并加入PBS并进行高温高压再次灭菌,PBS重悬,采用鲎试剂盒进行内毒素检测,确保钛颗粒内毒素含量低于0.1 EU/mL,方可用于细胞实验。用于实验的钛颗粒终质量浓度为0.1 mg/mL[8]。
1.2.2 白藜芦醇细胞毒性检测及实验浓度的确定 采用CCK-8细胞增殖实验。将RAW264.7细胞以5×103/孔接种于96孔板,加入不同浓度(0、1、5、10、15、20、30 μmol/L)白藜芦醇干预后,继续培养72 h,加入10 μL CCK-8溶液,使用酶标仪检测450 nm波长处的吸光度值,计算细胞增殖活性。CCK-8细胞增殖实验结果显示,加入0、1、5、10、15、20、30 μmol/L白藜芦醇后细胞增殖活性分别为1.000、1.020±0.009、1.029±0.011、1.010±0.008、0.979±0.009、0.957±0.009、0.870±0.022,其中加入1、5、10、15 μmol/L白藜芦醇的细胞增殖活性与加入0 μmol/L白藜芦醇的细胞增殖活性相比,P均>0.05。本研究选择≤15 μmol/L的白藜芦醇用于后续实验。
1.3 细胞培养及分组 将RAW264.7细胞种于含有10%胎牛血清的DMEM培养基中,在5%CO2、37 ℃细胞培养箱培养。将RAW264.7细胞分为Sham组、Vehicle组、Low-Res组、Mid-Res组、High-Res组,后续试验处理时,Sham组加入完全培养基,Vehicle组加入钛颗粒(0.1 mg/mL)+完全培养基,Low-Res组加入钛颗粒(0.1 mg/mL)+完全培养基+白藜芦醇(1 μmol/L),Mid-Res组加入钛颗粒(0.1 mg/mL)+完全培养基+白藜芦醇(10 μmol/L),High-Res组加入钛颗粒(0.1 mg/mL)+完全培养基+白藜芦醇(15 μmol/L)。
1.4 各组破骨细胞数与F-actin环面积测算 ①采用TRAP染色法检测各组破骨细胞数。取各组细胞以1×104/孔接种于6孔板,继续培养5天后,4%多聚甲醛固定,加入TRAP染液,置入37 ℃生物培养箱中避光孵育1 h,碱性液冲洗干净、晾干,按照Ping等[5]的方法,光镜下观察并计数破骨细胞数。②采用鬼笔环钛染色法检测各组破骨细胞F-actin环面积。取各组细胞以1×104/孔接种于6孔板,继续培养5天后,加入4%多聚甲醛固定,0.1% Triton X-100穿膜5 min,加入鬼笔环肽染色液在37 ℃生物培养箱中避光孵育2 h,DAPI室温染色细胞核5 min,冲洗干净,封片,按照Roscher等[9]的方法,荧光显微镜下观察并测算F-actin环面积。
1.5 各组细胞中TNF-α、IL-1β mRNA和蛋白检测 ①采用Realtime-PCR法检测各组细胞中TNF-α、IL-1β mRNA。取各组细胞以1×104/孔/孔接种于6孔板,继续培养5天后,TRIzol法提取总RNA,用逆转录试剂盒将总RNA逆转录成cDNA,以cDNA为模板进行Realtime-PCR反应。引物序列如下:TNF-α正向引物为5′-CCCTCACACTCAGATCATCTT-3′,反向引物为5′-CTGCTACGACGTGGGCTACAG-3′;IL-1β正向引物为5′-CCTCGTGCTGTCGGACCCATA-3′,反向引物为5′-CAGGCTTGTGCTCTGCTTGTGA-3′;β-actin正向引物为5′-AGGGTGTGATGGTGGGAATG-3′,反向引物为5′-GCTGGGGTGTTGAAGGTCTC-3′。以2-ΔΔCt表示细胞中目的mRNA的相对表达量。②采用ELISA法检测各组细胞中TNF-α、IL-1β蛋白。取各组细胞以5×103/孔接种于96孔板,继续培养5天后收集细胞培养上清,800 r/min离心5 min去除Ti颗粒和细胞,分别使用TNF-α和IL-1β ELISA试剂盒检测各组细胞上清液中炎性破骨因子TNF-α和IL-1β。
1.6 各组细胞p-p65、p-IκB蛋白检测 采用Western blotting法。取各组细胞以1×104/孔接种于6孔板,继续培养5天后,用细胞蛋白试剂盒提取各组细胞的蛋白,BCA法定量,配置12%分离胶溶液,常规SDS-PAGE电泳、转膜,5%BSA封闭1 h后,分别加入p-p65(1∶1 000)、p-IκB(1∶1 500)和β-actin(1∶1 000)一抗4 ℃封闭过夜,加入二抗(1∶10 000)后用TBST稀释,室温孵育2 h,凝胶成像仪曝光,用Image J软件进行灰度值分析,以目的蛋白条带灰度值与内参蛋白条带灰度值的比值表示目的蛋白的相对表达量。

2 结果
2.1 各组破骨细胞数与F-actin环面积比较 ①Vehicle组可观察到较多体积较大、酒红色、内含多个细胞核的破骨细胞,而应用不同浓度白藜芦醇干预后,破骨细胞数随着药物浓度的增加而减少。Sham组、Vehicle组、Low-Res组、Mid-Res组、High-Res组破骨细胞数分别为0、(145.31±7.87)个、(129.63±4.12)个、(85.51±3.65)个、(69.76±5.63)个,其中Vehicle组和Low-Res组破骨细胞数相比,P>0.05,其余组间相比,P均<0.05。②Vehicle组可观察到少量较大且呈绿色的F-actin环,内含多核细胞,细胞核被DAPI染呈蓝色,细胞膜可见些许伪足,其中Low-Res组、Mid-Res组的F-actin环较Vehicle组略有减少,且细胞核减少,High-Res组多核细胞明显减少。Sham组、Vehicle组、Low-Res组、Mid-Res组、High-Res组F-actin环面积分别为0、(3 642.31±987.01)μm2、(3 265.75±871.98)μm2、(2 497.45±712.61)μm2和(1 741.81±716.07)μm2,组间相比,P均<0.05。
2.2 各组细胞中TNF-α、IL-1β mRNA和蛋白相对表达量比较 各组细胞中TNF-α、IL-1β mRNA和蛋白相对表达量比较见表1。
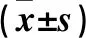
表1 各组细胞中TNF-α、IL-1β mRNA和蛋白相对表达量比较
2.3 各组细胞中p-p65、p-IκB蛋白相对表达量比较 各组细胞中p-p65、p-IκB蛋白相对表达量比较见表2。
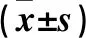
表2 各组细胞中p-p65、p-IκB蛋白相对表达量比较
3 讨论
骨溶解的特征是磨损颗粒诱导的炎症反应的激活,从而导致体内骨吸收与骨形成稳态的失调。研究[10]表明,破骨细胞的过度活动和骨吸收均与骨溶解密切相关。虽然许多细胞以各种方式参与这些病理过程,但破骨细胞是导致严重骨丢失并最终使假体松动的惟一骨降解细胞。一般来说,不同类型的磨损颗粒会从假体接触摩擦面产生,在人工关节中主要是金属碎片或超高分子量聚乙烯颗粒,它们会招募包括巨噬细胞和T淋巴细胞在内的免疫细胞到骨-种植体界面,触发一系列促炎细胞因子的释放,进而促进周围其他细胞如成纤维细胞和成骨细胞产生更多细胞因子,加速假体周围炎性微环境的形成[11]。在这些炎症介质中,巨噬细胞集落刺激因子(M-CSF)和核因子κB受体活化因子配体(RANKL)在破骨细胞的激活中起着至关重要的作用。M-CSF维持单核/巨噬细胞的生长,引导单核/巨噬细胞分化为破骨细胞前体细胞,而RANKL结合到破骨细胞前体细胞表面核因子κB受体活化因子(RANK)后,激活下游信号通路,主要涉及NF-κB信号传导通路,最终导致成熟的破骨细胞分化和随后的骨吸收活动。基于这些理论,我们认为通过破骨细胞的主要信号通路来靶向破骨细胞的形成是治疗骨溶解的一种有效可行的方法。
白藜芦醇是一种在多种植物中发现的非黄酮类多酚化合物。最近的研究[6,12]证明,白藜芦醇具有多种健康益处,例如心血管疾病和癌症的预防。然而,这些保护机制还没有得到充分的探索。有研究[13,14]指出,其保护作用的可能机制之一是通过下调炎症反应,包括抑制促炎介质的合成和释放、修饰二十烷类化合物的合成、抑制一些活化的免疫细胞或环氧合酶1和2,降低促炎介质的合成。在本研究中,我们采用了磨损颗粒诱导下的体外破骨细胞形成模型来证明白藜芦醇在骨溶解中的作用。为排除白藜芦醇是通过对RAW264.7细胞产生毒性作用来影响破骨细胞形成的可能性。我们首先用不同浓度的白藜芦醇对RAW264.7细胞干预72小时检测各组的增殖活性,以评估白藜芦醇的细胞毒性水平,结果显示浓度≤15 μmol/L的白藜芦醇对RAW264.7细胞的增殖是没有影响的。TRAP是破骨细胞特异性的标志酶,TRAP染色是鉴定破骨细胞分化成熟的金标准,如果观察到三个或以上细胞核同时TRAP呈现阳性(酒红色)的细胞便可鉴定为是破骨细胞[15]。我们通过TRAP染色实验观察不同浓度的白藜芦醇对RAW264.7细胞向破骨细胞分化的影响,我们发现,应用不同浓度白藜芦醇干预后,染色呈阳性的破骨细胞数目随着药物浓度的增加而减少,且白藜芦醇呈浓度趋势抑制体外破骨细胞的成熟。此外,特征性F-actin环的形成是破骨细胞发挥骨吸收功能的前提条件,F-actin环锚定在矿化的基质上,可以形成一个密闭的骨吸收腔,破骨细胞依靠其行使骨吸收功能[16]。因此,我们进行鬼笔环肽染色以测试白藜芦醇对F-actin环形成的影响,结果与TRAP染色结果相符,我们在Vehicle组可以清楚的观察到大且清晰的F-actin环,然而用白藜芦醇干预后,F-actin环的大小随浓度而减少。结合TRAP的结果,我们认为白藜芦醇在体外可以抑制破骨细胞的功能与成熟,并且与白藜芦醇的浓度有关。
炎性骨溶解所诱导的炎性反应主要是通过磨损颗粒自身刺激巨噬细胞、成纤维细胞、成骨细胞及T淋巴细胞等分泌大量的TNF-α、IL-1β和IL-6炎性因子引起[17]。我们用ELISA法检测了各组细胞上清液中TNF-α和IL-1β的分泌量,结果显示白藜芦醇能够显著抑制上述炎症因子的表达,进一步证实了白藜芦醇良好的抗炎效果。同时,本研究Realtime-PCR结果表明,白藜芦醇可显著降低TNF-α和IL-1β mRNA的表达,并呈浓度依赖性,这也进一步验证了我们ELISA的检测结果。我们最后检测了白藜芦醇处理后IκBα和p65磷酸化蛋白的表达。IκBα作为IκB家族中最重要的成员之一,它调控的是NF-κB这一细胞通路中关于机体免疫与炎症的途径,其与p65/p50二聚体结合,抑制其活性[18]。本研究结果显示,通过影响IκBα和NF-κBp65的磷酸化,白藜芦醇抑制了钛颗粒诱导的小鼠RAW264.7巨噬细胞中NF-κB通路的活化。
综上所述,白藜芦醇呈浓度依赖性对钛颗粒诱导小鼠巨噬细胞株RAW264.7形成的破骨细胞数量及F-actin环面积产生抑制作用,其抑制作用的机制与NF-κB信号通路有关。这说明,白藜芦醇可能是治疗假体磨损颗粒引起的骨溶解的一种潜在选择的治疗药物。
