红景天苷抑制Hcy诱导的血管内皮细胞氧化应激损伤的实验研究
2020-08-11张彦燕付凌云李佳川
张彦燕,何 丽,黄 梅,姜 丰,付凌云,李佳川
(1.贵州医科大学药学院,贵州贵阳 550025;2.贵州医科大学天然药物资源优效利用重点实验室,贵州 贵阳 550025;3.西南民族大学药学院,四川 成都 610041)
新近研究表明,同型半胱氨酸(homocysteine,Hcy)可通过活化炎症因子,促进血小板黏附聚积等机制促进As的发生发展,成为动脉粥样硬化新的、独立的危险因素[1-2].而氧化应激损伤为动脉粥样硬化的关键病理过程[3],其中核转录因子E2相关因子2(Nrf2)是新近发现的抗氧化应激的重要转录因子[4-5].研究显示,上调Nrf2信号可激活机体抗氧化酶与II相药物代谢酶,提高细胞对活性氧(reactive oxygen species,ROS)的清除能力.因此,积极寻找可调控Nrf2分子信号的防治药物具有重要意义.
红景天苷(salidroside)是景天科(Crassulaceae)红景天属植物红景天的主要有效成分,具有抗自由基损伤、抗氧化、抗疲劳、耐缺氧等药理作用[6-7],但其对Hcy诱导血管内皮细胞氧化应激损伤的保护作用及分子机制尚未明确.本研究拟基于Nrf2信号,分析红景天苷对氧化应激损伤相关指标的影响,明确其对Hcy损伤的血管内皮的保护作用及可能机制.
1 材料与方法
1.1 材料
人脐静脉内皮细胞(HUVECs)购于美国Siencell公司;红景天苷购自西亚化学工业有限公司;内皮细胞培养液、胰蛋白酶、冻存液,均购自美国Sciencell公司;Hcy、MTT购于Sigma公司;乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒均购自南京建成生物工程研究所.
1.2 细胞培养、分组与处理
选择3~8代生长状态良好的HUVEC,复苏,加入5%血清的完全培养基后置于37℃、5%CO2的湿热恒温培养箱中,视细胞生长情况换液及传代.以1×105个/ml的细胞密度接种培养,随机分为正常对照组、模型组(Hcy,1mmol/L)、红景天苷高剂量组(SAL,50 μmol/L)、红景天苷低剂量组 (SAL,10 μmol/L),待细胞处于增殖期后分组实验.各组预先给予SAL孵育2 h后,再加入Hcy(1 mmol/L)共孵育12h复制氧化应激损伤细胞模型.
1.3 细胞存活率检测
将细胞接种于96孔板中,采用MTT法测定细胞存活率.
1.4 LDH、MDA、SOD 活性检测
将细胞接种于24孔板中,经培养及分组处理后收集各组培养细胞上清液,乳酸脱氢酶检测试剂盒测定上清液中LDH活性.胰酶消化法收集各组细胞,PBS离心洗涤3次,以超声法破碎细胞,离心收集上清液待测.待测样品按照MDA、SOD试剂盒所述方法分别测定其细胞内含量.
1.5 细胞活性氧簇(ROS)检测
将细胞接种于6孔培养板中,待细胞融合度达70% ~80%时,按1.2项下方法分组处理.经PBS洗涤后于细胞培养板内加入10μΜ的DCFH-DA,置于培养箱内避光孵育30 min,用无血清ECM清洗3~4次.采用ImageJ软件统计各组荧光照片中阳性细胞面积和平均光密度(IDO)值.
1.6 实时荧光定量PCR检测Nrf2、HO-1、NQO1的mRNA表达
Trizol法提取各组细胞总RNA,取2μgA260-A280为1.8~2.0的总RNA逆转录为cDNA.以GAPDH为内参,按SYBRⒸPremix Ex TaqTMⅡ试剂盒所述方法检测cDNA产物中Nrf2、HO-1、NQO1的丰度.引物序列如下,Nrf2上游引物:5’-TCCTATGCGTGAATC-CCAAT-3’,Nrf2下游引物:5’-GCGGCTTGAATGTTTGTCTT-3’;HO-1上游引物:5’ -GGGCTGTGAACTCTGTCCAAT-3’,下游引物:5’ -GGTGAGGGAACTGTGTCAGG-3’;NQO1上游引物:5’ -TTCTGTGGCTTCCAGGTCTT-3’,下游引物:5’ -TCCAGACGTTTCTTCCATCC-3’.设置反应程序为:95℃预处理30 s,后进行40次循环,循环条件为95℃变性5 s,60℃退火30 s,72℃延伸30 s.目的基因的相对表达量按照公式2-△△Ct计算.
1.7 统计方法
各组实验数据以(x-±s)表示,SPSS 20.0软件进行统计学处理.采用Student t检验(T-test),P<0.05表示具有差异,P<0.01表示具有显著性差异.
2 结果
2.1 SAL对细胞存活率的影响
正常对照组、模型组、红景天苷高、低剂量组(50,10 μmol/L)细胞存活率分别为 100%、72.74%、97.24%、88.71%.Hcy作用后细胞存活率显著降低(P<0.01),预先给予SAL孵育后,SAL高、低剂量组细胞存活率明显提高(P<0.01,P<0.05).
2.2 SAL对上清液LDH及细胞内MDA、SOD活性的影响
经Hcy诱导孵育后,内皮细胞培养上清液LDH释放量和细胞内MDA含量明显升高(P<0.01),SOD水平明显降低(P<0.01),表明HUVEC细胞氧化与抗氧化水平失衡.红景天苷预给药后,高、低剂量SAL可明显降低LDH释放量(P<0.01),降低MDA水平(P<0.01,P<0.05),明显提高 SOD 活性(P<0.01,P<0.05),结果见表1.
表1 SAL对LDH、MDA、SOD活性的影响(±s,n =6)Table 1 Effects of SAL on LDH,MDA and SOD activity(±s,n =6)

表1 SAL对LDH、MDA、SOD活性的影响(±s,n =6)Table 1 Effects of SAL on LDH,MDA and SOD activity(±s,n =6)
注:与对照组比较*P<0.05,**P<0.01,与模型组比较,与△P <0.05,△△P <0.01(下同)
组别 LDH(U/L)MDA(μmol/g)SOD(U/mg)正常对照组 178.24±6.82 2.48±0.34 37.21±1.8模型组 284.36±9.45** 8.41±0.52** 16.54±2.17**SAL高剂量组 227.61±7.13△ 4.07±0.36△△ 32.49±2.33△△SAL低剂量组 243.76±6.57△ 5.26±0.42△ 26.64±2.59△
2.3 SAL对ROS的影响
正常对照组、模型组、SAL高、低剂量组IDO值分别为85.41±14.62、367.04±18.33、123.76±19.28、254.46±24.76.结果表明,Hcy显著升高内皮细胞IDO值(P<0.01),SAL高低剂量干预给药可明显降低细胞ROS水平,组间比较P<0.01.SAL对各组ROS的影响情况见图1.
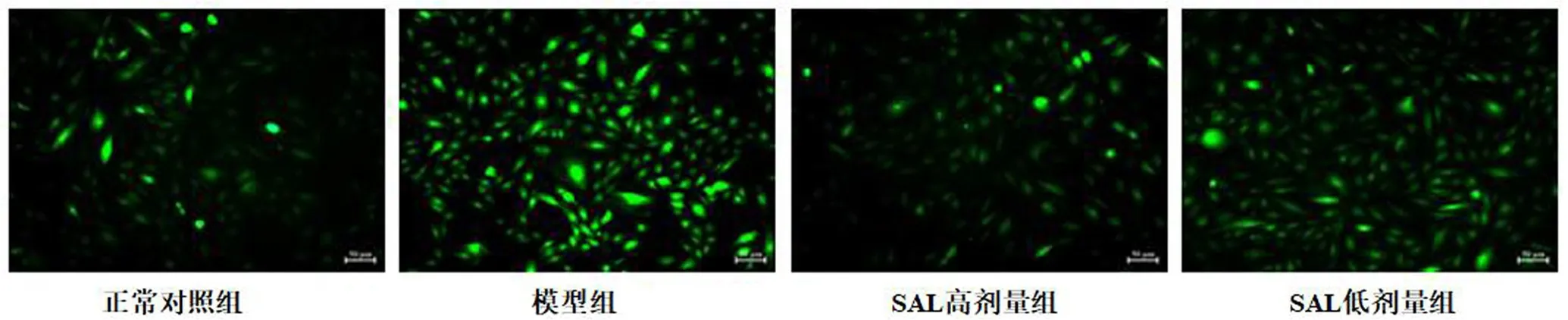
图1 SAL对ROS的影响Fig.1 Effect of SAL on ROS
2.4 SAL对Nrf2、HO-1、NQO1 mRNA表达的影响
采用qRT-PCR分析各组细胞抗氧化信号Nrf2、NQO1与HO-1的mRNA表达水平.结果表明,SAL高低剂量预给药后可明显上调Hcy诱导的内皮细胞Nrf2、NQO1与HO-1的mRNA表达水平,结果见表2.
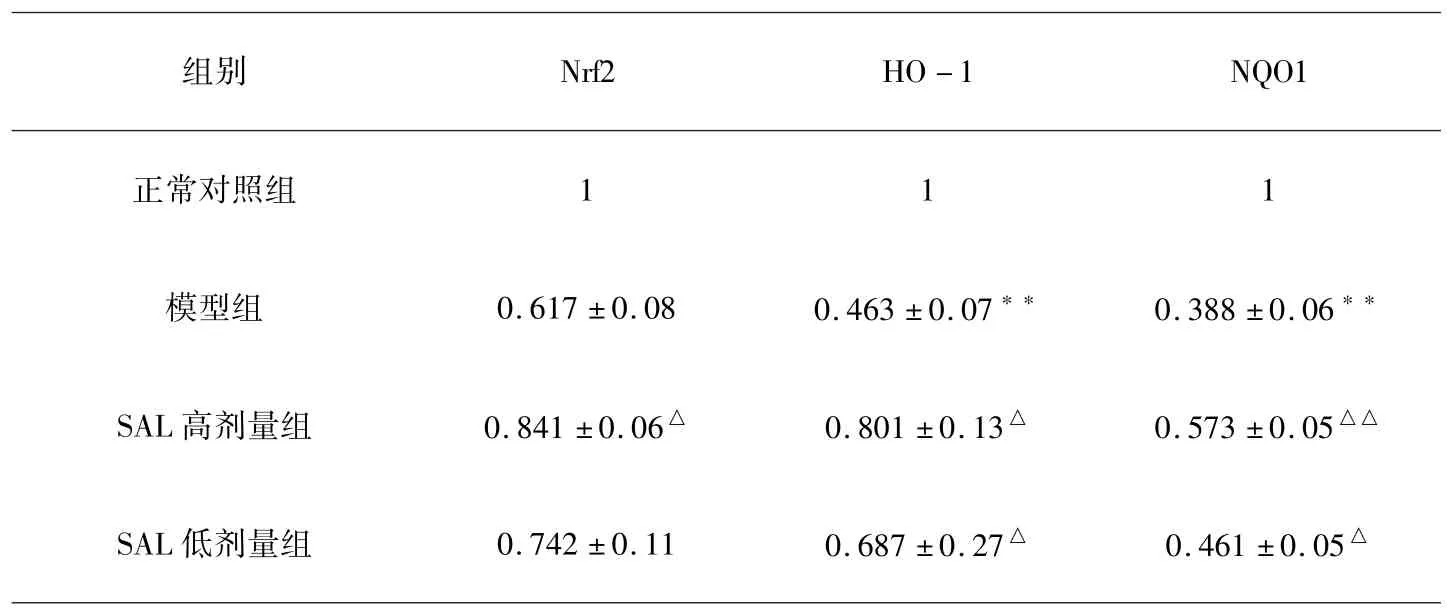
表2 SAL对Nrf2、HO-1及NQO1 mRNA表达的影响(x±S,n=3)Table 1 Effects of SAL on the mRNA expression of Nrf2,HO-1 and NQO1(x ± s,n =3)
3 讨论
近年发现,许多冠心病患者并不存在传统的As致病因素(如高脂血症、高血压等),但其中高同型半胱氨酸血症占一定比例,Hcy已成为AS的独立危险因素[8].Hcy可通过影响内皮细胞功能,介导氧化应激和炎症反应,进一步调控相关基因的表达导致AS的发生发展[9].本研究通过建立Hcy诱导HUVECs氧化应激损伤模型,明确红景天苷预给药后对细胞氧化损伤的保护作用,并基于Nrf2信号对其抗氧化作用机制进行了分析.
在危险因素的刺激下,细胞通过自身氧化产生大量的活性氧和活性氮,导致ROS在体内的聚积,引发机体氧化/抗氧化稳态的失衡,为动脉粥样硬化的关键病理过程[10].MDA是氧自由基过氧化反应的毒性终产物,其水平可反映机体氧自由基的清除能力.SOD为机体重要的抗氧化剂,可减轻氧自由基对细胞的过氧化损伤[11].本研究通过MTT法、LDH活性实验表明,1 mmol/L Hcy诱导12h显著引起内皮细胞损伤,而SAL高、低剂量预给药后,明显提高细胞存活率,降低LDH活性.同时,SAL能够抑制Hcy诱导的ROS的增加,降低细胞内MDA水平,提高SOD的活性,表明SAL对Hcy诱导的内皮细胞氧化损伤具有保护作用.
Nrf2/ARE是体内协调抗氧化应激的重要信号通路,其通过促进系列抗氧化基因的表达,提高细胞的抗氧化能力[12].当ROS、亲电子物质或其他有害物质引起氧化应激时,Nrf2可与 Keap1解偶联,游离的Nrf2可与自身启动子近侧区抗氧化反应元件(ARE)结合,激活抗氧化酶基因 HO-1、醌氧化还原酶NQO1等相关基因的表达,维持氧化/抗氧化的平衡稳态[13-17].本研究采用RT-PCR技术分析了抗氧化基因的表达量,与模型组相比,SAL能够上调抗氧化转录因子Nrf2的基因表达,并增加Nrf2信号下游HO-1、NQO1信号的mRNA的表达.结果表明,红景天苷可通过上调Nrf2信号的表达,同时增加下游抗氧化基因的表达,提示SAL可通过改善氧化应激损伤,发挥其心血管药理学活性.
