MRS联合FL导航手术治疗幕上高级别胶质瘤疗效观察
2020-08-10陈曦
陈曦
自贡市第四人民医院神经外科,四川 自贡 643000
脑胶质瘤为常见的颅内恶性肿瘤,由于肿瘤侵袭性生长,因此总体预后不佳。高级别胶质瘤主要出现于幕上,其生长具有高度间变的特点,手术切除后复发较快,因此治疗更为棘手[1]。目前,外科手术仍然是治疗脑胶质瘤的最有效手段,手术方式的选择是影响术后生存期的主要因素,全切除可延长生存时间,提高患者生存质量[2]。随着显微外科与神经影像技术的发展,手术治疗脑胶质瘤的切除率得到了提升,可更有效缓解肿瘤压迫,为后续非手术治疗奠定基础[3]。本研究旨在探讨磁共振波谱分析(MRS)联合荧光素钠(FL)导航的显微外科手术治疗幕上高级别胶质瘤的临床效果。
1资料与方法
1.1 一般资料 回顾性分析2017年1月至2019年1月期间自贡市第四人民医院神经外科收治的80例幕上高级别胶质瘤患者的临床资料,其中51例实施MRS联合FL导航手术,纳入观察组,29例实施常规显微外科手术,纳入对照组。纳入标准:幕上胶质瘤经手术病理确诊者;病理诊断为高级别胶质瘤(WHO分级Ⅲ~Ⅳ级)者;术后接受辅助同步放化疗者;卡氏功能状态评分(KPS)60分以上者;病例资料完整者。排除标准:严重的肝肾功能不全者;肿瘤转移或复发者;脑脊液播散者;无法接受核磁共振检查者。两组患者的临床资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者的临床资料比较[±s,例(%)]
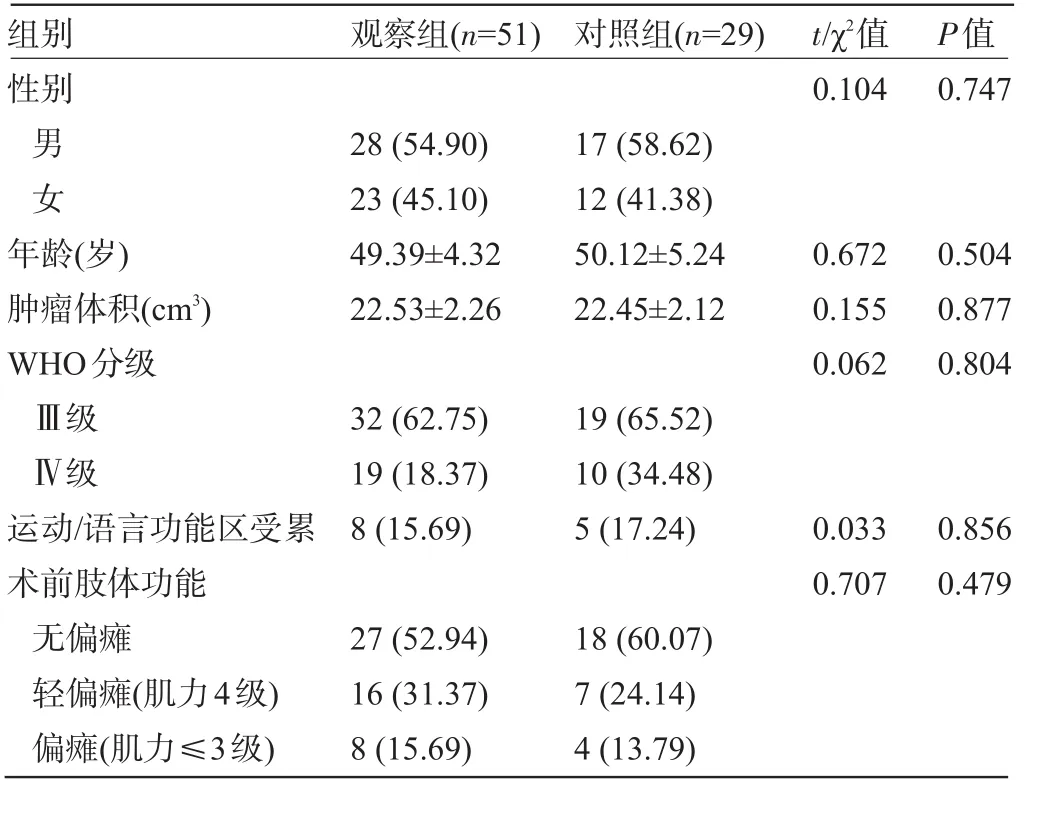
表1 两组患者的临床资料比较[±s,例(%)]
性别男女年龄(岁)肿瘤体积(cm3)WHO分级Ⅲ级Ⅳ级运动/语言功能区受累术前肢体功能无偏瘫轻偏瘫(肌力4级)偏瘫(肌力≤3级)28(54.90)23(45.10)49.39±4.32 22.53±2.26 32(62.75)19(18.37)8(15.69)27(52.94)16(31.37)8(15.69)17(58.62)12(41.38)50.12±5.24 22.45±2.12 19(65.52)10(34.48)5(17.24)18(60.07)7(24.14)4(13.79)0.104 0.672 0.155 0.062 0.033 0.707 0.747 0.504 0.877 0.804 0.856 0.479
1.2 方法
1.2.1 对照组 该组患者实施常规显微外科手术。术前予以甘露醇降颅压,根据术前CT、MRI等影像学检查确定的肿瘤位置,采取翼点或扩大翼点入路、冠状入路、旁正中入路等术式,显微镜下,沿着肿瘤边界水肿带分离,尽可能全切。非功能区可适当扩大切除发哪位,将肿块及周围水肿组织切除;功能区肿瘤仔细辨认肿瘤与正常脑组织,严格沿着肿瘤边缘切除;肿瘤较大且边界不清者,先行瘤内切除,减压后,缓慢提起瘤壁,沿着周边的胶质增生带,进行分块切除;对于血供较为丰富的肿瘤,为了减少出血,可将供瘤血管电凝切断,在进行瘤内分块切除。
1.2.2 观察组 该组患者实施MRS联合FL导航手术。术前行MRS检查,采用二维点分辨波谱分析法,参数设置:TR 2 000 ms,TE 144 ms,翻转角90°;选择性水激发水抑制技术,二次激发角300,半高全宽32 Hz,水抑制带宽140 Hz,水抑制率>96%。视野120 mm×120 mm~140 mm×140 mm,成像时间286 s,重建矩阵512×512。数据后处理,增强后横断面T1WI将肿瘤实质、强化边缘、周围水肿组织作为感兴趣区(ROI),对侧正常脑组织作为对照区,测量胆碱(Cho)、肌酸(Cr)、N-乙酰天冬氨酸(NAA)峰下面积,分别计算Cho/NAA、Cho/Cr、NAA/Cr值。术前24 h予以20%FL(生产企业:广州白云山明兴制药;3 mL:600 mg;国药准字:H44023400)皮试,0.5 mL稀释至3%,深静脉推注5 mL,无皮疹或生命体征异常者,稀释至1%,3 mg/kg静脉推注;FL推注后60 min,常规开颅,暴露肿瘤,调节手术室灯光,至最佳荧光效果。激发状态下,采用附YELLOW 560 nm滤光片的手术显微镜观察肿瘤以及周围水肿组织,若荧光显影肿瘤边界清晰,在显微镜下直接切除,若肿瘤边界分辨困难,根据MRS确定的肿瘤范围切除,瘤腔边缘多点冰冻活检,若病理提示有残余,则对荧光部分继续切除,至荧光消失;所有患者术后进行4~6周期的放疗联合替莫唑胺同步化疗。
1.3 观察指标与评价方法 比较两组患者围术期指标(手术时间、住院天数),肿瘤切除率,术后肢体功能运动情况,术后3个月、6个月、12个月生存质量评分,以及术后随访情况。①切除率:术后48 h内强化MRI扫描,根据残余肿瘤体积计算肿瘤切除率,残余肿瘤体积小于术前的10%判定为全切。肿瘤体积=肿瘤和水肿体积总和水平位垂直经线长度×肿瘤和水肿体积总和的水平位最大直径×肿瘤和水肿体积总和冠状面最大高度。②生存质量[4]:采用卡氏功能状态评分(KPS),从日常生活能力、工作能力评估患者术后生存质量,评分范围0~100分,分值越高,表明患者生存质量越佳。KPS评分<60分为依赖级,表示日常生活无法自理,需要别人照护;60~80分为半依赖级,表示生活部分自理;81~90分为非依赖级,表示生活可基本自理;91~100分,表示患者功能状态可适应日常生活。③术后随访:放化疗结束后,每3个月进行影像学随访,若患者出现复发症状则需即刻进行影像学复查,由MRI增强扫描或二次手术病理判断肿瘤复发情况。残余肿瘤体积增加或出现大于0.175 cm3的新肿瘤病灶即定义为肿瘤进展。患者死亡则随访截止。比较两组患者肿瘤无进展生存时间(PFS)以及1年生存率。
1.4 统计学方法 应用SPSS17.0专业统计学软件分析数据,计数资料以百分率表示,组间比较采用χ2检验,计量资料以均数±标准差(x-±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的围术期指标比较 两组患者的手术时间比较差异无统计学意义(P>0.05),但观察者患者的住院天数明显短于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者的围术期指标比较(±s)

表2 两组患者的围术期指标比较(±s)
观察组对照组t值P值51 29 4.97±0.16 4.91±0.95 0.442 0.660 17.22±0.85 24.68±0.73 39.650<0.05
2.2 两组患者的手术切除率和术后肢体功能运动情况比较 观察者患者的肿瘤全切率明显高于对照组,术后偏瘫或肌力下降比例明显低于对照组,差异均有统计学意义(P<0.05),见表3。

表3 两组患者的手术切除率和术后肢体功能运动情况比较[例(%)]
2.3 两组患者术后生存质量比较 观察组患者术后3个月、6个月、12个月评分均高于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者术后生存质量比较(±s)

表4 两组患者术后生存质量比较(±s)
观察组对照组t/χ2值P值51 29 91.97±4.26 88.73±6.58 2.672 0.009 85.47±5.95 81.33±4.79 3.058 0.003 81.92±7.32 7.48±6.73 39.394 0.001
2.4 两组患者的随访情况比较 两组患者的平均PFS和1年生存率比较差异均无统计学意义(P>0.05),见表5。
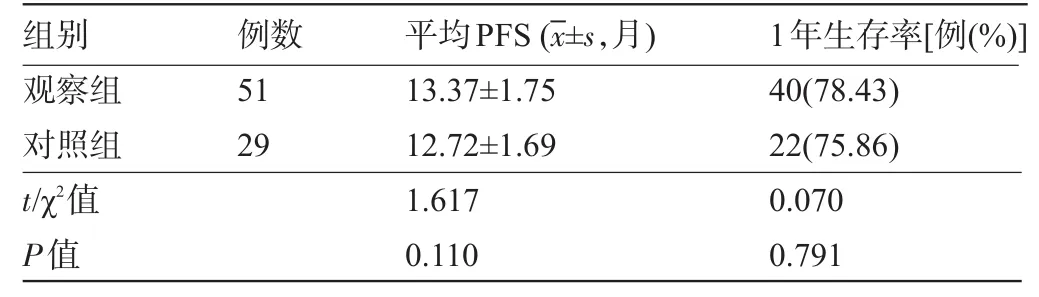
表5 两组患者的随访情况比较
3 讨论
高级别脑胶质瘤多数发生于幕上,手术切除范围是手术治疗后患者的生存期、生存质量的重要影响因素[5]。当胶质瘤侵犯重要功能区时,由于浸润性较高,难以辨认其与正常脑组织的界限,而传统神经导航定位技术易在脑组织中移位,无法准确、实时对肿瘤边界进行定位,因此手术全切率不高,且难以有效保护周围重要组织结构[6]。在保护重要脑功能区的前提下,尽可能切除肿瘤组织,是延长生存期、降低致残率、提高生存质量的重要措施[7]。
MRS技术利用化学位移以及磁共振,分析1H、31P、23Na、13C及其化合物,观察上述元素在体液、活体组织中的代谢物浓度,且化学特异性高[8]。NAA是反应神经元、轴索生存能力、密度的标记物,其波谱最高峰在白质、灰质中浓度接近,大多数颅脑损伤可见其值降低;Cr合成于肾脏、肝脏,灰质中其浓度略高于白质,属于相对稳定的脑代谢标志物,感染、肿瘤、缺氧、坏死中其浓度降低;Cho为磷脂代谢成分,白质中浓度略高于灰质,可反映细胞增殖,是细胞膜转换标志物,在创伤、肿瘤等状态下浓度升高[9]。MRS通过观察分析肿瘤组织与正常脑组织代谢物浓度、浓度比值的变化,对肿瘤进行鉴别诊断[10]。随着肿瘤级别升高,代谢逐渐增强,细胞膜转换、细胞增殖更加活跃,细胞膜合成所需Cho增加,同时神经元损伤加强,故NAA呈下降趋势,在肿瘤强化区,这些变化更为明显[11]。本研究通过分析Cho/NAA等比值变化,判断肿瘤位置,指导立体定向活检,研究中发现,在荧光强度不同的肿瘤实质中,Cho、NAA峰值不同,Cho/NAA表现出差异;而在荧光强度不同的瘤周水肿中,Cho、NAA峰值以及Cho/NAA未表现出明显差异。进一步表明:上述代谢物的代谢水平变化与胶质瘤患者血脑屏障破坏存在一定相关性;MRS可呈现胶质瘤生化代谢异常,以此发挥FL定位的作用。
FL是具有荧光特性的化合物染料,具有性质稳定、安全性高的特点。FL注射后,60%~80%在血清中与血清白蛋白结合,剩余部分是可产生强烈荧光的游离荧光素[12]。当胶质瘤侵袭性生长,破坏血脑屏障后,FL通过受损的血脑屏障,进入被肿瘤侵袭的脑组织,发出黄色的荧光,在显微镜下可清晰辨别肿瘤边界,指导术中肿瘤切除[13]。本研究行FL静脉注射后,肿瘤组织被染色,显微镜下可观察到肿瘤组织从中心向四周,颜色依次呈现深黄、黄绿、淡黄的明显变化,肿瘤边界更加清晰、明确,以此确定肿瘤切除范围,经术后病理证实,病理检测与染色组织相吻合。另外,本研究根据FL荧光染色强度,联合MRS定位的ROI等信息,分辨肿瘤边界,确定手术切除范围。手术切除过程中,脑叶塌陷可能导致脑移位,造成肿瘤与影像位置偏差,为了尽可能缩小荧光边界与肿瘤代谢边界之间的偏差,术中仍根据荧光染色强度确定切除强度,并将白光下正常脑组织与肿瘤组织质地差异作为参照[14]。本研究选择低剂量FL,并在YELLOW 560 nm滤光片下观察肿瘤组织,术中显示亮度足够且持久。研究结果显示,观察组患者肿瘤全切率高于对照组,术后偏瘫或肌力下降比例低于对照组,住院时间短于对照组,且术后3个月、6个月、12个月评分均高于对照组,表明肿瘤负荷减小后,患者术后生活质量得以显著改善。
MRS联合FL导航手术可提高全切率,但目前尚无证据证实其显著延长幕上高级别胶质瘤生存期的作用。洪健等[15]的研究实施20 mg/kg FL引导下的显微外科手术,结果显示全切率显著提升,但预后与非FL组无明显差别。而本研究随访结果显示,两组患者PFS、1年生存率差异无统计学意义,但考虑到12个月的随访时间较短,尚不足以明确得出结论,受限于随访时间,本研究未纳入更长期的生存指标,后续将进一步完善。
