高产岩藻黄素的海洋硅藻筛选及光照条件优化
2020-08-07侯红焰向威鹏张金荣程鹏飞周成旭
侯红焰 向威鹏 张金荣 程鹏飞 周成旭
(宁波大学食品与药学学院,浙江省海洋生物重点实验室,宁波大学李达三叶耀珍伉俪李本俊海洋生物医药研究中心,宁波 315211)
岩藻黄素(Fucoxanthin)是类胡萝卜素中最丰富的一种化合物,它的产量占类胡萝卜素总产量的10%以上[1]。研究表明,岩藻黄素具有高度独特的结构,在多烯链中既含有环氧键、羟基,又含有烯丙键(碳碳双键)和共轭羰基(碳氧双键)[2,3]。这些结构赋予了岩藻黄素抗氧化[3,4]、抗炎[5,6]、抗癌[7,8]等多种生物活性。
在工业生产中,岩藻黄素主要来源于海带(Laminaria japonica)、裙带菜(Undaria pinnatifda)以及羊栖菜(Hizikia fusiforme)等大型藻类[9],但其中岩藻黄素含量较低。另一方面,大型海藻多在开放的自然海区养殖,受海域、季节变化以及养殖海域的水质等因素的影响[10],大型海藻来源的岩藻黄素质量和产量相对不稳定。这些特点都阻碍了大型海藻在岩藻黄素方面的生产应用[10,11]。
海洋硅藻在海洋环境中分布广泛,是现代海洋中生物量最为丰富的微型藻类,具有极高的生物多样性[12]。硅藻中岩藻黄素含量约占干重的0.22%—2.17%,高于大型海藻含量的4倍以上[13—15],是岩藻黄素生产的重要来源[1]。而且,硅藻具有易于培养、生长速度快、生长环境可控等优势[16—18]。因此,硅藻在岩藻黄素的工业化清洁生产中有着巨大潜力[19],被认为是潜在的替代大型海藻的岩藻黄素生产者[20]。
类胡萝卜素的产生一般与环境条件有关,例如受到光照强度的影响[21]。光照强度的增加会导致微藻中采光色素含量的降低[21]。臧正蓉等[22]在对三角褐指藻(Phaeodactylum tricornutum)和球等鞭金藻(Isochrysis galbana)生产岩藻黄素的研究中发现,90 μmol/(m2·s)和红光条件可促进三角褐指藻的生长以及提高三角褐指藻的岩藻黄素含量,90 μmol/(m2·s)和绿光条件可促进球等鞭金藻的生长以及提高岩藻黄素的含量。同时,不同地域来源的藻株,岩藻黄素含量存在差异。Wu等[23]对六株不同来源的三角褐指藻的研究中发现,来自福州海岸的三角褐指藻中岩藻黄素的产量最高。硅藻岩藻黄素是一种重要的光合色素,位于岩藻黄素-叶绿素a蛋白复合体上,作为天线色素将激发能转运到叶绿素[24]。岩藻黄素可以将高达60%的能量转移到叶绿素a中[24]。不同藻株、不同环境条件,均可导致色素组成含量的变化[25—27]。可见,硅藻的生长和岩藻黄素含量在不同种类、藻株之间存在很大差异,并且培养条件同样影响其岩藻黄素产量。因此,有必要筛选优质藻株以及获取最优培养条件以提高硅藻岩藻黄素的产量。
本研究对16株海洋硅藻的岩藻黄素产量和得率进行测定分析,以评估同种不同株或不同种的藻株岩藻黄素生产潜能。针对其中最具高生产潜力的藻株,研究光照强度和光质对藻细胞生长过程中岩藻黄素含量的影响,以及岩藻黄素与关键光合色素叶绿素a和β-胡萝卜素的消长关系,为筛选岩藻黄素优质藻株及其优化生产工艺提供参考。
1 材料与方法
1.1 藻种的来源
本实验所采用的藻种均为宁波大学海洋微藻藻种库保存硅藻,具体种属及库存种质编号如表1所示。

表 1 实验用藻种种名及库存编号Tab.1 Algal cultures and the stock codes in Microalgae Collection Center in Ningbo University (MCCNBU)
1.2 不同藻株岩藻黄素提取率和含量分析
藻株培养与生物质收集本实验选取的16株海洋硅藻均采用f/2培养基。在逐级扩大预培养基础上,将生长至指数期的微藻接种到5000 mL三角瓶中进行定量培养,水体总体积4000 mL,各三组平行。在温度为(23±1)℃、光照强度50 μmol/(m2·s),光照周期为L∶D=12h∶12h的条件下培养8d,每天人工摇瓶2次。
生长至平台期的藻液,4℃、8000×g离心20min(冷冻离心机,天美科学仪器有限公司,中国),去上清液,收集藻细胞于-80℃冰箱中保存。将样品真空冷冻干燥48h,获得干燥的藻粉(冷冻干燥机,Labconco,USA)。
岩藻黄素的提取为了克服丙酮或其他有机溶剂不可在食品原料生产中使用及其易制毒和易残留等缺点,本研究利用无水乙醇作为提取溶剂。将实验所得硅藻藻粉每份均匀称取0.1 g,按照10 mL/g的料液比比例向收集的藻粉中加入无水乙醇充分震荡,使藻细胞与提取液充分接触,在25℃水温、超声条件下破碎细胞5min。4℃,12000×g离心10min(离心机,Eppendorf AG,Germany),获得岩藻黄素第一次提取液,将所得提取液分装到对应EP管中。向离心后离心管中的沉淀再次加入1 mL无水乙醇重复以上操作,得第二次提取液。
岩藻黄素检测用岩藻黄素标准品(Sigma,USA),采用LC-MS(ACQUITY UPLC I-Class,Waters,USA;Waters XEVO-TQD,Waters,USA)方法,使用ZORBAX SB-C18色谱柱(Waters BEH Amide 1.7 μm 2.1×100 mm,Waters,USA)。液相色谱中(表2),流动相A: 5 mmol/L乙酸铵-水溶液,流动相B: 乙腈,等度洗脱A%=2%、B%=98%,流速: 0.30 mL/min,运行时间: 5min,柱温: 30℃,进样量: 2 μL,检测波长: 450 nm。质谱采用ESI-正离子模式,毛细管电压: 3.50 kV,锥孔电压: 30.00 V,二级锥孔萃取电压: 3.00 V,源温度: 150℃,脱溶剂气温度: 400℃,气帘气流量: 50 L/Hr,脱溶剂气流量: 900 L/Hr。绘制岩藻黄素的标准曲线。在实验质量浓度范围内,峰面积与质量浓度呈良好的线性关系。
1.3 光强和光质对牟氏角刺藻累积岩藻黄素的影响
本研究选取一株牟氏角刺藻(Chaetoceros muelleri,编号4,库存编号: NMBguh003-11)进行光强和光质影响硅藻岩藻黄素含量变化的研究,同时分析两种重要光合色素(叶绿素a和β-胡萝卜素)含量的变化。
实验设置将预培养至指数期的实验微藻接种于f/2培养基中,起始密度约1.34×104cells/mL,于250 mL三角瓶中培养,藻液总体积200 mL。白色荧光灯光源(T8),设置低50 μmol/(m2·s)、中100 μmol/(m2·s)、高200 μmol/(m2·s)三个光照强度。以LED光源设置单色红、蓝光质实验组,光照强度50 μmol/(m2·s)。全部顶部给光,光照周期为L∶D=12h∶12h。培养温度(23±1)℃。每天人工摇瓶2次。分别在第1、第2、第4、第6、第8天取样以血球计数板检测藻细胞数。光强实验组在培养第2和第6天时、单色光质实验组在培养第4和第8天时,各实验组取10 mL藻样,以玻璃纤维滤膜(GF/F)过滤,避光保藏于-80℃冰箱中,用于分析三种藻色素(岩藻黄素、叶绿素a和β-胡萝卜素)含量。
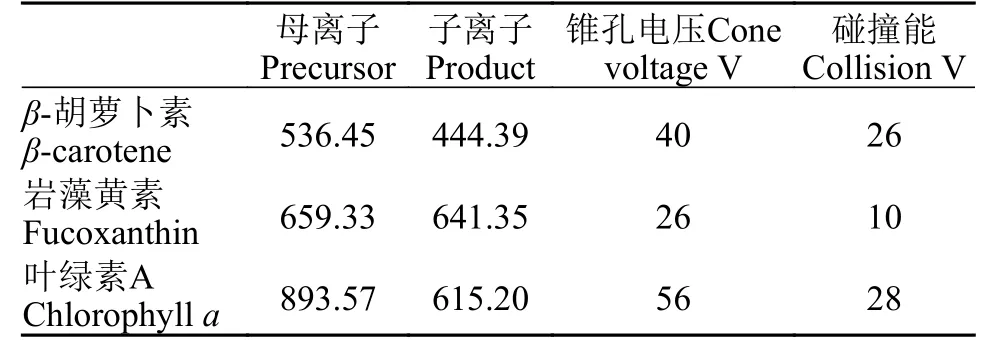
表 2 质谱中MRM参数Tab.2 MRM parameters in mass spectrometry
光合色素分析用岩藻黄素、叶绿素a和β-胡萝卜素标准品(Sigma,USA),同上文检测岩藻黄素含量的方法,制作标准曲线,根据标准曲线测得色素峰面积,计算得出不同色素含量。
1.4 数据分析
第一次提取和第二次提取所得岩藻黄素的提取率来评价提取方法的可行性,并以两次提取岩藻黄素的干重含量和提取率来确定干藻粉中岩藻黄素的真实含量,根据对不同硅藻的提取率和岩藻黄素含量分析。
提取率:X(%)=(1-m2/m1)×100%;
干重含量=m1+m2;
实际含量(mg/g)=m1/X
细胞增殖速率rt=ln(Nt-N0)/t式中,X为提取率;m1为第一次提取,岩藻黄素的得率;m2为第二次提取,岩藻黄素的得率;rt为细胞增殖速率;Nt为t时间点的细胞密度;N0为起始细胞密度;t为培养时间间隔。
数据采用Origin 2019软件进行制图,采用SPSS 13.0单因素方差分析(One way ANOVA)执行显著性差异分析。
2 结果
2.1 不同藻株岩藻黄素提取率和含量分析
相同条件下培养增殖并在相同时期收集的16株硅藻,其岩藻黄素的提取率和岩藻黄素的含量具有较大的差异(表3)。直链藻和双尾藻(编号分别为13和14)的提取率最高,达89%以上。而一种角刺藻(编号为7)的提取率小于1%。对同种硅藻而言,不同株牟氏角刺藻(编号1—5)的提取率也存在差异,其提取率在20%—85%,分析检测的岩藻黄素含量为1.3—2.3 mg/g,按提取率及实测黄素含量估算的实际含量在1.3—5 mg/g。岩藻黄素的含量在不同种类的硅藻,以及同种不同株之间都存在较大差异。在此实验中我们认为提取率大于80%为有效的提取方法。综合考虑微藻增殖速率、岩藻黄素含量以及提取率大于80%方法标准,选取牟氏角刺藻(藻株编号4),作为后续研究的藻株。

表 3 不同硅藻岩藻黄素的提取率和含量比较Tab.3 Extraction rates and content of fucoxanthin in different strains of diatom
2.2 光照对牟氏角刺藻细胞增殖和色素变化的影响
光强对藻株生长及光合色素变化的影响 牟氏角刺藻在高200 μmol/(m2·s)、中100 μmol/(m2·s)、低50 μmol/(m2·s)三种光强下平均增殖率为分别为0.082、0.067和0.068/d,无显著性差异(P<0.05),培养一周(第6天)后进入平台期,其最大生物量平均
3.4×104cells/mL(图1A)。
分别取培养初期(2d)和平台期(6d)的藻样,测定岩藻黄素、叶绿素a及β-胡萝卜素三种色素的单细胞含量。如图1B所示,比较培养初期和平台期色素变化: 在低光照下,叶绿素a、岩藻黄素和β-胡萝卜素的含量在培养初期和平台期均没有显著差异(P<0.05)。在高、中光强下,叶绿素a的含量在培养初期高于平台期;β-胡萝卜素含量在平台期高于培养初期;岩藻黄素含量则没有显著差异。比较不同光强下的各色素变化,在低光强下,岩藻黄素的含量为1.2×10-2ng/cell均高于较高光强;中、高光照条件下没有显著差异,平均含量为8.0×10-3和7.1×10-3ng/cell。β-胡萝卜素的含量随着光照强度的升高而增加,高光照强度下平台期单位细胞含量为4.0×10-4ng/cell,较起始增加111.2%。叶绿素a单细胞含量,在培养初期随着光强增加而增加,培养平台期不同光强下无显著差异。
从岩藻黄素和β-胡萝卜素分别相对于叶绿素a的比值变化来看(图1C),两个比值在平台期均较培养初期显著增加,但随光强增强,该比值增加的幅度不同: 岩藻黄素与叶绿素a的比值随光强增加其增幅降低,从786.7%降至184.7%。β-胡萝卜素与叶绿素a的比值随光强增加其增幅增加,从3.6%增加到10.4%。平台期时,在低光照条件下岩藻黄素相对于叶绿素a的比值最高(786.7%),β-胡萝卜素相对于叶绿素a的比值最低(3.6%)。
光质对藻株生长及光合色素变化的影响如图2所示,在蓝光下的生长相对稳定,4d增殖速率为0.049/d,平台期维持时间长(图2A);而在红光条件下,培养初期增殖相对较快,4d增殖速率为0.095/d,但平台期维持时间相对短。在相同光强下,红光最大生物量出现在第4天,为3.3×104cells/mL,蓝光最大生物量在第8天,为3.0×104cells/mL。
分析红、蓝单色光质条件下进入平台期后的单位细胞色素含量变化结果显示(图2B),三种色素的含量在生长平台期维持过程中,均出现上升的特征。在红光条件下,岩藻黄素、叶绿素a和β-胡萝卜素分别上升89.0%、542.8%和1686.3%;在蓝光条件下,分别上升195.1%、651.5%和368.6%。岩藻黄素与叶绿素a在红光条件下上升幅度高于蓝光组,产量也高于蓝光组。β-胡萝卜素在蓝光条件下上升幅度高于红光组,产量也高于红光组。红光组和蓝光组比较,平台初期,红光组的岩藻黄素较蓝光组高,平台后期两组没有显著差异;蓝光组的β-胡萝卜素含量均高于红光组。
从岩藻黄素和β-胡萝卜素分别相对于叶绿素a的比值来看(图2C),前者的比值在平台维持期显著降低,β-胡萝卜素与叶绿素a的比值变化没有显著性差异(P<0.05)。
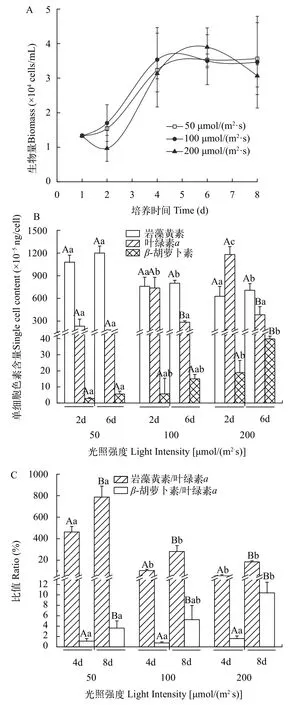
图1 不同光照强度对牟氏角刺藻的影响Fig.1 Ef fects of different illumination intensitice on Chaetoceros muelleri
3 讨论
岩藻黄素是硅藻中最丰富的类胡萝卜素之一,具有丰富的生物活性。优化岩藻黄素提取工艺是实现大规模生产的关键过程之一。在工业化生产中,以食用级乙醇作为提取试剂,能满足食品安全或化妆品生产中对清洁生产的要求。在本研究中,用乙醇提取不同株硅藻的岩藻黄素,检测结果表示不同株硅藻中岩藻黄素含量差异较大,从无法计算(一种角毛藻Chaetocerossp.)到高达5.0 mg/g(两种角毛藻:C. debilis和C. muelleri)。实验组中最高含量与Foo等[28]使用甲醇提取角毛藻(C. calcitrans)中的岩藻黄素含量相近[(5.3±0.03) mg/g]。在Kim等[29]的研究中,乙醇提取三角褐指藻(P. tricornutum)的岩藻黄素的提取产率最高,为15.7 mg/g。但Foo等[30]的研究表明,与其他微藻(如角毛藻C. calcitrans和球等鞭金藻I. galbana)相比,三角褐指藻中提取的岩藻黄素仅为0.07 mg/g,且检测其总提取物的抗氧化活性最小。可见,在不同的研究中,微藻岩藻黄素含量、提取率及生物活性都可能存在显著差异。因此,典型藻株岩藻黄素累积的生物学机制研究是生产工艺优化的基础。

图2 不同光质对牟氏角刺藻的影响Fig.2 Effects of different light on Chaetoceros muelleri
影响微藻生理生化的一个关键因子——光强作为重要的光合色素之一,岩藻黄素与藻类生长、培养条件及光合系统调节过程都密切相关,光强是关键调节因子之一。本研究显示,在相对低光强条件下[50 μmol/(m2·s)],牟氏角刺藻岩藻黄素累积最高。Song等[9]发现,在长耳齿状藻(Odontella aurita)中与较高光强[300 μmol/(m2·s)]相比,在较低的光强[100 μmol/(m2·s)]下具有较高的岩藻黄素产生。Li等[31]的研究表明,高光强抑制了湛江等鞭金藻(Isochrysis zhangjiangensis)中岩藻黄素的积累,而低光强促进了其中岩藻黄素的产生。Guo等[32]在三个光照条件下研究小环藻(Cyclotella cryptica),结果也发现,相对低光强下岩藻黄素含量最高。岩藻黄素含量受光强影响含量相对变化的特点,与藻色素受光调节合成代谢相关。紫黄素是合成岩藻黄素的重要前提物质[33,34],在强光照射下,为了提供有效的光保护,硅藻会把紫黄素转化为玉米黄素,通过非光化学过程(叶黄素循环)耗散多余的光能[35,36],这也就降低了岩藻黄素的产生。而在低光照下,碳骨架会转换成3-磷酸甘油醛并转入类胡萝卜素,尤其是岩藻黄素中。因此,藻株培养过程中营养盐充足且光照条件较弱的情况下岩藻黄素的富集量较高[37]。本研究结果显示,在三种光强下,培养初期和平台期的岩藻黄素含量并没有显著差异。显然,两个生长期的营养盐水平是有差异的。因此,除藻株因素之外,光强是影响岩藻黄素含量变化的关键因子。
不同藻种或不同藻株的岩藻黄素含量受光强影响下的相对变化,还与各研究所设置的光照强度区段相关。在本研究中,最低光强[50 μmol/(m2·s)]下岩藻黄素的含量最高,但在100和200 μmol/(m2·s)的光强下,单位藻细胞的岩藻黄素含量没有显著差异。而Mcclure等[21]的研究显示,在此高光强区间,三角褐指藻的岩藻黄素含量仍然是比相对较低的光照条件下含量高。Guo等[32]以黑暗条件下培养为对照组发现,小环藻在10—30 μmol/(m2·s)的光照强度促进岩藻黄素积累,而40 μmol/(m2·s)对于岩藻黄素的积累没有有益效果。当光照强度低于50 μmol/(m2·s)[例如10—40 μmol/(m2·s)]或者高于50 μmol/(m2·s)时,硅藻中岩藻黄素含量随光照强度的增加而降低。
在本研究中,岩藻黄素、叶绿素a以及β-胡萝卜素在不同光强条件下的消长,反映了微藻在光能适应中的调节特征。叶绿素a与β-胡萝卜素在本实验的最高光照强度50 μmol/(m2·s)下含量最高。β-胡萝卜素通常被认为是岩藻黄素生物合成的前体物质,但两者尚未发现直接的定量相关关系。岩藻黄素和叶绿素a一起构成了硅藻重要的光合作用捕光色素,在光系统光收集复合物中进行光收集和能量传递[37]。微藻通过调节各色素的含量实现对光合作用有效光能的充分利用和抗逆保护。例如,硅甲藻黄素(Diadinoxanthin)和硅藻黄质(Diatoxanthin)的二氨基黄素循环是微藻的短期光保护机制[38]。两种叶黄素的含量变化随光强的增加而增加[32]。Erdoğan等[39]的研究发现,在氧化应激的作用下新月菱形藻(Cylindrotheca closterium)中的岩藻黄素含量增加了50%以上。因此,以培养海洋硅藻进行岩藻黄素的规模化生产,尚需对多因子综合影响的色素调节过程进行系统研究,以获得最优培养工艺。
影响微藻生理生化的一个关键因子——光质 光质是环境光照影响微藻生理生化过程的另一个关键因子。在本研究中,牟氏角刺藻岩藻黄素的含量在红光条件下远远高于蓝光。臧正蓉等[40]研究也显示,通过红光光照能够使三角褐指藻细胞中的岩藻黄素产量提高。在红光下,叶绿素a的含量也较蓝光下高。岩藻黄素以吸收光合作用有效光谱中的蓝光为主,在单色红光条件下,岩藻黄素与叶绿素a含量增加,可能是微藻对能量较低的红光波长需增大吸收强度。与本研究中光强影响不同,在单色红光或蓝光下,平台前期和平台后期营养盐差异可能导致藻细胞色素的累积差异。平台后期较平台前期,岩藻黄素和叶绿素a的含量均显著增加。研究结果不仅说明单色红光利于岩藻黄素的累积,而且在该条件下,营养盐胁迫可能提高岩藻黄素的累积。在藻细胞的培养过程中,单色蓝光条件下β-胡萝卜素富集[41,42],与β-胡萝卜素具有光保护作用相关。
规模化生产微藻中重要色素时(如β-胡萝卜素和虾青素的工业生产),常常面临的一个问题是最适细胞生长的培养条件与最适色素累积的培养条件的矛盾。因此,工业上常采用两步法生产工艺。在第一阶段,微藻在最佳条件下生长,以使生物量最大化;而在第二阶段,使微藻生长受到胁迫以利于目标色素的累积。目前,以微藻为培养目标生产岩藻黄素尚未实现工业化生产。本研究显示,规模化培养至高密度时,藻细胞间的遮光会利于岩藻黄素的累积,此为工业化生产微藻岩藻黄素的一大优势。针对典型藻株进行培养时,以最适生长的光强进行增殖培养,以平台期低光照或红光胁迫,还可能进一步实现生产工艺优化。本研究关于三种关键光合色素的消长特征还显示,可能叶绿素含量低的藻株更能积累岩藻黄素,并且叶绿素含量低的藻株很可能更容易高密度培养。此结果提示了微藻岩藻黄素优势藻株的筛选和种质创制的研究目标。
4 结论
本研究对16株海洋硅藻岩藻黄素含量进行了分析,发现不同种或同种不同株的硅藻,即使在完全相同的条件下,其提取效率具有差异,从而导致对含量评价的差异。对一株提取率大于80%的牟氏角刺藻进行了光强和光质条件对重要光合色素影响的分析,证明了低光照和红光条件是硅藻累积生产岩藻黄素的关键因子。本文为后续筛选素优质藻株、岩藻黄素的提取和分析以及累积生产工艺优化提供了参考。
