好氧反硝化细菌的鉴定及其脱氮特性研究
2020-08-07龚望宝王广军余德光李志斐田晶晶
朱 云 龚望宝 谢 骏 王广军 余德光 李志斐 张 凯 田晶晶
(1.中国水产科学研究院珠江水产研究所,农业农村部热带亚热带水产资源利用与养殖重点实验室,广州 510380;2.上海海洋大学,水产与生命学院,上海 201306)
随着我国水产养殖业的快速发展,养殖方式从传统粗放型向现代规模化、集约化转变[1],养殖过程中营养物质的高投入,导致池塘养殖内源氮素污染严重,不仅会恶化水质,致使养殖动物疾病暴发,养殖产品质量和产量下降,而且氮素超标严重的养殖尾水排放会导致江河水域环境的污染。因此,如何降低池塘养殖水体中氮素污染成为水产养殖领域的热点问题。生物脱氮以无污染、高效率的优点被认为是去除水体中氮素的有效途径之一[2]。传统的生物脱氮理论认为反硝化是严格厌氧的过程[3],氧气会抑制反硝化还原酶基因的表达和反硝化还原酶的活性,不能发挥微生物脱氮的作用。
20世纪80年代,Robertson和Kuenen[4]首次成功分离出了一株细菌Thiosphaera pantotropha(现命名为Paracoccussp.),报道了该菌能够在好氧条件下进行反硝化作用,并将此现象命名为好氧反硝化。Bell等[5]对Paracoccussp.的反应机理开展了进一步研究,结果表明,好氧反硝化的发生是由于细胞内存在的好氧反硝化作用酶系。好氧反硝化细菌能够在有氧的环境中将NO-N和NO-N还原为N2,这就为生物脱氮提供了崭新的思路[6]。此后,越来越多的好氧反硝化细菌从不同的环境中分离出来,如粪产碱菌(Alcaligenes faecalis)[7]、假单胞菌(Pseudomonadaceae)[8]、不动杆菌(Acinetobacter)[9]、丛毛单胞菌(Comamonas)[10]、红球菌(Rhodococcus)[11]、芽孢杆菌(Bacillus)[12]和副球菌(Paracoccus)[13]等,其中以假单胞菌属最多[14—17]。好氧反硝化细菌的发现,为现有的养殖池塘水体中氮素的去除工艺提供了新的研究方向。
本研究从广东省中山市草鱼养殖池塘水体中分离出一株高效好氧反硝化细菌ZS1,对该菌株进行形态观察、生理生化特性和16S rDNA基因序列分析,探究了该菌株在好氧条件下的脱氮特性以及不同环境因子对菌株ZS1脱氮效率的影响,以期为养殖池塘尾水处理系统的生物脱氮技术工艺提供理论支持及初步的候选菌株。
1 材料与方法
1.1 池塘条件及样品采集
本实验在广东省中山市某养殖场进行,池塘面积约10000 m2,水深1.8 m。该池塘采用轮捕轮放的生态养殖技术,三年不换水,其中主养草鱼密度为30000 尾/hm2,规格为1000 g/尾。
采样时间为2018年3月20日,养殖水温24.3℃,溶氧为4.5 mg/L,pH为7.7。上午10点用采水器5点采样法取池塘水样装于无菌水样袋中,置于4℃冷藏箱中,并立即带回实验室进行菌株的富集和分离。
1.2 培养基
(1)基础富集培养基: 酵母浸膏5 g,蛋白胨10 g,NaCl 5 g,pH=7。
(2)反硝化富集培养基[18]: 酵母浸膏3.0 g,蛋白胨5.0 g,KNO3l.0 g,蒸馏水1000 mL,pH=7.0—7.6。
(3)溴百里酚蓝(BTB)培养基: KNO31.0 g,C6H5Na3O21.0 g,KH2PO41.0 g,FeSO4·7H2O 0.05 g,CaCl20.2 g,MgSO4·7H2O 1.0 g,1%的溴百里香酚蓝 1 mL,蒸馏水999 mL,pH=7.2。
(4)反硝化性能测定培养基: CH3COONa 2.56 g,KNO30.361 g,MgSO4·7H2O 0.2 g,KH2PO4l.0 g,K2HPO45.0 g,NaCl 0.5 g,微量元素溶液1 mL,蒸馏水999 mL,pH=7.4。
(5)微量元素溶液: EDTA 50 g,CaCl25.5 g,ZnSO42.2 g,MnCl2·4H2O 5.06 g,FeSO4·7H2O 5.0 g,(NH4)6MO7O2·4H2O 1.1 g,CuSO4·5H2O 1.57 g,CoCl2·6H2O 1.61 g,蒸馏水1000 mL,pH=7.0。
1.3 菌株的富集、分离和筛选
将养殖场采集的水体10 mL放入装有90 mL反硝化细菌富集培养基的250 mL锥形瓶中,在摇床上培养(180 r/min,30℃)。24h后,取菌悬液体1 mL,放置到9 mL无菌水的离心管中,混合混匀,然后用涂布平板10倍稀释法分离好氧反硝化细菌。将平板长出的菌落进行3 次纯化,得到纯菌。
挑取纯化后的纯菌株单菌落至液体反硝化富集培养基中至其长到对数期,将其稀释为细菌浓度为4×108cfu/mL的菌悬液,取1 mL菌悬液接种到装有100 mL液体培养基的250 mL 锥形瓶中,放置在摇床中培养(180 r/min,30℃),24h后测其NO-N和TN的去除效率,并选取NO-N去除效率在90%以上且总氮去除效率在60%以上的菌株开展进一步分析,共分离得到89株反硝化细菌,其中菌株ZS1脱氮性能最优,使用甘油法[19]将ZS1置于-80℃保存待用。
1.4 菌株的鉴定
从形态学、生理生化和16S rDNA三方面对菌株进行鉴定。
扫描电镜(SEM)观察: 取菌液体1.5 mL在1000 r/min 条件下离心10min,使用3%的戊二醛溶液固定24h后,通过扫描电镜(JSM-5800,Japan JEOL)拍摄观察菌株形态,在广东省微生物分析检测中心测定分析。
采用细菌基因组DNA试剂盒(Omega,USA)提取菌株ZS1 的DNA,然后以其为模板进行PCR扩增,选用细菌通用引物[20],上游引物为27F(5′-AGAG TTTGATCCTGGCTCAG-3′),下游引物为1492R(5′-TACGGCTACCTTGTTACGACTT-3′)。PCR扩增反应体系为: DNA模板1 μL,TaqDNA聚合酶25 μL,27F引物 (10 μmol/L) 1 μL,1492R引物 (10 μmol/L)1 μL,ddH2O(22 μL)。将PCR反应体系充分混合均匀后,在PCR扩增仪(Heal Force,T960,杭州)上进行PCR反应,反应条件为: 94℃预变性5min,94℃变性1min,56℃退火1min,72℃延伸2min,共30个循环,最后72℃延伸8min,4℃ forever。PCR扩增产物 (约1400 bp) 经1.5%琼脂糖凝胶电泳(EB染色) 确定条带后,送至上海美吉生物公司进行测序分析,将16S rDNA基因序列在GenBank核酸序列数据库中进行同源性比较,以Neighbor-Joining法构建系统发育树。
1.5 菌株ZS1好氧反硝化性能测定
将活化好的菌液按体积比1%接种到以KNO3为唯一氮源的反硝化培养基的锥形瓶中,培养基的初始pH为7.4,碳源为乙酸钠,C/N为15,培养条件为温度30℃,转速180 r/min,设3组平行,置于恒温振荡培养箱中培养48h,每隔6h取样监测菌株的生长、TN、NO-N、NO-N等指标,分析菌株ZS1的反硝化性能。
1.6 不同环境因子对菌株ZS1的脱氮影响
向装有100 mL已灭菌的反硝化培养基的三角瓶中接入菌株ZS1,研究不同温度(20、25、30、35、40℃)、C/N值(5、10、15、20、25)、初始pH(6、7、8、9、10、11)、摇床转速(0、50、100、150、200 r/min)和碳源种类(柠檬酸钠、乙酸钠、丁二酸钠、蔗糖、葡萄糖)对菌株ZS1反硝化特性的影响。以上处理的基本条件为: 温度30℃、初始pH 7.4、C/N为15、初始悬浮液NO-N含量为50 mg/L、摇床转速为180 r/min、碳源为乙酸钠、KNO3为唯一氮源。然后将其中一种条件改变,其余反应条件与基本条件相同,培养24h后,测定培养基中菌株ZS1的生长、NO-N、NO-N和TN的浓度,并计算NO-N和TN的去除率。
1.7 分析方法
在本研究中,NO-N的测定采用N-(1-萘基)乙二胺光度法,NO-N的测定采用麝香草酚分光光度法,TN的测定采用碱性过硫酸钾氧化紫外分光光度法,菌株的生长采用光度比浊法,用紫外可见分光光度计于600 nm处测量吸光度值(TU-1810,北京通用),pH采用pH计(pHB-3,上海)测定,所有样品均测定3次,取平均值。脱氮率计算方法[21]如下:
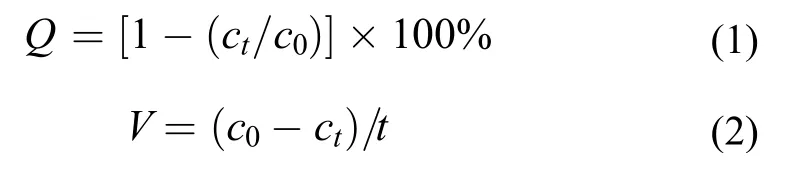
式中,Q为氮的去除率,ct为终末氮浓度(mg/L),c0为初始氮浓度(mg/L),V为氮的去除速率[mg/(L·h)],t为时间。
本研究采用Excel、MEGA7.0和Origin8.5软件对实验数据进行统计分析与作图。
2 结果
2.1 菌株的鉴定
形态特征菌株ZS1革兰氏染色反应呈阴性,生理生化特性如表1所示: 接触酶、氧化酶反应阳性;硝酸盐还原和柠檬酸盐利用阳性;七叶苷水解和明胶液化阳性;吲哚反应、V-P实验、淀粉水解、酪素水解、脲酶、ONPG试验、精氨酸双水解酶均为阴性。在基础富集培养基上培养48h后,观察到菌株ZS1的菌落形态特征为: 圆形,呈灰白色,凸起,边缘整齐。经扫描电镜观察,结果如图1所示,菌体呈杆状,长1.5—2.0 μm,宽0.7—0.9 μm,有鞭毛。
16S rDNA序列分析和系统发育分析菌株ZS1的16S rDNA基因序列长度为1333 bp,测序结果已上传至GenBank数据库,登录号为MK615112。系统发育树如图2所示,菌株ZS1与Pseudomonas furukawaii同源性达100%。结合菌株的形态学、生理生化特性和16S rDNA基因序列分析结果,将菌株ZS1确定为Pseudomonas furukawaii。
2.2 菌株ZS1的好氧反硝化特性
在以KNO3为唯一氮源的情况下,观察菌株ZS1在48h内的生长情况及好氧反硝化特性。如图3所示,在6—18h,可以观察到菌株ZS1的A600显著增加,从0.133增加到0.930;培养18h后菌体生长变缓,在18—24h生长处于稳定期;培养24h后,菌体密度呈现减小趋势,进入衰亡期。在0—24h阶段,NO-N浓度迅速下降,从48.93 mg/L降至7.32 mg/L,NO-N去除率为85.04%,去除速率达1.734 mg/(L·h);TN的含量从52.04 mg/L 降低到13.73 mg/L,去除率为73.62%,去除速率达1.596 mg/(L·h)。24h后,菌株进入衰亡期,A600开始下降,NO-N和TN浓度也趋于稳定。培养至48h时,NO-N的含量降低到1.27 mg/L,去除率达到97.40%,去除速率为0.993 mg/(L·h);TN的含量继续降低到8.40 mg/L,去除率达83.86%,去除速率达0.909 mg/(L·h),且无NO-N积累。

表 1 菌株ZS1的生理生化特性Tab.1 Physiological and biochemical characteristics of strain ZS1
2.3 不同环境因子对菌株ZS1反硝化性能的影响
不同碳源对菌株ZS1反硝化特性的影响如图4所示,不同碳源对菌株ZS1的生长及脱氮率的影响存在很大差异。在5种不同碳源下,菌株的A600均显著增多,由高到低的顺序为乙酸钠(0.930)、柠檬酸钠(0.878)、葡萄糖(0.777)、丁二酸钠(0.623)和蔗糖(0.013)。当菌株ZS1分别以5种碳源为唯一碳源时,对-N的去除率从高到低依次为乙酸钠(99.47%)、柠檬酸钠(99.39%)、葡萄糖(95.13%)、丁二酸钠(75.49%)和蔗糖(26.20%);对TN的去除率从高到底依次为乙酸钠(88.52%)、柠檬酸钠(88.31%)、葡萄糖(78.12%)、丁二酸钠(55.05%)和蔗糖(3.22%)。菌体生长情况与N和TN的去除率具有一致性,密度越大,对-N和TN的去除率就越高。当以蔗糖为碳源时,菌株ZS1几乎不能生长,TN去除率仅为3.22%。因此,在实际池塘养殖尾水生物脱氮处理中可以将乙酸钠、柠檬酸钠和葡萄糖作为菌株ZS1的最适碳源。

图1 扫描电镜下菌株ZS1的形态特征Fig.1 Morphological characteristics of strain ZS1 under a scanning electron microscope

图2 基于16S rDNA分析的菌株ZS1系统发育树Fig.2 Phylogenetic tree of strain ZS1 based on 16S rDNA analysis
不同C/N对菌株ZS1反硝化特性的影响如图5所示,菌株ZS1的A600随着C/N的增加而升高。当C/N为5时,TN和NO-N去除率均达最低值,分别为19.74%和51.28%,NO-N积累达最高值,为0.11 mg/L;当C/N从5上升至15时,TN和NO-N去除率同步上升达到最高值,分别为88.31%和99.39%;当C/N从15上升至25时,TN和NO-N去除率基本保持不变。因此,菌株ZS1发挥反硝化功能的最适C/N为15—25。
不同pH对菌株ZS1反硝化特性的影响如图6所示,当培养基的pH为6和11时,严重抑制菌株ZS1的生长,A600值仅为0.003和0.001,同时其TN和NO-N的去除率也均最低,分别为6.43%和10.16%。当pH在7—10时,菌株ZS1生长良好,A600在0.734—0.773,其对NO-N和TN的去除率较高,NO-N的去除率在99.34%—99.59%,TN的去除率在60.735%—73.77%。因此,菌株ZS1发挥反硝化功能的最适pH为7.0—10.0。
不同温度对菌株ZS1反硝化特性的影响如图7所示,当温度为20℃时,菌株ZS1的A600为0.048,几乎停滞生长。当温度上升到25℃时,NO-N和TN去除率分别为98.42%和71.98%。当温度为30℃时,NO-N和TN去除率达到最高,分别为99.18%和77.99%。当温度继续上升到40℃时,菌株的生长和
不同摇床转速对菌株ZS1反硝化特性的影响培养基中的溶解氧浓度是通过改变摇床转速来进行调控。如图8所示,随着摇床转速的升高,菌株的去氮能力逐渐加强。当转速为50 r/min时,NO-N和TN去除效率极低,分别仅有9.19%和5.03%;当转速上升至100 r/min时,NO-N和TN的去除率显著上升,分别达93.33%和78.72%;当转速继续上升至150 r/min时,NO-N和TN的去除率达最高值,分别为99.35%和83.09%;转速升高到200 r/min时,NO-N和TN的去除率保持稳定。因此,菌株ZS1发挥反硝化功能的最适摇床转速为100—200 r/min。

图3 菌株ZS1好氧反硝化特征及生长曲线Fig.3 Aerobic denitrification performance and growth curve of the strain ZS1

图4 碳源对菌株ZS1反硝化性能的影响Fig.4 Effect of the carbon source on the denitrification ability of strain ZS1
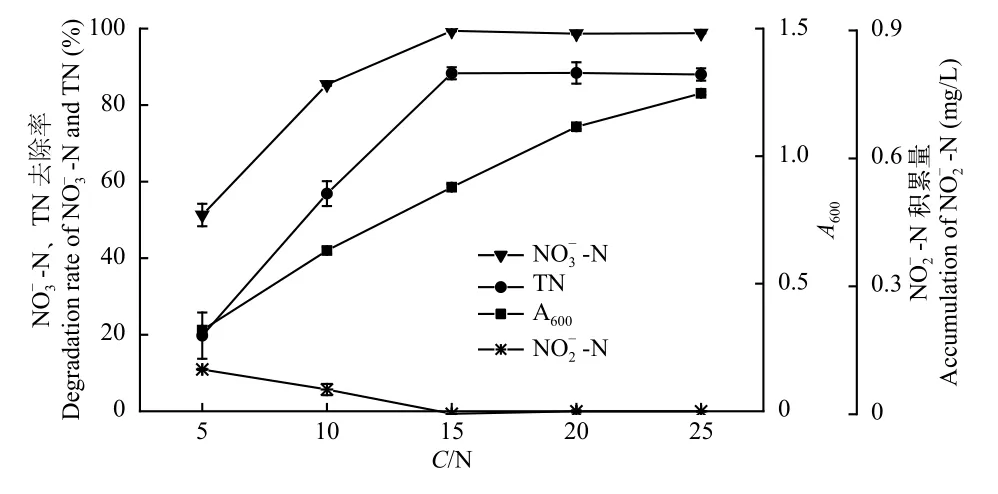
图5 C/N对菌株ZS1反硝化性能的影响Fig.5 Effect of the C/N ratio on the denitrification ability of strain ZS1

图6 pH对菌株ZS1反硝化性能的影响Fig.6 Effect of pH on the denitrification ability of strain ZS1

图7 温度对菌株ZS1反硝化性能的影响Fig.7 Effect of temperature on the denitrification ability of strain ZS1

图8 转速对菌株ZS1反硝化性能的影响Fig.8 Effect of rotation speed on the denitrification ability of strain ZS1
3 讨论
3.1 不同碳源对菌株ZS1脱氮性能的影响
有机碳源在菌株的反硝化过程中提供电子和能量,不同碳源因其化学结构和分子量的差异而对菌株的生长和脱氮效果产生不同的影响[21]。在本研究中,当菌株ZS1以乙酸钠、柠檬酸钠和葡萄糖为碳源时,菌株生长良好,具有高效的脱氮性能,其NO-N的去除率分别为99.47%、99.39%和95.13%,TN的去除率分别为88.52%、88.31%和78.12%,菌株ZSI基本不能利用蔗糖,本实验结果与修海峰等[8]、张婷月等[22]和蔡茜等[23]研究结果一致。颜薇芝等[9]发现不动杆菌YN3以葡萄糖和蔗糖为碳源时,菌株基本不增长,柠檬酸钠是其最佳碳源,氨氮去除率达到99%。这说明相对于糖类,菌株更高效利用有机酸,是因为有机酸是三羧酸循环的中间产物,能被细菌直接利用,而糖类需要先转化为有机酸再被利用。同时有机酸还能增强周质硝酸还原酶的活性[24]。反硝化反应属于氧化还原反应,不同碳源对菌株的脱氮性能产生差异,也可能与不同碳源的氧化还原电位有关[25]。
3.2 不同C/N对菌株ZS1脱氮性能的影响
C/N是菌株能否进行完全反硝化的关键因素,直接影响细菌的生长和对有机物质的去除效果[23]。大多数研究结果表明,细菌的脱氮效率会随着C/N的增大而升高,达到一定值后,脱氮效率维持稳定,继续增大C/N,脱氮效率反而会呈下降趋势[26—28]。赵丹等[29]发现假单胞菌ZD8在好氧条件下,C/N在4—22时,NO-N的去除率随着C/N增加而增强,当C/N为22时,其NO-N去除率达到最高,为99.2%,
3.3 不同pH对菌株ZS1脱氮性能的影响
培养基的pH通过影响微生物细胞膜上的电荷,从而决定微生物体内营养物质的转移方式,进而影响微生物对营养物质的吸收和转化[32]。pH过高或过低都会导致微生物酶的活性降低或丧失,从而降低菌体的反硝化活性[33]。菌株只有在最适pH下才具有快速生长和高效脱氮的能力[34]。在本实验中,pH为7—10时,菌株ZS1的脱氮性能最佳,NO-N和TN的去除率分别在99.34%—99.59%和60.73%—73.77%。目前已报道的好氧反硝化细菌中大部分菌株的最适pH为中性或偏碱性,如张淑楠等[35]从地热水中分离出的一株芽孢杆菌,生长和高效反硝化作用的适宜pH为7—8。黄廷林等[36]筛选出的贫营养菌株A14在pH为7时,对NO-N的去除效果最佳。高喜燕等[37]研究发现菌株在 pH为7.5时的脱氮率最高,但在过酸(pH<5.5) 或过碱(pH>9) 的条件下,菌株几乎不生长,脱氮性能也最低。
3.4 不同温度对菌株ZS1脱氮性能的影响
温度是影响细菌反硝化性能的重要因素之一,主要是通过影响微生物细胞结构从而影响其生长和新陈代谢[38]。许多研究证明,好氧反硝化细菌的最适温度为20—35℃,如Ye等[39]报道了菌株Providencia rettgeri strainYL的最适脱氮温度为25℃;修海峰等[8]报道德克斯氏菌株DF2的最适脱氮温度为30℃;菌株Pseudomonas stutzeriF1在温度低于20℃和高于35℃时,其生长和脱氮能力均受到抑制[40]。本实验中菌株ZS1发挥好氧反硝化性能的最适温度为25—35℃,与上述报道一致。
3.5 不同摇床转速对菌株ZS1脱氮性能的影响
本实验通过转速来调节培养基中的溶解氧,结果表明,转速过低导致培养基中的溶氧偏低,抑制了菌株ZS1的生长和脱氮性能,当转速在100—200 r/min时,菌株ZS1的生长和脱氮性能显著增加。王田野等[28]发现不动杆菌SQ2脱氮性能最佳的转速为180—220 r/min。易立等[26]报道蜡样芽胞杆菌CZ1在转速为160 r/min时,其NO-N去除率达99.29%。菌株Acinetobacter calcoaceticusN7在转速为230 r/min时,TN去除率达到最大,为89.8%[27]。本实验结果与上述报道一致,随着摇床转速的提高,培养基中的液体形成涡流,延长了空气的停留时间,加大了空气接触面积,使培养基中的溶解氧提高,满足了菌株的生长代谢,提高了脱氮过程中相关酶的合成能力,导致菌株的脱氮性能增强。因此,在实际生物脱氮处理过程中,要控制适当的溶解氧,以适合菌株的生长,从而提高菌株去氮的效率。
本研究中P. furukawaiiZS1具有高效的好氧反硝化性能,下一步需要深入开展该菌株在实际养殖水体中的应用效果以及该菌株好氧反硝化的分子机制,为池塘养殖尾水处理应用生物脱氮技术提供理论依据。
4 结论
(1)本实验从中山市主养草鱼池塘水体中分离筛选出1株具有高效好氧反硝化能力的菌株,经形态观察、生理生化特性以及16S rDNA序列分析,鉴定为Pseudomonas furukawaii,命名为P. furuka-waiiZS1。(2)经48h培养后,NO-N的含量从48.93降至1.27 mg/L,去除率为97.40%,去除速率达0.993 mg/(L·h);TN的含量从52.04 mg/L 降低到8.40 mg/L,去除率为83.86%,去除速率达0.909 mg/(L·h),且无NO-N积累。以NO-N为唯一氮源时,菌株ZS1实现最佳好氧反硝化性能的碳源为乙酸钠、柠檬酸钠和葡萄糖,温度为25—35℃,pH为7.0—10.0,C/N为15—25,转速为100—200 r/min。(3)在好氧条件下,P. furukawaiiZS1具有高效脱氮效率,该菌株为池塘养殖尾水生物脱氮处理提供初步的候选菌株。
