饲料蛋白质水平对异齿裂腹鱼生长、消化酶活性、非特异性免疫及蛋白质代谢反应的影响
2020-08-07王纤纤曾本和刘乐乐杨瑞斌刘海平
王纤纤 曾本和 刘乐乐 杨瑞斌 刘海平
(1.西藏自治区农牧科学院水产科学研究所,拉萨 850002;2.华中农业大学水产学院,武汉 430070;3.西藏自治区动物疫病预防控制中心(畜牧总站),拉萨 850000)
异齿裂腹鱼(Schizothorax),隶属鲤形目(Cypriniformes),鲤科(Cyprindiae),裂腹鱼亚科(Schizothracinae),裂腹鱼属(Schizothorax)[1],因体延长,略呈棒形,故俗称“棒棒鱼”,为我国特有的高原冷水性鱼类资源,喜急流生活[2],仅分布于西藏雅鲁藏布江中上游干支流及附属水体中,多在水质清澈、砾石底质的河道处活动,主要以刮取着生藻类为食,为产区主要经济鱼类之一[3]。然而,随着捕捞强度的增强,河流现存渔业资源量明显下降;不科学的放生习俗,导致外来物种入侵;加上异齿裂腹鱼自身分布区域狭小,性成熟年龄迟[4],生长速度和资源量增长缓慢[5],2016年异齿裂腹鱼已被列入中国脊椎动物红色名录[6],若该资源一旦受到破坏,将很难有效恢复。
近年来,学者们对异齿裂腹鱼的相关研究报道逐渐增多,主要集中在生物学特征[7—9]、行为学特性[10,11]、病理学研究[12,13]、适应性进化[14,15]、生物监测[4]、养殖开发[16,17]等方面。通过人工驯养异齿裂腹鱼开展系列研究,可保护异齿裂腹鱼的种群数量,但人工驯养异齿裂腹鱼的饲料来源亟待解决。目前,市面上还没有异齿裂腹鱼的全价配合饲料,有关其营养需求的研究报道仍属空白。
不同于畜禽,鱼类对饲料中的蛋白质需求量较高[18],鱼体体成分中蛋白质占干物质组成的65%—75%[19],且在鱼类养殖过程中,蛋白质也是饲料中最为主要和昂贵的营养成分,鱼类饲料的蛋白质水平常为25%—55%[20],可占饲料总成本的50%以上[19]。故研究者都将水产饲料的最适蛋白质需求量的确立,作为研究鱼类营养需求量的首要课题[21]。饲料中的蛋白质经鱼体消化吸收后以氨基酸的形式进入体内,能为鱼体提供合成自身蛋白质所需的氨基酸,氨基酸将参与鱼体内绝大多数酶、含氮激素(如生长激素、胰岛素)与含氮维生素(绝大多数B族维生素)等物质的合成[22],是鱼体细胞、组织和机体的重要组成部分,同时在维持鱼体新陈代谢、促进鱼体生长、发育和繁殖等阶段中都发挥着非常重要的作用,是决定鱼类生长发育速度的关键性因素[23]。当鱼类摄入低蛋白质含量的饲料时,会限制鱼类的生长,降低存活率,扰乱上市时间,损害水产养殖的经济效益;摄入高蛋白质含量的饲料时,并不能进一步提高鱼类的生长性能,反而会通过氧化脱氨基作用把过量的蛋白质分解,用于机体供能而非储积体蛋白,在加重鱼类代谢负担的同时产生更多的氨氮排泄物,污染水体,并且还会增加饲料成本,造成渔业资源的不必要浪费,不利于水产行业的可持续发展[24—26]。
因此,本试验设置一系列蛋白质梯度饲料饲养异齿裂腹鱼,旨在研究其饲料蛋白质的最适需求量,并探讨饲料中不同蛋白质水平对其生长、形体指标、全鱼体成分、消化酶活性、非特异性免疫及蛋白质代谢反应的影响,为确定异齿裂腹鱼的营养标准和开发低成本、高效益的科学饲料配方提供基础资料,这将为其苗种的大规模生产和西藏异齿裂腹鱼的人工增殖放流活动提供技术支持,为异齿裂腹鱼资源的合理保护与开发奠定基础,亦为西藏的鱼类资源保护提供参考。
1 材料与方法
1.1 试验饲料设计
本试验饲料以白鱼粉、酪蛋白和南极磷虾粉为蛋白源,鱼油为脂肪源,糊化淀粉和玉米淀粉为糖源,羧甲基纤维素为黏合剂。配制6组等脂等能蛋白质水平分别为20.01%、25.00%、30.19%、35.24%、40.12%和45.10%的试验饲料,试验饲料组成及营养水平(表1)。饲料原料从河南中偌生物科技有限公司购买,饲料原料过60目筛,严格按照表1配比称重,采用逐级混匀法混合均匀,混合后的粉状饲料经制粒机,制成(粒径0.3 cm;长度1 cm左右)的颗粒饲料;自然风干至含水分约10%,放入密封袋于冰柜(-4℃)中保存备用。
1.2 试验设计及养殖管理
试验所用异齿裂腹鱼为2018年采自雅鲁藏布江日喀则河段,试验前期试验用鱼暂养于(长5 m×宽3 m×高0.6 m)水泥池中,以鲤(Cyprinus carpio)商业饲料驯食60d,使之逐渐适应配合饲料,待野生异齿裂腹鱼能正常抢食后,开始试验。在试验开始前,停食24h,用MS-222麻醉后称重,随机挑选540尾规格相似,体重为 (115.46±16.20) g健康无伤病的异齿裂腹鱼,随机分成6组,每组3个重复,每个重复30尾鱼,并分别放入6个(长3.0 m×宽0.5 m×高0.3 m)平列槽(每个平列槽用网孔为1.5 mm制作的隔板分成3个平行的养殖空间),分组后停食24h,然后给予不同蛋白质水平的配合饲料进行94d的饲养试验。每天按试验鱼体重3%—5%表观饱食投喂3次(8:30、13:30和18:30),投饵1h后吸出残饵和粪便,残饵置于恒温箱中(55℃)烘干称重并记录。前1周内各组死亡的鱼可进行补充替换,在此之后每天记录死鱼的数量,计算死亡率。因试验对象为野生鱼,在饲养过程中极易发生水霉病,造成极高的死亡率,为保试验的顺利进行,每隔1天配制浓度为2%的盐水用于鱼体消毒,浸泡时间由鱼的耐受能力而定,一般大于20min,并结合药物(美婷Ⅱ)防治水霉病对鱼类的危害。试验鱼用曝气后的地下水(微循环)进行饲养,每天对试验水体进行3次监测,保持水体的水温变化范围: 12.1—12.3℃;溶氧含量: ≥6 mg/L;pH变化范围: 7.8—8.2;氨氮≤0.01;亚硝≤0.02。试验于西藏自治区农牧科学院水产科学研究所西藏土著鱼类增殖育种场内进行。
1.3 样品采集与分析方法
在养殖试验结束时,将鱼停食24h,用MS-222麻醉后确认每个平面槽内鱼的数量并将全部试验鱼逐一称重、测体长和全长,以分别计算异齿裂腹鱼的体重增长率、特定生长率、摄食率、饲料系数、蛋白质效率和成活率。
每个平列槽随机取5尾试验鱼,用干布吸干鱼体外表水分后,在冰盘上迅速解剖取其内脏并称重,然后分离出内脏、肝胰脏和肠道,再分别称重,以分别计算肥满度、脏体比、肝体比、肠体比。肝脏保存于-80℃的超低温冰柜中,用于测定消化酶、免疫酶和抗氧化酶活性;肠道分为前肠、中肠和后肠,均保存于-80℃,用于测定消化酶活性。每组随机抽取10尾试验鱼,以注射器自尾静脉取血,以3000 r/min离心10min,离心后分离血清并于-80℃保存,用于血清中血氨和尿素氮(BUN)的测定。每组取5尾试验鱼,鱼体放入封口胶袋中,编号后迅速放入-20℃冰柜中冷冻,用于鱼体体成分分析。
各组试验配合饲料和异齿裂腹鱼鱼体的水分(H2O)、粗蛋白质(CP)、粗脂肪(EE)、灰分(Ash,%)均参照AOAC(1995)[27]的方法进行测定: 水分含量采用常压干燥法,于鼓风烘箱105℃下烘干至恒重测定;粗蛋白含量采用凯氏自动定氮仪测定;饲料粗脂肪含量采用索氏抽提器测定(乙醚为溶剂);饲料粗灰分的测定,先将样品在电炉上碳化至无烟后,再在马福炉灼烧12h后测定。肝脏中的消化酶、免疫酶和抗氧化酶,前肠、中肠和后肠中的消化酶、血清中的血氨和尿素氮(BUN)以及组织匀浆液中蛋白质浓度均采用南京建成生物工程研究所的试剂盒进行测定。

表 1 异齿裂腹鱼试验饲料配方及营养成分(%干物质)Tab.1 Formulation and nutrition composition of Schizothorax experimental diets (% dry matter)
1.4 计算与统计分析
异齿裂腹鱼的体重增长率、特定生长率、摄食率、饲料系数、蛋白质效率、成活率、肥满度、脏体比、肝体比和肠体比参照以下公式计算:
增重率(Weight growth rate,WGR,%)=100×(Wt-W0)/W0
特定生长率(Specific growth rate,SGR,%/d)=(lnWt-lnW0)×100/t
摄食率(Feeding ratio,FR,%)=100×F/[t× (Wt+W0)/2]
饲料系数(Feed conversion ratio,FCR)=F/(Wt-W0)
蛋白质效率(Protein efficiency ratio,PER,%)=100×(Wt×Nt-W0×N0)/Ip
成活率(Survival rate,SR,%)=100×(Nt-N0)/N0
肥满度(Condition factor,CF,g/cm3)=100×Wt/L3
脏体比(Viscerasomatic index,VSI,%)=100×Wv/Wt
肝体比(Hepaticsomatic index,HSI,%)=100×Wh/Wt
肠体比(Viserosomatic index,VI,%)=100×Wvi/Wt式中,W0为试验开始时鱼体重(g);Wt为试验结束时鱼体重(g);t为养殖天数(d);L为鱼体长(cm);N0为试验开始时鱼的尾数;Nt为试验结束时鱼的尾数;F为饲料摄入量(g);Wv、Wh、Wvi分别为试验鱼内脏团、肝脏、肠道的质量(g);Ip为粗蛋白质摄入量(以干重计);Ip=F×P[P为饲料中粗蛋白质含量(%)]。
1.5 统计分析方法
试验结果表示为“平均值±标准差”(Mean±SD)。采用SPSS19.0统计软件中one-way ANOVA对所得数据进行单因素方差分析,若差异达到显著,则采用Duncan’s进行多重比较,差异显著水平为P<0.05。
2 结果
2.1 饲料蛋白质水平对异齿裂腹鱼生长及饲料利用的影响
由表2可知,随着饲料蛋白质水平的增加,异齿裂腹鱼末重(FW)、增重率(WGR)、特定生长率(SGR)、蛋白质效率(PER)、成活率(SR)均呈先升高后降低的变化趋势。FW、WGR、SGR均在饲料蛋白质水平为40.12%时达到最大,分别为140.55 g、28.20%和0.41 %/d;FW与饲料蛋白质水平为30.19%—35.24%的试验组差异不显著(P>0.05),显著高于其余试验组(P<0.05);WGR、SGR均与饲料蛋白质水平为30.19%的试验组差异不显著(P>0.05),显著高于其余试验组(P<0.05)。PER、SR均在饲料蛋白质水平为25.00%时达到最大,分别为1.19%和74.44%,均与饲料蛋白质水平为30.19%的试验组差异不显著(P>0.05),显著高于其余试验组(P<0.05)。摄食率(FR)随饲料蛋白质水平的升高呈先降低后趋于稳定的变化趋势,在饲料蛋白水平为20.01%时最高,为0.74%,显著高于其余试验组(P<0.05)。饲料系数(FCR)随着饲料蛋白水平的升高呈先降低后升高的变化趋势,且在饲料蛋白含量为40.12%时最低,为2.36,与饲料蛋白质水平为30.19%—35.24%的试验组差异不显著(P>0.05),显著低于其余试验组(P<0.05)。以二次曲线来拟合饲料蛋白水平(X)与WGR(Y1)、SGR(Y2)、FCR(Y3)、PER(Y4)的关系,得回归方程,方程Y1=-1026.3X2+683.26X-85.957(R2=0.8611);Y2=-14.643X2+9.7293X-1.2069(R2=0.8681);Y3=260.29X2-177.09X+32.232(R2=0.9031);Y4=-39.571X2+24.693X-2.6436(R2=0.8507)。则WGR、SGR、FCR、PER最优时饲料蛋白水平分别为33.29%、33.22%、34.02%和31.20%(图1—4)。以一次方程来拟合饲料蛋白水平(X)与FR(Y5),得回归方程Y5=-0.4971X+0.8332(R2=0.9583,图5)

表 2 饲料蛋白水平对异齿裂腹鱼生长性能的影响(平均值±标准差)Tab.2 Effect of dietary protein levels on growth of Schizothorax (Mean±SD)
2.2 饲料蛋白质水平对异齿裂腹鱼形体指标及全鱼体成分的影响
由表3可知,异齿裂腹鱼肥满度(CF)随饲料蛋白质水平升高呈先升高后降低的变化趋势,在饲料蛋白质水平为35.24%时最高,显著高于其余各试验组(P<0.05)。脏体比(VSI)、肠体比(VI)均随饲料蛋白质水平升高呈逐渐降低的变化趋势,均在饲料蛋白质含量为45.10%时取得最小值,分别为8.71%和1.88%。肝体比(HSI)随饲料蛋白质水平升高呈先降低后升高的变化趋势,在饲料蛋白质水平为40.12%时最低,与饲料蛋白水平为35.24%试验组差异不显著(P>0.05),显著低于其余试验组(P<0.05)。
由表4可知,随着饲料中蛋白质水平的增加,异齿裂腹鱼育成鱼全鱼粗蛋白质含量逐渐升高,45.10%组达到最高值,为18.25%,与30.19%—40.12%组全鱼粗蛋白质含量差异不显著(P>0.05),但显著高于20.01%—25.00%组(P<0.05)。随着饲料蛋白质水平的升高,各组异齿裂腹鱼育成鱼全鱼水分含量呈先增加后降低的变化趋势,且差异不显著(P>0.05);粗脂肪含量随饲料蛋白水平的增加而不断下降,45.10%组达到最小值7.87%,且各组差异不显著(P>0.05);粗灰分含量无显著差异(P>0.05)。

图3 饲料蛋白水平对异齿裂腹鱼饲料系数的影响Fig.3 The effect of dietary protein levels on feed conversion ratio of Schizothorax
2.3 饲料蛋白质水平对异齿裂腹鱼消化酶活性的影响
用蛋白质水平为20.01%、25.00%、30.19%、35.24%、40.12%和45.10%的试验饲料饲养异齿裂腹鱼94d后,其肠道和肝脏胰蛋白酶(TPS)的活性见表5。试验鱼前肠、中肠、后肠和肝脏TPS活性随试验饲料蛋白质水平的升高均呈先增加后减小的变化趋势;前肠TPS活性在蛋白质水平为40.12%达到最大,最大值为5254.64 U/mg prot,与饲料蛋白质水平为30.19%—35.24%的试验组差异不显著(P>0.05),显著高于其余试验组(P<0.05);中肠和肝脏TPS活性在蛋白质水平为35.24%达到最大,最大值分别为5908.91和1411.26 U/mg prot,中肠各组TPS活性差异不显著,肝脏TPS活性在饲料蛋白质水平为25.00%—40.12%的试验组差异不显著(P>0.05),显著高于其余试验组(P<0.05)。后肠TPS活性随试验饲料蛋白质水平(25.00%—45.10%的实验组)的升高呈先增加后减小的变化趋势,在饲料蛋白质水平为35.24%时达到最大,为4685.64 U/mg prot,与饲料蛋白质水平为30.19%的试验组差异不显著(P>0.05)。异齿裂腹鱼育成鱼TPS活性具有组织器官差异性,在饲料蛋白质水平为25.00%—35.24%、45%时TPS活性表现为: 中肠>后肠>前肠>肝脏;在饲料蛋白质水平为20.01%—45.10%时,肝脏TPS活性均为最低。
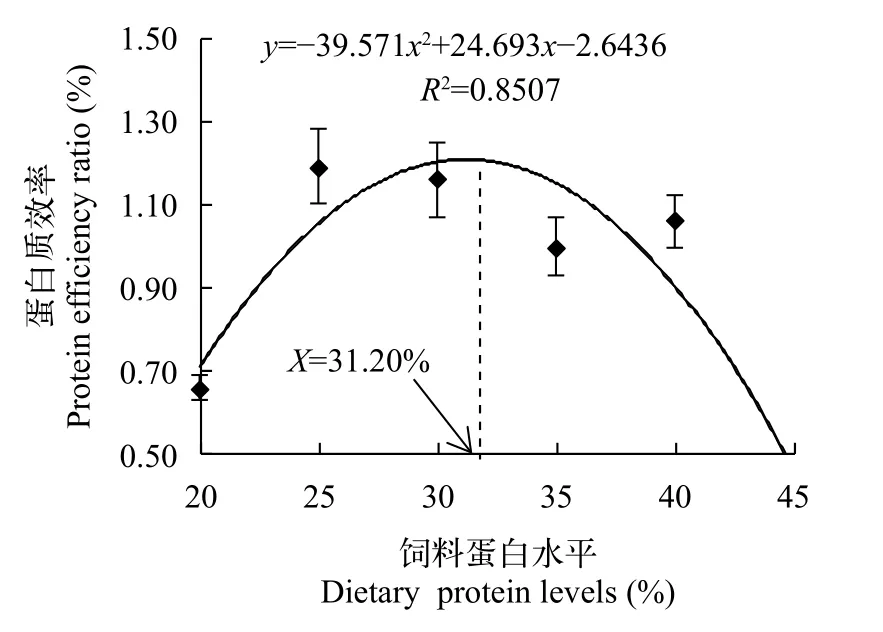
图4 饲料蛋白水平对异齿裂腹鱼蛋白质效率的影响Fig.4 The effect of dietary protein levels on protein efficiency ratio of Schizothorax

图5 饲料蛋白水平对异齿裂腹鱼摄食率的影响Fig.5 The effect of dietary protein levels on feed intake of Schizothorax
试验鱼前肠、中肠、后肠和肝脏的脂肪酶(LPS)活性随试验饲料蛋白质水平的升高均呈先增加后减小的变化趋势;前肠和肝脏LPS活性均在蛋白质水平为35.24%时达到最大,分别为3.90和22.30 U/mg prot,前肠LPS活性在饲料蛋白质水平为30.19%—35.24%的试验组差异不显著(P>0.05),肝脏LPS活性在饲料蛋白质水平为30.19%—35.24%的试验组差异不显著(P>0.05),显著高于其余试验组(P<0.05);中肠和后肠LPS活性均在蛋白质水平为30.19%时达到最大,分别为16.29和7.66 U/mg prot,中肠LPS活性在饲料蛋白质水平为20.01%—30.19%的试验组差异不显著(P>0.05),显著高于其余试验组(P<0.05),后肠各组LPS活性差异不显著。异齿裂腹鱼育成鱼LPS活性具有组织器官差异性,在饲料蛋白质水平为20.01%—45.10%时LPS活性表现为: 肝脏>中肠>后肠>前肠(除在饲料蛋白质水平为20.01%—25.00%时LPS活性表现为: 中肠>肝脏)。
试验鱼前肠、中肠、后肠和肝脏的淀粉酶(AMS)活性随试验饲料蛋白质水平的升高均呈先增加后减小的变化趋势,且各组间均差异不显著(P>0.05)。前肠AMS活性在30.19%时达最大值,为0.235 U/mg prot,中肠和肝脏AMS活性在35.24%时达最大值,分别为0.354和0.172 U/mg prot。后肠AMS活性的高低受饲料蛋白质水平的影响较小,随试验饲料蛋白质水平的升高,变化不明显。异齿裂腹鱼育成鱼AMS活性具有组织器官差异性,在饲料蛋白质水平为25.00%—40.12%时AMS活性表现为:中肠>前肠>后肠>肝脏。
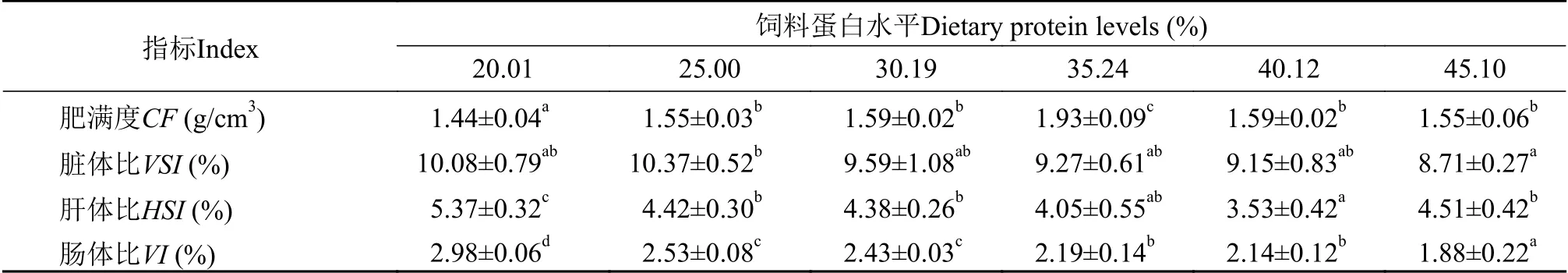
表 3 饲料蛋白水平对异齿裂腹鱼形体指标的影响Tab.3 Effects of feed protein levels on body parameters of Schizothorax fish

表 4 饲料蛋白质水平对异齿裂腹鱼全鱼体成分的影响Tab.4 Effects of feed protein levels on the whole fish body composition of Schizothorax fish
2.4 饲料蛋白质水平对异齿裂腹鱼非特异性免疫及蛋白质代谢反应的影响
由表6可知,饲料蛋白质水平对肝脏超氧化物歧化酶(SOD)活性影响显著(P<0.05),随饲料蛋白质水平升高,SOD活性增加,在蛋白质水平为45.10%时,SOD活性最高,为1.60 U/mL,显著高于20.01%—25.00%组(P<0.05),与30.19%—40.12%组差异不显著(P>0.05);随着饲料蛋白质水平增加,肝脏的谷丙转氨酶(ALT)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活性均呈先升高后降低的变化趋势,且各组间差异均不显著(P>0.05),ALT和ACP活性在蛋白质水平为35.24%时最高,分别为52.87 IU/L和0.078 U/g prot,AKP活性在蛋白质水平为30.19%时最高,为0.31 U/g prot。
随着饲料蛋白质水平增加,异齿裂腹鱼血清中的尿素氮含量逐渐升高,45.10%组达最大含量,为2.00 mmol/L,显著高于20.01%组(P<0.05),与其他试验组差异不显著(P>0.05);血清中血氨含量在45.10%组达最大含量,为899.03 μmol/L,显著高于25.00%组(P<0.05),与其他组差异不显著(P>0.05)。
3 讨论
3.1 影响异齿裂腹鱼对饲料中蛋白质需求量的因素
鱼类为变温动物,体温极低,所需基础代谢极少,不能很好的利用碳水化合物供能,为维持正常的生长发育和繁殖,故鱼类对易于利用的蛋白质要求极高。有研究表明,在鱼体干物质中,蛋白质含量在65%左右[19],而在鱼类的全价配合饲料中蛋白质水平为25%—55%[20]。鱼类对蛋白质的需求与鱼类的种类、食性、生长阶段、水温等因素密切相关(表7)。根据食性的不同,鱼类可分为肉食性鱼类、杂食性鱼类、草食性鱼类,有研究表明: 鱼类对蛋白质的需求: 肉食性>杂食性>草食性。如: 青鱼(Mylopharyngodon piceus)[28]稚鱼蛋白质需求量为41%,瓦氏黄颡鱼(Pelteobagrus vachelli)[29]蛋白质需求量为39.73%,鲤[30]蛋白质需求量为35%,草鱼(Ctenopharyngodon idellus)[31,32]蛋白质需求量为22.77%—29.64%;真鲷(Pagrosomus major)[33]蛋白质需求量为35.8%—53.7%,团头鲂(Megalobrama amblycephala)[34]蛋白质需求量为21.05%—30.83%;南方大口鲶(Silurus meridionalis)[35]蛋白质需求量为41.1%—45.1%,鲤[36]蛋白质需求量为30%—32%;鳜(Siniperca chuatsi)[37]蛋白质需求量为44.7%—45.8%,彭泽鲫(Carassius auratus)[38,39]蛋白质需求量为30%。根据生长阶段的不同鱼类对蛋白质的需求: 仔鱼>稚鱼>成鱼;如: 规格为0.2—2、2—20和12—80 g的黄颡鱼(Pelteobagrus fulvidraco)[40,41]的蛋白质需求量分别为45%、40.00%和38.78%,虹鳟(Oncorhynchus mykiss)[42]的仔鱼、稚鱼和成鱼的蛋白质需求量分别为45%—50%、40%—45%和35%—40%;根据鱼类生长环境水温的不同,鱼类对蛋白质的需求: 冷水性鱼>温水性鱼;如黄颡鱼[43]蛋白质需求量为37.49%,施氏鲟(Acipenser schrenckii)[44]蛋白质需求量为39.00%;斑点叉尾鮰(Ictalurus punctatus)[45]蛋白质需求量为25%,高首鲟(Acipensertransmontanus)[46]蛋白质需求量为40.05%。本试验鱼的最适蛋白质水平为31.20%—34.02%,低于相似规格的高首鲟和虹鳟,高于相似规格的斑点叉尾鮰,与拉萨裸裂尻和鲤的相近。本试验中研究对象的天然生活环境仅限于青藏高原,海拔可能也会对其蛋白质需求量产生某些影响[47]。由于在现存裂腹鱼类蛋白质需求量的研究中海拔对鱼类蛋白质需求量是否有影响的可供参考资料较少,故本文暂未对海拔进行深入的讨论,但海拔是否会对鱼类营养需求量产生影响,还需继续进行探索。

表 5 饲料蛋白质水平对异齿裂腹鱼消化酶活性的影响Tab.5 Effects of dietary protein levels on digestive enzyme activities of Schizothorax fish (U/mg prot)

表 6 饲料蛋白质水平对异齿裂腹鱼非特异性免疫及蛋白质代谢反应的影响Tab.6 Effects of different protein levels on non-specific immune-related enzyme activities and protein metabolism of Schizothorax o’connori fish
3.2 异齿裂腹鱼饲料中蛋白质需要量的确定
最适蛋白质需要量是指符合鱼体最大生长或鱼体蛋白质最大增加量而必需的最为经济的摄食量[31]。鱼类营养需求研究中常常以生长速率(SGR、WGR等)[48—50]、饲料和营养物质利用效率(FCR、PER等)[51]来衡量营养物质含量对鱼类的养殖效果。本试验选择增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)和蛋白质效率(PER)等作为评定指标,得出异齿裂腹鱼最适蛋白质添加量为31.20%—34.02%。较相似规格的虹鳟[42]和高首鲟[46]等大部分冷水性鱼类低,这可能与试验鱼在自然环境中的摄食习性有关。本试验鱼为雅鲁藏布江日喀则段捕获的野生异齿裂腹鱼,有研究表明[4],自然环境中异齿裂腹鱼主要以着生藻类为食,其中硅藻占比最大,食物组成中仅有少量水蚯蚓和节肢动物附肢等,表明试验鱼已经适应采食低蛋白质含量的饵料,所以降低了对饲料中蛋白质的需求量。同相似规格鲤[36]相近。因此,在没有异齿裂腹鱼的全价配合饲料生产时,建议使用鲤饲料对异齿裂腹鱼进行驯食及养殖。

表 7 影响鱼类饲料中适宜蛋白质需求量的因素Tab.7 Factors affecting the appropriate protein requirement in fish feed
3.3 饲料蛋白水平对异齿裂腹鱼生长、摄食率、形体指标及体成分的影响
本试验鱼经94d的饲养,不同蛋白质水平试验组的鱼增重率为9.58%—28.20%,与叶文娟等[19]对泥鳅幼鱼、伍代勇等[36]对鲤、邹祺[40]对黄颡鱼的研究不同,但与曾本和等[50]对拉萨裸裂尻鱼幼鱼的报道相似。这是因为,异齿裂腹鱼等高原特有鱼类本身就存在着生长缓慢的现象,且异齿裂腹鱼若要长到500 g,往往需要10年以上的时间[2],生长缓慢的原因可能与其自身的生活史特征和海拔高度的不同而导致的水体环境条件差异直接相关,但具体的机制还需进行更为深入的研究。
本试验主要通过调节玉米淀粉和纤维素添加量来平衡饲料能量和配方,从而制成等脂等能不同蛋白水平的试验饲料,即随着饲料蛋白水平上升,其可消化碳水化合物水平逐渐下降。有研究表明[48],饲料中低蛋白质或高碳水化合物,均会降低鱼类特定生长率(SGR),鱼类生长会受到抑制。在本试验中,在蛋白质水平为20.01%时,异齿裂腹鱼的SGR最低,这表明,试验鱼在低蛋白质组生长缓慢可能也与饲料中高碳水化合物水平有关。有文献指出[52],鱼类会优先利用饲料中的蛋白质,且饲料中低水平碳水化合物不影响甚至可以提高鱼类的生长率、饲料效率。在本试验中,在蛋白质水平为40.12%时试验鱼的SGR最大,当蛋白质水平升高到45.10%时,其SGR显著降低(P<0.05),这主要与饲料中过高的蛋白质水平有关。本试验,饲料碳水化合物水平的变化可能会对低蛋白质组异齿裂腹鱼的生长产生影响,但并不会影响试验的开展,这一点,从肠道和肝脏淀粉酶活性无显著变化(P>0.05)也可以得到验证。
本试验鱼摄食率(FR)在低蛋白组(20%)最高(P<0.05),在高蛋白组(40%)最低,与30%—35%差异不显著(P>0.05),与叶文娟等[19]对泥鳅幼鱼蛋白质需求量的研究类似。这可能与鱼类的摄食补偿性调节[22]有关,即: 当摄入的饵料中蛋白质含量过低,鱼类就会增加对饵料的摄入量,以满足自身对能量及营养物质的需求,摄食率由此增大,因此,适当地提高饲料中的蛋白质含量,可以相应的降低鱼类养殖中饲料的用量,节约养殖成本。
在本试验中随饲料蛋白水平升高,异齿裂腹鱼脏体比(VSI)、肠体比(VI)呈逐渐降低的变化趋势,肝体比(HSI)在低蛋白质组(20%)最高(P<0.05),与曾本和等[50]所报道的蛋白质需求量对拉萨裸裂尻形体指数的影响相类似。鱼类在摄食低蛋白质水平饲料时,摄食率往往会增加,这相对于摄食高蛋白质饲料组的鱼类,摄入了较高水平的糖类和脂肪。有研究表明,鱼类摄入过多碳水化合物,会使鱼体糖代谢增强[54],同时,提高某些组织脂肪合成酶的活性,加快糖类向脂肪的转变,并与摄入的脂肪共同促进肝脏、腹腔内脏等脂肪组织的脂肪沉积[54,55],从而增加肝脏、内脏团和肠系膜的质量,鱼体的肝体比(HSI)、脏体比(VSI)和肠体比(VI)也随之增加,因此,适当地增加饲料中的蛋白质含量,可以减少鱼体内脏脂肪比例,并提高养殖鱼类的品质[56]。
在本试验中,随着饲料蛋白水平的上升,异齿裂腹鱼全鱼粗蛋白质含量明显增加,粗脂肪含量逐渐降低,与曾本和等[57]对台湾泥鳅、宋理平[21]对宝石鲈、孙挺[58]对黄颡鱼的研究相似,与桑永明等[59]对方正银鲫、涂永芹等[60]对春鲤、周兴华等[61]对齐口裂腹鱼、鲁琼[62]对黄姑鱼的研究结果不同,这可能与鱼的种类有关。
3.4 饲料蛋白水平对异齿裂腹鱼消化酶活性的影响
本试验结果表明,各试验组异齿裂腹鱼肠道和肝脏3种消化酶活性高低均呈: 胰蛋白酶活性(TPS)>脂肪酶活性(LPS)>淀粉酶活性(AMS)。这可能与异齿裂腹鱼在长期进化过程中所形成的固有生物学特性有关,即异齿裂腹鱼长期生存在食物严重缺乏水域,为适应环境,必须充分地消化和吸收食物中的蛋白质,以保证鱼体能在相同的能量消耗上获得最多的食物蛋白质(氨基酸)用于自身的生长[4],从而导致鱼类自身的发育过程和遗传规律,倾向于消化酶类中的蛋白酶活性较高。在自然环境中异齿裂腹鱼的食物组成主要是底层藻类,有研究表明,底栖硅藻的营养成分中粗脂肪的含量大于总糖[63],饵料中某些成分的增加,消化该成分的消化酶的活性也会增强[64],这与本试验研究结果异齿裂腹鱼的LPS活性大于AMS活性相符。
除后肠各组AMS的活性变化与蛋白质水平无明显相关外,其余组织的3种消化酶活性均随试验饲料蛋白质水平的升高呈先增加后减小的变化趋势,饲料中某些成分增加,消化该成分的消化酶的活性也会增强,而其他消化酶的活性也会发生变化[64],且鱼类对饲料中蛋白质的消化和吸收是有一定限度的,即蛋白酶活性随着饲料蛋白水平的增加而升高,当达到最适宜蛋白质水平后,酶活不再升高甚至下降[65],这与本试验研究结果相一致。
4种组织的3种消化酶活性呈现组织器官差异性,TPS活性为: 中肠>后肠>前肠>肝脏;LPS活性为: 肝脏>中肠>后肠>前肠;AMS活性为: 中肠>前肠>后肠>肝脏。该结果表明,异齿裂腹鱼摄食蛋白质和糖类后,肠道是主要的消化器官,肝脏起辅助作用;食物中的脂肪主要依靠肝脏分泌脂肪酶再在其中肠进行消化吸收,这主要与异齿裂腹鱼的消化结构有关,众所周知,鱼类肠道内的脂肪酶大多数都不是由肠黏膜直接分泌的,而是来自肝胰脏(胆管、胰管导入),脂肪消化吸收的主要部位在肠道中前部(胆管开口附近)[66],当中肠内的脂肪酶将食物中的脂肪消化后,便会因为肠道的蠕动随食物团向后肠移动,与此同时,促进后肠TPS的活性,加强后肠消化吸收LPS,回收利用自体蛋白,这与数据所反映的后肠的TPS和LPS活性大于前肠相一致。
本研究结果表明,在一定蛋白水平范围内,异齿裂腹鱼消化酶活性的变化趋势基本与确定饲料适宜营养水平的主要评价指标: 特定生长率,辅助评价指标: 增重率和蛋白质效率[65]相一致。
3.5 饲料蛋白水平对异齿裂腹鱼非特异性免疫及蛋白质代谢反应的影响
动物体内的酸性磷酸酶(ACP)和碱性磷酸酶(AKP)主要来源于肝脏,是机体代谢过程中重要的调控酶[67],常作为评价非特异性免疫性能的重要指标,其活性降低会导致非特异性免疫性能下降[68]。本研究结果表明,随着饲料蛋白质水平的升高,肝脏ACP和AKP活性均呈先增加后减小的变化趋势,说明适当提高鱼类饲料中蛋白质水平有助于提高异齿裂腹鱼的抗病性,但过高的蛋白质水平可能会抑制ACP和AKP活性,给免疫系统带来负面影响。
超氧化物歧化酶(SOD)是一种抗氧化酶,可以清除活性氧的自由基,防止机体受到氧化伤害[69]。SOD负责催化降解组织器官产生的超氧化物阴离子,同时生成过氧化氢(H2O2),是抵抗氧化应激最基本的酶之一,机体自由基越多SOD活性就越高。在本试验中,随饲料蛋白质水平的升高,肝脏SOD活性增加显著(P<0.05),与唐媛媛[70]对卵形鲳鲹的研究相似,但杨弘等[71]对尼罗罗非鱼的研究不同,本试验所测的SOD活性数值较低,这可能与鱼的种类有关。
谷丙转氨酶(ALT)是氨基酸代谢的关键酶类之一,肝脏中ALT活性升高表明氨基酸代谢增强,即蛋白质合成代谢加强,有利于氮在鱼体的蓄积;若肝等组织中ALT活性异常降低,可能与肝细胞损伤有关[72]。异齿裂腹鱼肝脏中ALT活性随饲料中蛋白质水平的升高呈先增加后减小的变化趋势,但各组差异不显著,说明本试验饲料的高蛋白质组对异齿裂腹鱼的肝脏健康并未产生明显的不良影响,但是对鱼体蛋白质的合成产生了一定的影响。
饲料中的蛋白质经鱼类肠道消化分解成氨基酸,再通过吸收进入鱼体氨基酸代谢库,其中有一部分氨基酸被氧化分解,产生氨和尿素等,并积累在血液中,饲料蛋白质水平的增加会显著提高血清中尿素氮含量和血氨含量,与林淑琴[73]对大黄鱼研究相似。这表明,异齿裂腹鱼在摄食适宜的蛋白水平饲料后,其体内蛋白质代谢反应会加快,当饲料中蛋白质水平超过其适宜量时,可能会造成蛋白质的浪费。
4 结论
本研究结果表明,饲料蛋白质水平会对异齿裂腹鱼的生长、消化酶活性、非特异性免疫及蛋白质代谢反应产生影响。饲料蛋白质水平过高或者过低都会造成异齿裂腹鱼的生长缓慢、消化酶活性降低、非特异性免疫能力下降、蛋白质代谢反应异常等。综上所述,以白鱼粉、酪蛋白、南极磷虾粉为蛋白源,饲料脂肪水平在7.00%—7.08%,饲料总能为15.01—15.39 MJ/kg的养殖条件下,结合增重率、特定生长率、饲料系数和蛋白质效率等作为评定指标表明: 异齿裂腹鱼(115.46±16.20) g达到最大生长的饲料蛋白水平为31.20%—34.02%。
