多鳞fih-1基因克隆及其低氧胁迫的mRNA表达
2020-08-07黄志棚林星桦王耀嵘江东能陈华谱邓思平朱春华李广丽田昌绪
黄志棚 林星桦,2 王耀嵘,2,3 江东能,2,3 陈华谱,2,3 邓思平,2,3 朱春华,2,3 李广丽,2,3 黄 洋,2,3,* 田昌绪,2,3,*
(1.广东海洋大学水产学院,湛江 524088;2.广东省名特优鱼类生殖调控与繁育工程技术研究中心,湛江 524088;
3.广东省海水养殖生物育种工程实验室,湛江 524088)
多鳞Sillago sihama(Forskål),又名沙锥鱼,隶属鲈形目、科,为热带印度至西太平洋浅海鱼类,广泛分布于我国沿海地区,粤西地区产量丰富,但近年来由于过度捕捞,导致多鳞种群数量减少,产量降低[1]。该鱼美味可口深受消费者喜爱,市场价格约60元/斤,具有较高的经济价值和营养价值[2]。在养殖生产中,多鳞属小型鱼类,成品鱼规格小,养殖管理过程简单,养殖成活率高,经济效益较好,养殖前景十分广阔[1]。目前杜涛等[3]已攻克了多鳞人工繁殖技术并对多鳞的人工养殖进行了初步试验,研究发现多鳞与对虾的混养模式具有较高的养殖效益,水体溶解氧过低是养殖过程中造成大规模死亡的主要原因。多鳞耐低氧能力差,对水体溶解氧含量变化敏感,在低氧环境下易出现浮头现象。目前尚未能够实现工厂化高密度养殖,严重限制了其养殖业的发展空间。
水体中溶解氧含量不足或缺氧,直接影响了鱼类生长发育、繁殖及各种行为活动,进而导致严重的水产养殖问题[4—6]。低氧诱导因子抑制因子-1(factor inhibiting hypoxia inducible factor 1,fih-1)是鱼类低氧信号通路中的关键因子,在鱼类低氧转录响应中起重要作用。fih-1是由Mahon等[7]通过酵母双杂交方法发现的一种与HIF相互作用的蛋白。人类fih-1基因定位于10号染色体(10q24),含有8个外显子[8]。fih-1是一种天冬酰胺羟化酶,属于2-氧化戊二酸依赖的二氧化物酶超家族,能够使HIF-1α羧基端反式激活区(CTAD)的天冬酰胺残基羟基化[9]。在低氧信号传导途径中fih-1在常氧条件下利用氧气中的氧分子将HIF-1α的CTAD天冬酰胺残基羟基化,阻碍HIF-1α与转录辅助因子(CBP/p300)结合,从而抑制其下游靶基因的转录。相反,在低氧条件下,fih-1对HIF-1α羟基化能力下降,HIF-1α能够与转录辅助因子结合,从而促进下游靶基因转录[4,9,10]。目前在鱼类中关于fih-1基因的研究也取得一定进展: Zhang等[10]完成了团头鲂(Megalobrama amblycephala)fih-1基因的克隆,并在该基因中发现3个与其低氧耐受性状相关联的SNP位点;李红莲[11]克隆了尼罗罗非鱼(Oreochromis niloticus)fih-1α基因并对其抑制剂fih-1αn进行了功能分析;丁为群等[12]完成鲢(Hypophthalmichthys molitrix)低氧调控基因igfbp-1和igf-I的克隆及表达特征分析;Geng等[13]基于转录组技术开展了斑点叉尾鮰(Ictalurus punctatus)fih-1基因在低氧胁迫下的表达;Ju-Hoon等[14]对斑马鱼(Danio rerio) fih-1与Mib E3泛素连接酶相互作用机制进行了探讨。
fih-1基因在低氧胁迫通路中发挥重要作用,但目前多鳞中fih-1基因尚未克隆,其机制特别是在低氧胁迫后的表达机制不清楚,因此本研究的开展将为多鳞低氧胁迫相关基因的研究和解析多鳞低氧胁迫分子机理建立基础。
1 材料与方法
1.1 实验用鱼
本实验多鳞均为1龄性成熟鱼[体重(30.0±5.0) g,体长(13.5±3.0) cm],来自广东海洋大学东海岛海洋生物研究基地。
1.2 低氧胁迫处理实验
1.3 样品采集和保存
在实验鱼麻醉后解剖分离组织。对照组采集鳃、心脏、脑、肝脏、肌肉、精巢、卵巢等7个组织,其余三组采集鳃和心脏组织,采样后立刻放入液氮速冻,后转移到-80℃保存,用于后续实验。
1.4 总RNA的提取及cDNA的合成
本实验采用Trizol法提取总RNA,使用琼脂糖凝胶电泳,经Tanon-1600全自动数码凝胶图像分析系统检验RNA的完整性,使用Nanodrop 2000 超微量生物检测仪测定RNA的浓度和质量,最后使用反转录试剂盒(TaKaRa Bio)进行反转录合成cDNA。
1.5 fih-1基因cDNA全长的克隆
从多鳞转录组数据库[2]中获取fih-1基因序列,设计多鳞fih-1基因相关引物和β-actin基因引物(表1)。混合肝、肌肉、脑等组织cDNA作为模板,以fih1-Ss-orf-f引物作为正向引物,fih1-Ss-orf-r引物作为反向引物进行PCR扩增反应,程序设定为94℃预变性3min,94℃变性1min,58℃退火30s,72℃延伸1.5min,进行30个循环,72℃延伸10min,4℃保存。PCR产物选取5 μL进行电泳(DYY-6C型电泳仪)检测,将目的产物送上海生工公司测序。

表 1 引物名称编号及其相应的序列Tab.1 Primer sequence
1.6 fih-1基因的生物信息学分析
运用DNAstar软件(https://www.dnastar.com/)预测出基因的开放阅读框(ORF)并翻译成相应的氨基酸序列;运用SMART软件(http://smart.embl-heidelberg.de/)预测基因的蛋白质结构;运用Signal IP 4.1网站(http://www.cbs.dtu.dk/services/SignalP/)预测基因前体蛋白的信号肽;通过Swiss-Model(https://swissmodel.expasy.org/)进行基因的三级结构预测;使用DNAMAN 8软件对基因氨基酸序列与其他脊椎动物的基因氨基酸序列进行多序列比对,利用MEGA 7.0软件对氨基酸序列与其他脊椎动物的氨基酸序列进行邻接聚类分析。
1.7 fih-1基因的组织表达
1.8 fih-1基因的组织表达荧光定量分析
本实验采用实时荧光定量分析方法,对多鳞低氧胁迫处理前后鳃和心脏组织fih-1基因表达变化进行分析。在低氧胁迫实验处理后,每组随机选用3尾多鳞的鳃、心脏组织cDNA作为模板,以fih-1-RT-f引物作为正向引物,fih-1-RT-r引物作为反向引物,以β-actin基因作为内参,使用实时荧光定量PCR仪(Roche,LightCycle®96)进行扩增反应,扩增循环程序为95℃变性10s,58℃退火15s,72℃延伸15s,进行40个循环。每个样品做3个生物学重复,三个技术重复。荧光定量实验数据使用2−ΔΔCt法计算相对表达量,用SPSS 17.0对数据进行单因素方差分析,Duncan法对组间差异进行多重比较,用GraphPad Prism 7.0制作表达量直方图。
2 结果
2.1 fih-1基因全长cDNA的克隆及特征分析
多鳞fih-1基因cDNA全长为1280 bp,ORF为1065 bp,可编码353个氨基酸,其GenBank登录号为MN013394。对cDNA序列进行分析,发现在第145个到第312个氨基酸包含一个JmjC 保守结构域,fih-1蛋白无信号肽,其三级结构模型是一个同二聚体。
2.2 fih-1基因的同源性以及系统进化分析
以多鳞fih-1基因氨基酸序列为基础,在NCBI中进行BLAST分析,得到尖吻鲈(Lates calcarifer)、大黄鱼(Larimichthys crocea)、半滑舌鳎(Cynoglossus semilaevis)、武昌鱼(Megalobrama amblycephala)、白斑狗鱼(Esox lucius)、斑马鱼(Danio rerio)、原鸡(Gallus gallus)、非洲爪蟾(Xenopus tropicalis)、牛(Bos taurus)、智人(Homo sapiens)及小家鼠(Mus musculus)的氨基酸序列。使用DNAMAN 8软件分析得到多鳞与尖吻鲈的同源性最高为94.66%,其次是大黄鱼为92.13%;与哺乳动物智人同源性为80.34%,与两栖类非洲爪蟾同源性为77.25%,与禽类原鸡的同源性为78.93%。
系统进化树分析结果显示,系统进化树主要分为2个大分支,鱼类聚为一支,哺乳动物、鸟类、两栖类等较高等的生物聚为另一支。其中多鳞与大黄鱼和尖吻鲈的亲缘关系最近,与哺乳动物、两栖类和禽类的亲缘关系较远(图1)。
2.3 多鳞fih-1基因在不同组织的表达
在正常氧条件下,对多鳞鳃、心脏、脑、肝、卵巢、精巢、肌肉等组织fih-1基因表达分析(图2),多鳞fih-1基因在不同组织中均有表达,其中在精巢、卵巢和肌肉中的表达水平最高,其次在鳃、心脏和肝脏中的表达水平相对较高,在脑组织中的表达水平较低。
2.4 多鳞低氧胁迫处理前后fih-1基因的表达变化
对多鳞进行低氧胁迫实验,分析低氧胁迫处理过程中fih-1基因在鳃和心脏组织中表达变化(图3)。结果显示,经低氧胁迫处理1h后,fih-1基因在鳃和心脏组织中的表达量显著升高(P<0.05),低氧胁迫处理6h后,fih-1基因在鳃和心脏中的表达量持续显著升高(P<0.05),恢复正常溶解氧4h后,fih-1基因在鳃和心脏中的表达量相对低氧胁迫处理时显著下降(P<0.05),但仍显著高于正常水平。
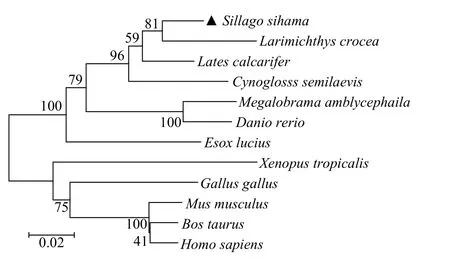
图1 多鳞鱚与其他脊椎动物fih-1基因的系统进化分析Fig.1 Phylogenetic analysis of fih-1 gene of S. sihama and other vertebrates
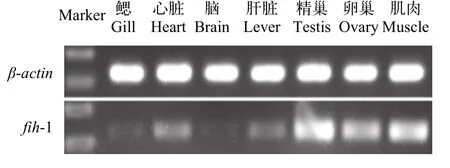
图2 多鳞鱚fih-1基因的组织表达Fig.2 The expression of fih-1 in various tissues of S. sihama
3 讨论
目前已有很多关于鱼类低氧相关基因的研究报道,但在多鳞中尚未有相关的研究。本次研究获得多鳞fih-1基因序列信息及其低氧胁迫处理下鳃和心脏组织中表达变化,发现fih-1在多鳞低氧信号传导通路中具有重要作用,可为今后多鳞低氧胁迫研究提供基础资料。
在常氧条件下,fih-1基因在团头鲂和斑点叉尾鮰主要组织中广泛表达[10,13],本研究也发现该基因在多鳞主要组织中均有表达,其中在肌肉、卵巢、精巢的表达水平最高,在鳃、心脏、肝的表达水平较高,在脑的表达水平较低。同时,fih-1基因在不同的鱼类中组织表达也存在一定差异,在团头鲂和多鳞的肝脏组织表达水平相对较高,在斑点叉尾鮰的肝脏组织表达相对较低,在河川沙塘鳢的脑组织表达水平相对较高,而在多鳞的脑组织表达相对较低[10,11,13]。

图3 低氧胁迫处理多鳞鱚fih-1基因在鳃(A)和心脏(B)的组织表达量变化Fig.3 The expression of fih-1 gene in gill (A) and heart (B) under hypoxia stress
鳃和心脏是鱼类低氧应激反应主要应答器官,研究低氧胁迫下多鳞fih-1基因在鳃和心脏组织中表达,发现该基因在低氧胁迫处理过程表达持续显著升高,表明fih-1基因在多鳞低氧胁迫转录调控中发挥重要作用。在多鳞中,低氧处理1h后,fih-1基因在鳃和心脏组织中的表达量显著升高,但在团头鲂的研究中,低氧处理2h后,fih-1基因在大部分组织中的表达量降低[10],提示该基因的表达可能在多鳞和团头鲂间存在物种特异性。经过低氧处理6h后,fih-1基因在多鳞鳃和心脏组织表达量显著升高,在团头鲂中fih-1基因表达量同样表现显著升高[10],这种现象还出现在尼罗罗非鱼和斑点叉尾鮰[11,13],表明在鱼类中长时间的低氧胁迫处理可能会持续激活fih-1基因mRNA的表达。在低氧信号传导途径中,fih-1基因应在缺氧期间表达下调,促进HIF与其转录辅助因子结合并激活其下游靶基因表达[4,9],但在以上4种鱼类中经过长时间的低氧胁迫处理fih-1基因在组织中的表达显著升高,提示低氧通路中fih-1与HIF之间可能存在反馈调节机制,说明fih-1在鱼类低氧适应中起着重要的作用。丁晨雨等[15]发现低氧胁迫通过调节鲢心肌Bax基因和Bcl-2基因的表达来诱导心肌细胞凋亡,从而造成鲢心脏损伤甚至鱼死亡,吴鑫杰等[16]发现低氧可导致团头鲂心脏组织结构的变化及线粒体损伤,低氧能诱导心肌细胞的凋亡。在恢复氧气4h后,多鳞fih-1基因在鳃和心脏组织的表达量相对低氧胁迫处理时显著降低,逐渐恢复至正常水平,但仍比正常水平要高。出现上述现象的可能原因是低氧处理导致多鳞鳃和心脏组织部分细胞损伤,也可能是经过长时间的低氧处理,fih-1的表达量恢复至正常水平需要更长的时间。
综上所述,本研究成功克隆多鳞fih-1基因并对其基因序列进行分析,同时探究在不同低氧胁迫处理下多鳞fih-1基因mRNA表达量的变化。结果表明,不同低氧胁迫处理组间存在显著的差异,表明fih-1基因在多鳞低氧信号传导通路中扮演重要的角色。本次实验为开展并解释多鳞低氧胁迫遗传机制提供候选基因,可为后续fih-1基因SNP筛选、鉴定以及关联性分析建立基础。
