黑水虻虫油替代豆油对黄颡鱼幼鱼生长、血清生化指标和肝脏脂滴面积的影响
2020-08-07胡俊茹易昌金王国霞莫文艳黄燕华
胡俊茹 易昌金 王国霞 莫文艳 黄燕华,2
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.广州飞禧特生物科技有限公司,广州 510640)
脂质作为水产动物一种重要的营养素,为鱼类生长提供所需的能量和必需的脂肪酸是水产动物饲料中重要的组成成分。豆油含有多种不饱和脂肪酸是水产动物饲料重要的油脂来源。随着水产养殖的快速发展和高油脂饲料的广泛使用[1],豆油需求持续增加,但我国大豆主要依赖进口,对外依存度非常高,豆油价格的涨幅直接关系我国水产养殖效益的好坏。因此,寻求其他合适的脂肪源替代豆油是保障我国水产养殖业可持续发展的重要措施之一。
昆虫是地球上生物量最大的群体,其生物量超过其他生物总量的10倍,是有待开发的巨大的食物和饲料资源。黑水虻(Hermetia illucensL.)是双翅目水虻科昆虫,又名亮斑扁角水虻,具有繁殖迅速,摄食范围广,饲料转化率高,饲养占地空间小等优势,黑水虻幼虫干物质含有大约30%左右的脂肪[2,3],其中棕榈酸(C16∶0)、油酸(C18∶1)和亚油酸(C18∶2)含量较高,月桂酸(C12∶0)含量丰富[3—5],黑水虻幼虫脂肪酸组成和含量会随着采食基质的不同略有差异,但仍以这几种脂肪酸为主[6]。已有研究表明黑水虻虫油可完全替代幼建鲤(Cyprinus carpiovar.Jian)饲料中的豆油[5],部分替代虹鳟(Oncorhynchus mykiss)饲料中鱼油[3,7],ST-Hilaire等[6]认为黑水虻是替代动物饲料鱼油的适宜脂肪源。
黄颡鱼(Pelteobagrus fulvidraco)是我国主要的水产名特养殖品种之一,其肉质细嫩、无肌间刺、味道鲜美、营养丰富、药用价值较高。2017年我国黄颡鱼养殖产量为43.44×107kg[8],每年以20%左右的幅度迅猛增长,国内外市场发展潜力巨大。黄颡鱼是杂食性动物,对脂肪的最适需要量为9%—12%[9],目前豆油仍是黄颡鱼配合饲料主要的脂肪来源。因此,鉴于豆油供应短缺的现状和饲料产业发展需求的矛盾,本试验选取黄颡鱼为研究对象,旨在研究黑水虻虫油替代豆油对黄颡鱼幼鱼生长性能、营养物质表观消化率、血清生化指标、血清抗氧化能力、炎症因子和肝脏脂滴面积的影响,为黑水虻虫油在黄颡鱼幼鱼配合饲料中的应用提供理论依据和技术支撑。
1 材料与方法
1.1 黑水虻虫油制备
取适量新鲜幼虫(7—8日龄,由广州飞禧特生物科技有限公司提供)倒入小型果蔬料理机,快速磨碎。然后按照料液比1∶3加入乙酸乙酯,4℃萃取24h,收集提取液,于4℃下6000 r/min离心10min,除去沉淀,得到粗提液,使用旋转蒸发仪对粗提液进行浓缩,待有机溶剂蒸发完毕直至恒重,收集油脂,用于试验。
1.2 试验饲料
以国产鱼粉、豆粕、花生粕作为主要的蛋白质源,黑水虻虫油分别替代0、20%、40%、60%、80%和100%的豆油,配制6种等氮等脂的试验饲料,饲料配方见表1。饲料制备之前,将鱼粉和豆粕等饲料原料经粉碎后过60目筛网,再按配比梯度混匀后倒入V型搅拌机充分混合20min。将大豆卵磷脂、黑水虻虫油和豆油放入烧杯中混合均匀,将其倒入已混合均匀的干粉,V型搅拌机搅拌均匀再加入30%左右的水继续搅拌,搅拌均匀后利用双螺杆挤条机(F-75型,华南理工大学研制),挤压温度为(43±2)℃,将其制成直径为1.5 mm的硬颗沉性饲料,在55℃条件下烘12h后进行冷却回潮处理,所制饲料采用双层塑料袋包装并封口,-20℃冰箱保存备用,以防止饲料受潮氧化变质。饲料原料和试验饲料脂肪酸组成见表2。
1.3 试验鱼与饲养管理
黄颡鱼幼鱼购于广州市白云区锦龙渔业有限公司,暂养期间投喂黄颡鱼配合饲料(锦龙渔业有限公司提供),待试验开始前1周再用自制硬颗粒饲料(对照组饲料)暂养使其适应试验饲料。养殖试验在广东省农业科学院动物科学研究所水产研究室水产养殖基地内进行,挑选初始重为(2.12±0.01) g的黄颡鱼幼鱼840尾,随机分到24个缸,每缸300L水,35尾鱼,然后随机分成6组,每种饲料饲喂一组试验鱼。每天09:00和16:00饱食投喂2次,投喂结束后40min将缸内剩余的饲料和粪便用虹吸管吸走。记录水温、气温、pH、摄食量及死亡情况等,养殖周期为56d。本试验采用独立循环养殖系统,控制水流速2 L/min。每天晚上8:00打开排污系统排污,在试验前4周,每3天更换一次循环水,每次更换2/3,之后每天更换1/2。养殖水温20—29℃,溶氧浓度不低于5 mg/L,氨氮和亚硝酸盐浓度均低于
0.25 mg/L。
1.4 样品采集和分析
每天投饲40min后清理残饵,养殖试验开始1个月后开始收集粪便,投饲1.5h后采用网捞法收集包膜完整的粪便,连续收集粪便至检测样品需求量,为期20d。将收集到的粪便60℃烘干,粉碎后装袋密封,-20℃冰箱中保存备用。在养殖试验结束后停食24h,统计每缸尾数并称量每缸鱼体终末体重,然后每个缸随机选取15尾鱼,从中随机选取3尾鱼置于-20℃保存,用于测定全鱼常规营养成分,剩余的12尾鱼快速放入40 mg/L的MS-222溶液中麻醉,静脉取血,测量体长、体重,其中6尾鱼冰上解剖,测定其内脏重、肝脏重及腹脂重,然后其中3尾鱼分离肌肉和肝脏用于测定脂肪酸组成,另3尾鱼取肝脏进行油红O染色分析;其余6尾鱼用于分子样品分析。尾静脉血于冷冻离心机4℃下4000 r/min离心10min制备血清样品,保存于-80℃冰箱中,用于血清生化、抗氧化指标和炎症因子测定。
试验饲料、全鱼及粪便常规营养成分的测定方法如下: 能量釆用氧弹量热仪(IKA-C2000)测定,粗脂肪含量采用乙醚抽提的方法(GB/T6433-2006)进行测定,灰分含量采用550℃灼烧至恒重的方法(GB/T6438-2007)测定,水分含量采用105℃烘箱烘干至恒重的方法(GB/T6435-2014)进行测定,粗蛋白质含量采用凯氏定氮法(GB/T6432-2018)进行测定,磷含量采用钼黄比色法(GB/T6436-2002)进行测定,钙含量采用乙二胺四乙酸二钠(EDTA)滴定法(GB/T6436-2002)进行测定。饲料及粪便中Y2O3含量采用等离子体光谱仪(SPECTRO CIOSCCD)进行测定。
血清总蛋白(Total protein,TP)、白蛋白(Albumin,ALB)、球蛋白(Globulin,GLO)、尿素氮(Urea nitrogen,UN)、胆固醇(Cholesterol,CHO)、甘油三酯(Triglycerides,TG)、高密度脂蛋白胆固醇(High density lipoprotein Cholesterol,HDL-CH)、低密度脂蛋白胆固醇(Low density lipoprotein Cholesterol,LDL-DH)、血糖(Glucose,GLU)、乳酸脱氢酶(Lactic dehydrogenase,LDH)、谷丙转氨酶(Alanine transaminase,ALT)及谷草转氨酶(Aspatate transaminase,AST)采用全自动生化分析仪进行检测。抗氧化酶活性采用南京建成试剂盒测定。白介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白介素-8(Interleukin-8,IL-8)、白介素-10(Interleukin-10,IL-10)采用酶联免疫检测试剂盒测定。

表 1 试验饲料组成及营养水平(风干基础, %)Tab.1 Composition and nutrient levels of experimental diets (air-dry basis,%)
油红O染色: 首先对肝脏组织采用冷冻切片法进行肝脏组织切片制作,且切片厚度要求为6 μm,将制作好的肝脏切片放在配置好的10% 福尔马林1% CaCl2固定液中固定15min转移至60%异丙醇中漂洗2min,随后将组织切片放入油红O工作液中染色10min,接着用60%异丙醇溶液分化漂洗,自来水冲洗,最后用甘油明胶封固,于显微镜下观察染色情况并拍照。每组内每张切片随机挑选至少3个200倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件选取相同的红色作为判断所有照片脂滴的统一标准,对每张照片进行分析得出每张照片红色脂滴占整个组织面积的比率即脂滴的面积百分比(%)。
1.5 指标计算
成活率(Survivalrate,SR,%)=100×Nt/N0;
增重率(Weightgainrate,WGR,%)=100×(Wt-W0)/W0;
特定生长率(Specificgrowthrate,SGR,%/d)=100×(lnWt-lnW0)/t;
饲料系数(Feedconversionratio,FCR)=Wf/(Wt-W0);
摄食量(Foodintake,FI,g/d)=Wf/t
肝体比(Hepatosomaticindex,HSI,%)=100×Wh/W;
脏体比(Viscerosomaticindex,VSI,%)=100×Wv/W;
肥满度(Conditionfactor,CF,g/cm3)=100×W/L3;
腹脂指数(Intraperitionealfatindex,IPF,%)=Wi/Wt×100;
干物质的表观消化率(ADC,%)=100×(1-Dy/Fy);
营养物质表观消化率(ADC,%)=100×[1-(Fn×Dy)/(Dn/Fy)]式中,Nt为终末尾数;N0为初始尾数;Wt为终末体质量(g);W0为初始体质量(g);t为实验天数(d);Wf为摄入饲料量(g);Wh为鱼肝脏重(g);Wv为鱼内脏重(g);W为鱼体质量(g);L为鱼体长(cm);Wi为肠系膜脂肪质量(g);Fn为粪便中营养素百分含量或能量值;Dn为饲料中营养素百分含量或能量值;Fy为粪便中Y2O3的含量;Dy为饲料中Y2O3的含量。
1.6 数据统计与分析
试验数据采用平均值±标准误差(n=3)表示。采用SPSS11.5软件进行统计分析。首先对数据进行方差齐性检验,若满足方差齐性则用单因素方差分析(One-WayANOVA)分析数据,差异显著者再用LSD检验方法进行多重比较,若不满足方差齐性则采用Dunnett’sT3检验法进行多重比较。P<0.05表示差异显著。
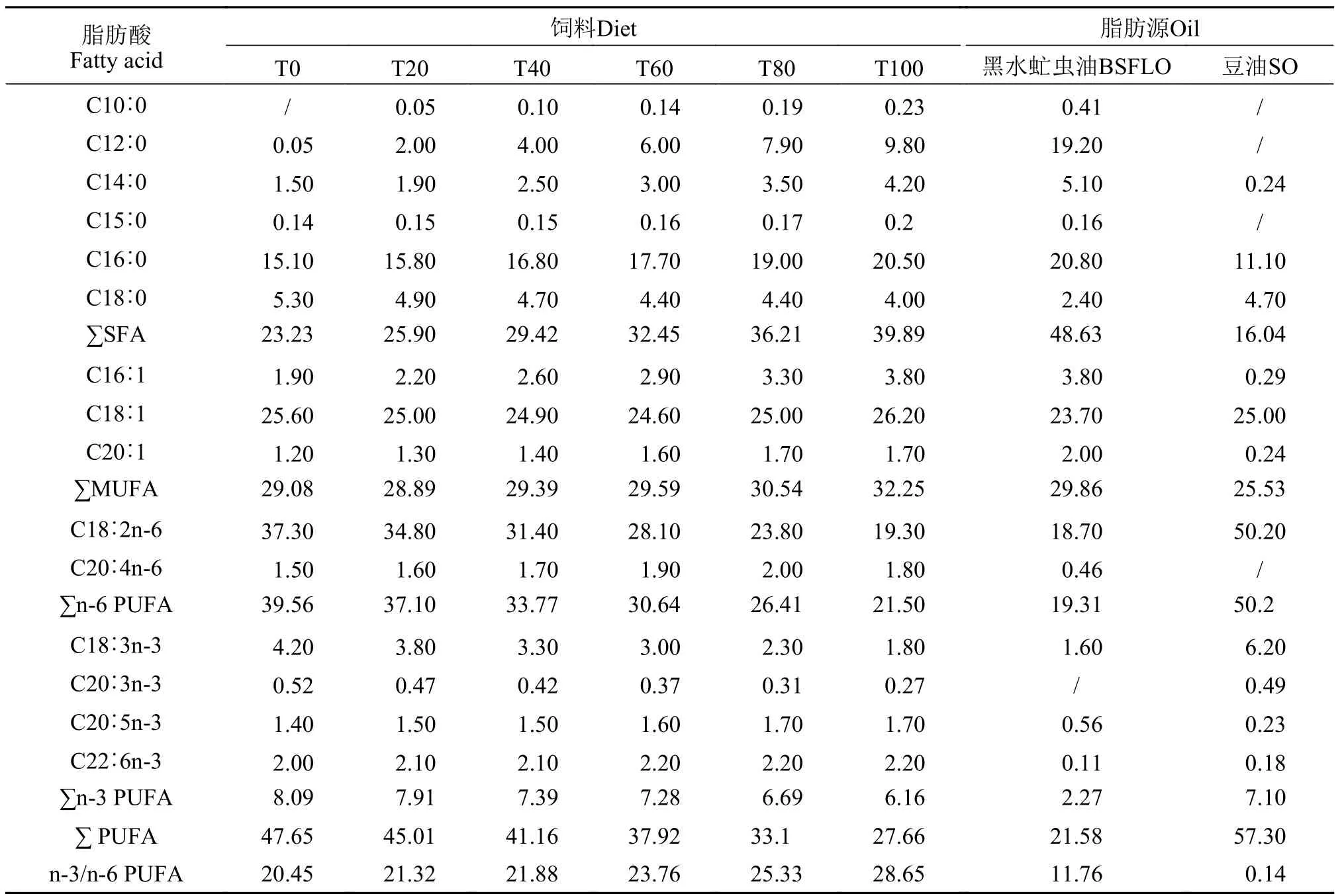
表 2 原料和饲料脂肪酸组成(%总脂肪酸)Tab.2Fattyacidcompositionoflipidsourcesandthediet(%oftotalfattyacids)
2 结果
2.1 黑水虻虫油替代豆油对黄颡鱼生长性能和形体指标的影响
由表3可知,黑水虻虫油脂替代豆油对黄颡鱼幼鱼的末均重、增重率、特定生长率、存活率、饲料系数、肥满度、脏体比、肝体比及腹脂指数均无显著影响(P>0.05)。
2.2 黑水虻虫油替代豆油对黄颡鱼幼鱼体成分的影响
由表4可知,与对照组相比黑水虻虫油替代豆油对黄颡鱼幼鱼粗蛋白、粗脂肪、水分、灰分、钙和磷含量无显著影响(P>0.05)。
2.3 黑水虻虫油替代豆油对饲料营养物质表观消化率的影响
由表5可知,各处理组饲料干物质、蛋白质、脂肪、钙、磷及能量的表观消化率与对照组相比均无显著差异(P>0.05)。替代组钙的表观消化率与对照组差异不显著(P>0.05),但T100组显著低于T60组与T80组(P<0.05)。
2.4 黑水虻虫油替代豆油对黄颡鱼幼鱼血清生化指标的影响
由表6可知,与对照组相比各处理组黄颡鱼幼鱼血清白蛋白、低密度脂蛋白胆固醇、甘油三酯、谷丙转氨酶、谷草转氨酶、尿素氮、球蛋白、乳酸脱氢酶、血糖、总蛋白的含量差异不显著(P>0.05)。高密度脂蛋白胆固醇随着替代比例的增加呈现先上升后下降的趋势,T60组和T80组显著高于对照组(P<0.05)。

表 3 黑水虻虫油替代鱼油对黄颡鱼幼鱼生长性能和形体指标的影响Tab.3 Effects of dietary soybean oil replaced with Hermetia illucens larvae oil on growth performance and physical indicators of juvenilePelteobagrus fulvidraco
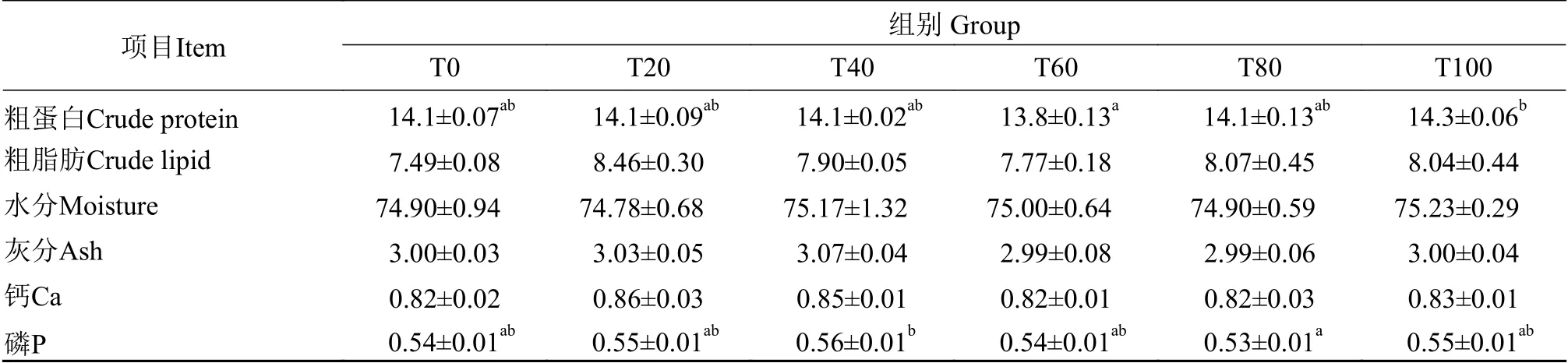
表 4 黑水虻虫油替代豆油对黄颡鱼幼鱼体成分的影响(干重, %)Tab.4 Effects of dietary soybean oil replaced with Hermetia illucens larvae oil on body composition of juvenile Pelteobagrus fulvidraco(dry weight %)
2.5 黑水虻虫油替代鱼油对黄颡鱼幼鱼血清抗氧化指标和炎症因子的影响
由表7可知,与对照组相比各替代组黄颡鱼幼鱼血清抗超氧阴离子、过氧化氢酶、超氧化物歧化酶活性及丙二醛含量均无显著差异(P>0.05)。与对照组相比,各处理组血清肿瘤坏死因子-α浓度无显著差异(P>0.05);当黑水虻虫油替代比例超40%时,各处理组血清中白介素-10、白介素-6及白介素-8的浓度均显著高于对照组(P<0.05)。
2.6 黑水虻虫油脂替代豆油对黄颡鱼幼鱼肝脏脂滴面积的影响
由表8和图1可知,与对照组相比黑水虻虫油替代豆油对黄颡鱼肝脏脂滴面积无显著影响(P>0.05)。

表 5 黑水虻虫油替代豆油对饲料营养物质表观消化率的影响Tab.5 Effects of dietary soybean oil replaced with H. illucens larvae oil on ADC’s of feed nutrients (%)
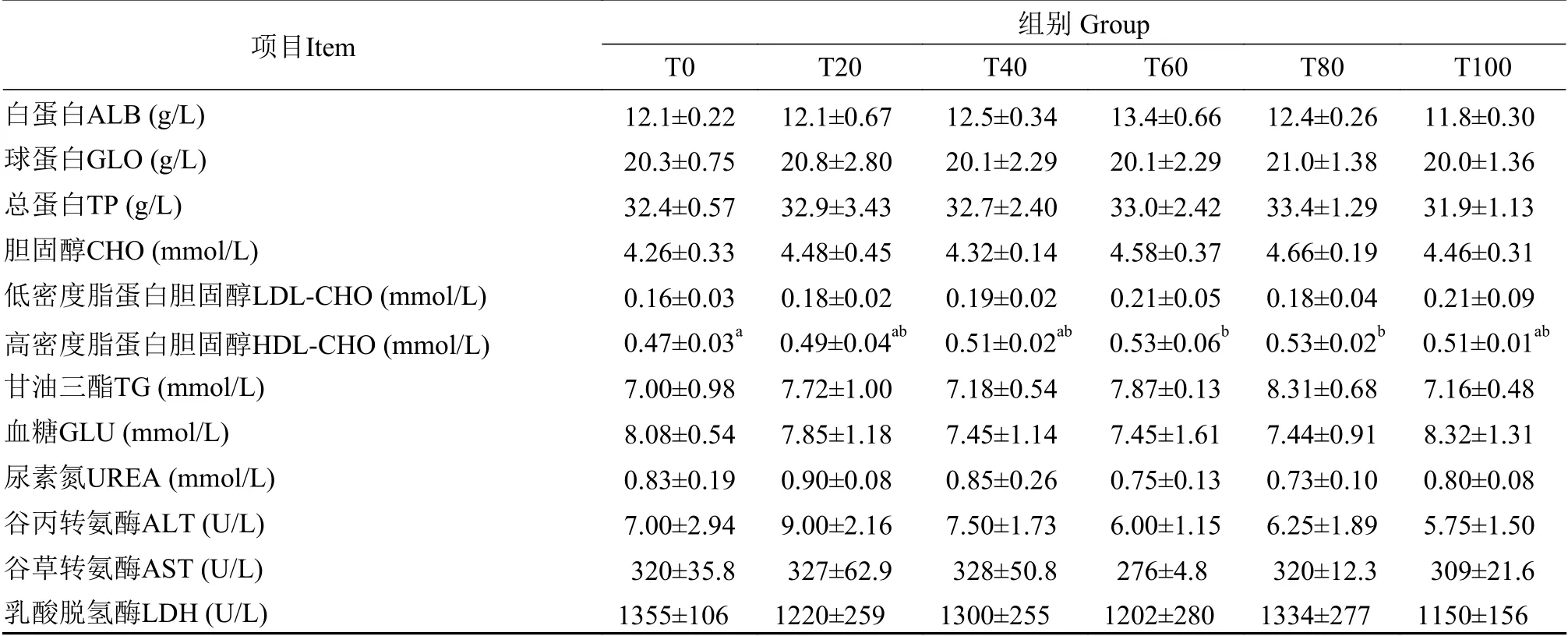
表 6 黑水虻虫油替代鱼油对黄颡鱼幼鱼血清生化指标的影响Tab.6 Effects of dietary soybean oil replaced with H. illucens larvae oil on serum biochemical indices of juvenile Pelteobagrus fulvidraco
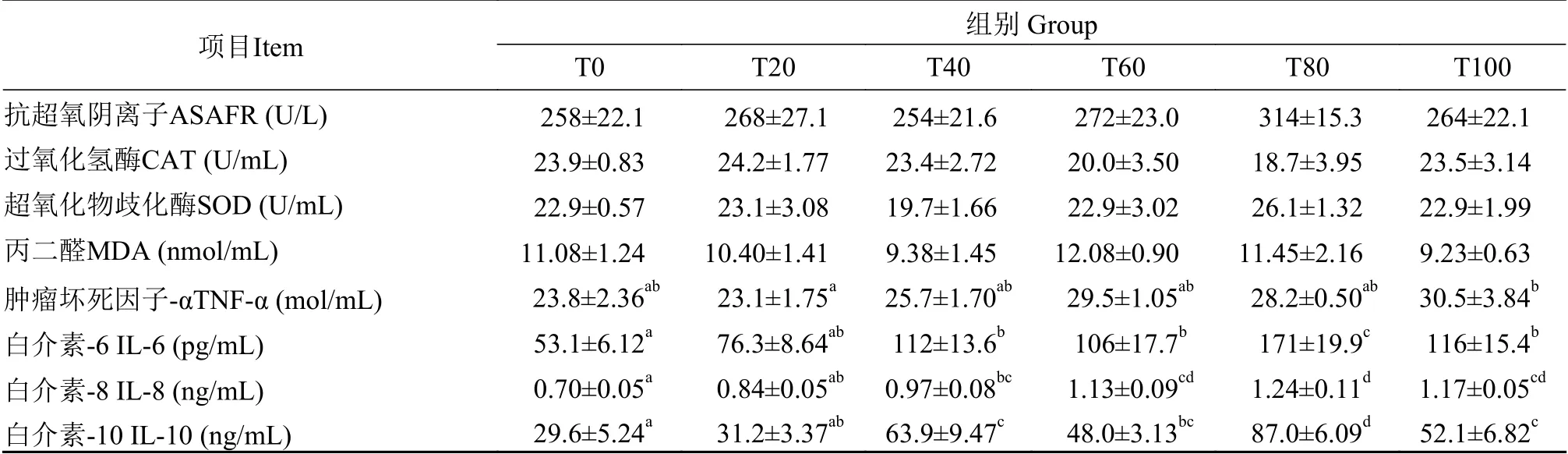
表 7 黑水虻虫油替代鱼油对黄颡鱼幼鱼血清抗氧化能力和炎症因子的影响Tab.7 Effects of dietary soy bean oil replaced with H. illucens larvae oil on serum antioxidant and inflammatory factors of juvenilePelteobagrus fulvidraco
3 讨论
3.1 黑水虻虫油替代豆油对黄颡鱼幼鱼生长性能和形体指标的影响
脂肪为鱼类生长发育提供必需脂肪酸和能量。本试验结果显示,黑水虻虫油完全替代豆油对黄颡鱼的末均重、增重率、特定生长率、存活率、饲料系数未产生显著影响,说明黑水虻虫油可以100%替代黄颡鱼幼鱼配合饲料中的豆油,这一结果与Li等[5]用黑水虻虫油完全替代豆油对建鲤的生长性能未产生显著影响的结果一致。本实验中豆油亚油酸含量达到50.2%,而黑水虻虫油中月桂酸含量19.20%、棕榈酸含量20.80%、油酸含量23.70%、亚油酸含量18.7%。Li等[5]认为黑水虻虫油月桂酸含量较高与椰子油相似,而且亚油酸含量远远大于亚麻酸的组成则与豆油相似。当椰子油(富含月桂酸)替代虹鳟[10]饲料中低剂量的鱼油和红姑鱼(Sciaenops ocellatus)[11]饲料中其他脂肪源时,对鱼的生长性能影响不显著,但是当椰子油替代高剂量鱼油时虹鳟增重率降低[12],在以豆油为基础油脂的饲料中添加椰子油黄颡鱼生长性能也不受影响[13]。已有研究表明,黄颡鱼体内具有把C18多不饱和脂肪酸(PUFA)去饱和及延长合成高度不饱和脂肪酸(HUFA)的能力,豆油、棕榈油与鱼油都是黄颡鱼适宜的脂肪源[14],棕榈油能够完全替代黄颡鱼饲料中鱼油和豆油混合物[15],上述研究结果进一步说明黄颡鱼能够利用黑水虻虫油中的大部分脂肪酸。

表 8 黑水虻虫油替代鱼油对黄颡鱼肝脏脂滴的影响Tab.8 Effects of dietary soy bean oil replaced with H. illucens larvae oil on liver lipid droplets in liver of juvenile Pelteobagrus fulvidraco
本试验中黑水虻虫油替代豆油对黄颡鱼幼鱼形体指标无显著影响,然而随着黑水虻虫油替代豆油比例的增加,幼建鲤脏体比和腹脂指数显著降低[5]。研究认为黑水虻虫油富含中链脂肪酸[5],而中链脂肪酸具有减少脂肪组织沉积,可在不增加脂脂沉积的情况下提高能量的利用[16,17]。本实验中黄颡鱼的肥满度、脏体比、肝体比及腹脂指数均未受豆油替代比例增加时饲料中饱和脂肪酸(SFA)增加的影响,这也可能是由于黑水虻虫油中的短链脂肪酸具有降低脂肪在组织中沉积的作用导致的。
3.2 黑水虻虫油替代豆油对黄颡鱼幼鱼体成分的影响
饲料组成影响鱼体的体成分组成[18],饲料中过量的脂肪会导致大量脂肪沉积在鱼体腹腔和组织中[19—21]。在本试验中,配置各实验组饲料粗蛋白、粗脂肪和能量相等可能是造成黑水虻虫油替代豆油对黄颡鱼幼鱼粗蛋白、粗脂肪影响不显著的因素之一,同样Li等[5]未发现黑水虻虫油替代豆油对幼建鲤肝脏、肌肉和鱼体的组成存在显著影响。研究发现饲料中PUFA通过降低脂肪酸合成酶(FAS)和乙酰CoA羧化酶(ACC)的酶活和含量以及提高脂肪酸氧化酶活性,从而降低体脂沉积的作用[22,23]。在本试验中由于黑水虻虫油SFA和单不饱和脂肪酸(MUFA)含量较高,因此随着替代量的增加饲料中PUFA含量降低,这一现象亦出现在Li等[5]的试验中,虽然饲料中PUFA含量下降,但未对体脂肪沉积产生显著影响,这可能也与中链脂肪酸月桂酸的降脂作用有关。但陆游等[13]在研究黄颡鱼对不同脂肪源利用情况时,发现虽然椰子油中月桂酸含量较高但黄颡鱼体脂沉积也显著高于其他富含PUFA的脂肪源组。
3.3 黑水虻虫油替代豆油对饲料营养物质表观消化率的影响
消化率是评定饲料营养成分可利用性的重要指标。脂肪的表观消化率与脂肪酸的不饱和程度及碳链长度有关[24]。在许多鱼类中研究发现鱼类对脂肪酸消化率的顺序依次是HUFA>C18PUFA>MUFA>SFA,在同一饱和程度下短链脂肪酸>长链脂肪[25—29]。在本试验中虽然随着替代量的增加饲料不饱和脂肪酸含量下降,但黄颡鱼对饲料脂肪的表观消化率无显著差异。彭墨等[30]使用亚麻籽油替代鱼油时饲料中不饱和脂肪酸含量升高,但大菱鲆(Scophthalmus maximus)幼鱼对饲料脂肪的表观消化率也无显著差异。Ng和Gibon[31]认为个别脂肪酸消化率微小地降低对于鱼类来说并没有显著的生物学意义。
3.4 黑水虻虫油替代豆油对黄颡鱼幼鱼血清生化指标、抗氧化能力和炎症因子的影响
鱼类血液生理生化指标与机体自身的营养状况、代谢和疾病密切相关[32]。在本试验中,黄颡鱼幼鱼高密度脂蛋白胆固醇随着替代比例的增加呈现先上升后下降的趋势。血清高密度脂蛋白胆固醇水平反应肝脏合成高密度脂蛋白的能力,它将总胆固醇、甘油三酯等物质从外周组织运输到肝脏分解,防止总胆固醇在血管壁沉积,其血浆含量与冠状动脉疾病的发生负相关[33,34]。已有研究显示单月桂酸甘油酯能够显著提高蛋鸡血清中高密度脂蛋白胆固醇的含量,改善蛋鸡的脂肪代谢[35]。然而,Li等[5]在实验中未发现黑水虻虫油替代豆油对幼建鲤血清生化指标产生显著影响。陆游等[13]用富含月桂酸的椰子油配置等氮等脂饲料投喂黄颡鱼时,各组血清生化指标无显著差异,Luo等[12]也认为,从椰子油提取的中链脂肪酸对虹鳟血浆脂类代谢产物影响较小。实验对象不同,待研究脂肪源脂肪酸组成差异,或者养殖时间长短等都是影响动物血脂类代谢差异的重要因素。
动物机体的抗氧化状态,在一定程度上反映了机体的健康状况。在本试验中黑水虻虫油替代豆油对黄颡鱼血清抗氧化能力无显著影响。但陆游等[13]发现富含月桂酸的椰子油添加到饲料中显著提高了黄颡鱼血清超氧化物歧化酶活性(SOD)和谷胱甘肽疏基转移酶(GST)活性,降低了MDA含量,认为这可能与椰子油的脂肪酸不饱和程度有关。已有研究表明,高含量DHA饲料可能会提高细胞膜脂质过氧化的敏感性,破坏抗氧化系统,从而对大鼠肝脏组织的抗氧化能力产生负面影响[36]。在虹鳟幼鱼中,随着橡胶籽油(其中不饱和脂肪酸含量为74.52%;α-亚麻酸的含量为20%—24%,是大豆油和菜籽油的3—4倍)替代豆油比例的升高,血浆一氧化氮含量显著升高,过氧化氢酶活性显著降低[37],鱼油中n-3脂肪酸含量较高可以抑制尼罗罗非鱼(Oreochromis niloticus)幼鱼的抗氧化酶活性[38],同样富含亚麻酸(Linolenic acid,LNA)的紫苏籽油,因不饱和脂肪酸含量过高,则容易引起中华绒鳌蟹(Eriocheir Sinensis)幼蟹肝胰腺的脂质氧化应激[39]。在本试验中,黑水虻虫油替代豆油对黄颡鱼血清抗氧化能力无显著影响,说明黑水虻虫油未对黄颡鱼幼鱼的抗氧化能力产生负面影响,这是否与黑水虻虫油的不饱和程度或是中链脂肪酸有关,需要进一步探讨。
肿瘤坏死因子-α(Tumor necrosis factor α,TNFα)、白介素-6(Interleukin-6,IL-6)和白介素-8(Interleukin-8,IL-8)是促炎症因子,而白介素-10(Interleukin-10,IL-10)是抑制炎症因子,它们在抗菌、抗病毒感染和免疫功能调节中发挥重要作用。已有研究表明,蝇蛆油溶液能减轻二甲苯引起的小鼠耳廓肿胀度,有抗炎作用[40],而目前仅在大西洋鲑(Salmo salar)中发现,黑水虻虫粉替代鱼粉对头肾细胞促炎基因IL-1β、IL-8、IL-10和TNF-α的转录无影响[41]。黑水虻幼虫脂肪酸的特殊性在于其中中链脂肪酸MCFA和月桂酸的浓度较高[42,43],中链脂肪酸MCFA是一种碳链为6-12碳的饱和脂肪酸,由于其快速氧化和吸收,以及其在养殖动物肠道微生物群中抗菌和抗病毒的特性而被广泛研究[44,45]。在本试验中黄颡鱼血清促炎症因子TNF-α、IL-6、IL-8和抗炎因子IL-10均随着黑水虻虫油替代量的增加而升高,这是否表明黑水虻虫油替代时黄颡鱼幼鱼血清促炎和抗炎细胞因子的动态平衡状态?由于目前相关资料比较缺乏,因此黑水虻虫油的抗炎作用及其机理需要深入研究。
3.5 黑水虻虫油脂替代豆油对黄颡鱼幼鱼肝脏脂滴面积的影响
肝脏是机体内脂肪合成的主要部位。肝脏脂肪沉积与从脂肪组织摄取的脂肪酸和肝脏脂肪合成有关[46],已有研究表明,植物油替代鱼油会造成饲料中PUFA的减少,促进大菱鲆幼鱼肝脏脏脂肪过多沉积[30],油酸和亚油酸比长链多不饱和脂肪酸显著增加了大黄鱼(Larmichthys crocea)肝脏和肌肉脂肪沉积[47]。然而在本实验中黄颡鱼幼鱼肝脏脂滴面积未受黑水虻虫油的影响。相反,Li等[5]发现随着黑水虻虫油替代量的增加,幼建鲤腹腔脂肪组织的脂肪细胞变小,认为这可能与黑水虻虫油内含有大量中链脂肪酸有关。鱼类代谢脂肪酸的能力与很多因素有关,比如鱼的种类、大小、生长周期等都可能对研究结果造成一定影响。
4 结论
黑水虻虫油完全替代豆油对黄颡鱼幼鱼生长性能、形体指标、体成分、营养物质表观消化率和抗氧化指标无显著影响,但提高了血清高密度脂蛋白胆固醇、抗炎和促炎因子含量,肝脏脂滴面积无显著变化。以生长性能为评价指标,当黄颡鱼幼鱼基础饲料中添加4%豆油时,黑水虻虫油能够完全替代豆油。
