新疆2 家牛场引进安格斯牛的牛病毒性腹泻、牛传染性鼻气管炎和布鲁氏菌病检测
2020-08-07李欣宇马晓菁谢彩云易新萍赵红琼刘丽娅谷文喜
李欣宇,叶 锋,钟 旗,马晓菁,谢彩云,易新萍,赵红琼,姚 刚,刘丽娅,谷文喜
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院兽医研究所,新疆乌鲁木齐 830000)
安格斯牛原产于英国的阿伯丁、安格斯和金卡丁等郡,全称为阿伯丁-安格斯牛[1],因性成熟早、屠宰率高、肉品优良、饲料转化率高、犊牛成活率高、难产率低,成为育种的父本或母本。1980年以来,我国越来越多的省份通过大量引进安格斯牛来改良当地品种。新疆自1999 年开始逐渐引进安格斯牛[2]。
牛病毒性腹泻/黏膜病(bovine viral diarrhea/mucosal disease,BVD/MD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起的,主要发生于牛的一种急性、热性传染病[3];牛传染性鼻气管炎(bovine infectious rhinotracheitis,IBR)又称坏死性鼻炎(necrotic rhinitis)、红鼻病(red nose disease),是由牛传染性鼻气管炎 病 毒(infectious bovine rhinotracheitis virus,IBRV)引起的一种牛接触性传染病[4]。布鲁氏菌病(brucellosis)是由布鲁氏菌(Brucella)引起的人兽共患传染病[5]。BVD、IBR 和布鲁氏菌病均可引起母畜流产,产畸形胎或免疫力低下犊牛等,临床上很难治愈,可终身带毒,引起患牛生产性能下降或死亡,对养牛业造成严重经济损失。为了解新疆当地流行疫病对引进安格斯牛的影响,本研究选择新引进安格斯牛的育种场A 和原有安格斯牛的育种场B,开展了BVD、IBR 和布鲁氏菌病的血清学和病原学检测,以期为安格斯牛养殖场的疫病防控提供参考。
1 材料与方法
1.1 样品来源
A 场存栏安格斯牛2 922 头,全部为8月龄左右的母牛,2018 年9月初从澳大利亚引入。该批安格斯牛引进时,BVD、IBR 和布鲁氏菌病检测均为阴性,在隔离期间,全部进行了IBRV 疫苗免疫,入场4 个月后,全群补免了BVDV 疫苗,同时加强免疫了IBRV 疫苗,未免疫布鲁氏菌疫苗。A 场自安格斯牛引入后,再未引进新牛及购买冻精。B场总存栏安格斯牛370 头,其中育成母牛216 头、犊牛154 头,为当地引进安格斯牛2 年以上牛场,常年购买冻精进行母畜繁殖,未免疫BVDV、IBRV 和布鲁氏菌疫苗。
按照《动物防疫抽样规范》(DB11/T 677—2009)要求,按存栏量的5%随机抽样,尾静脉采血,共采集170 份血样,4 ℃保存,其中A 场150 份、B 场20 份。
1.2 主要仪器
微量移液器(型号TopPette),购自北京大龙兴创实验仪器有限公司;灭菌移液器枪头(型号BT224-YS),购自生工生物工程(上海)股份有限公司;恒温箱二氧化碳培养箱(型号BCJ80-S),购自上海博迅实业有限公司医疗设备厂;PCR 扩增仪(型号AG22331Hamburg),购自德国Eppendorf 公司。其他仪器:计时器、洁净玻璃板、试管架等。
1.3 主要试剂
BVDV 抗原检测试剂盒、IBRV gB 抗体检测试剂盒,购自IDEXX 公司;EasyPure Blood Genomic DNA Kit、ddH2O,购自北京全氏金生物技术有限公司;2×PCRTaqPlus MasterMix with dye,购自爱必梦生物科技有限公司;DL 2 000 DNA Marker,购自生工生物工程(上海)股份有限公司;牛血清稀释液(0.5%石碳酸、0.85%NaCl),自行配制;布鲁氏菌虎红凝集抗原、布鲁氏菌试管凝集抗原,购自中国兽医药品监察所;布鲁氏菌标准阳性血清、标准阴性血清,购自黑龙江省生物制品一厂。
1.4 检测方法
对采集的全血分离血清,用BVDV 抗原ELISA 检测试剂盒和IBRV gB 抗体ELISA 检测试剂盒,分别进行BVDV 抗原与IBRV 抗体检测。对IBRV 抗体检测阳性的全部样品,提取DNA,用特异性引物扩增。用虎红平板凝集试验(RBT)结合试管凝集试验(SAT)进行布鲁氏菌检测。
1.4.1 IBRV 抗体ELISA 检测 按照IBRV gB 抗体ELISA 检测试剂盒说明书操作。
1.4.2 IBRV 核酸PCR 检测 将4 ℃抗凝血管中保存的样品放置室温,按照病毒液DNA 提取试剂盒说明书提取DNA。参考文献[6]合成gI 引物:上游引物为5'-cggcggtcgagcggcaagag-3',下游引物为5'-aggcgggaacacagctgggacaat-3',预期扩增片段大小为398 bp。引物由生工生物工程(上海)股份有限公司合成。反应体系为:PCR Mix 12.5 μL,上、下游引物各1 μL,模板1 μL,用ddH2O 补至25 μL。经反复试验摸索,确定PCR 扩增条件为:95 ℃预变性 5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环;72 ℃再延伸10 min。PCR 产物经1%琼脂糖凝胶电泳分析。
1.4.3 BVDV 抗原ELISA 检测 按照BVDV 抗原ELISA 检测试剂盒说明书操作。
1.4.4 布鲁氏菌抗体检测 采用RBT、SAT 方法,严格按照国家标准《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)操作。
2 结果
2.1 IBRV 抗体ELISA 检测
A、B 场的170 份样品全为IBRV 抗体阳性,抗体阳性率均为100%。
2.2 IBRV 核酸PCR 检测
经PCR 检测,A 场未检出IBRV 核酸阳性,阳性率为0;B 场检出4 份阳性,阳性率为20%(4/20)。阳性样品的PCR 检测结果见图1。
2.3 BVDV 抗原ELISA 检测
A、B 场全部170 份样品中,未检出BVDV抗原阳性,抗原阳性率均为0。
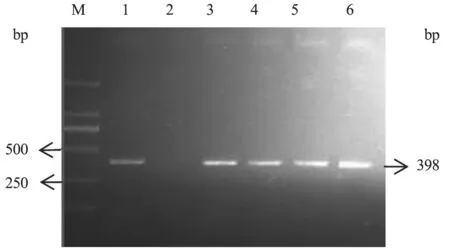
图1 B 场IBRV 阳性样品PCR 检测结果
2.4 布鲁氏菌抗体检测
A 场样品布鲁氏菌RBT 与SAT 法均未检出阳性,抗体阳性率均为0;B 场RBT 法未检出阳性,SAT 法检出1 份阳性,抗体阳性率为5%。
3 分析与讨论
本研究对新疆养殖安格斯牛的A、B 两个牛场进行BVDV、IBRV 和布鲁氏菌抗体和抗原检测,结果在A 场未检测出BVDV 抗原和布鲁氏菌抗体,IBRV核酸检测全为阴性,IBRV抗体检测全为阳性,说明该场新引进的安格斯牛未感染BVDV、IBRV和布鲁氏菌,IBRV 疫苗免疫效果良好;B 场已引进安格斯牛2 年以上,一直未进行过BVDV、IBRV 和布鲁氏菌疫苗免疫,但其IBRV 抗体阳性率为100%,IBRV 核酸PCR 阳性率为20%,布鲁氏菌抗体阳性率为5%,说明该场存在IBRV 和布鲁氏菌感染。
本次检测在2 个牛场虽均未检测到BVDV,所以存在较高的BVDV 感染风险,但因新疆地区的BVD、IBR 和布鲁氏菌病流行状况较为严重。2007 年郭燕[7]对新疆北疆部分集约化奶牛场进行BVDV 分子流行病学调查,发现平均抗原阳性率为35.4%;2019 年马振国[8]对新疆地区5 833 份牛血清进行BVDV 抗体检测,发现阳性率为52.03%。2012 年邹世颖等[9]对我国北方六省市进行IBR流行病学分析发现,新疆地区4 个规模化牛场的IBRV 抗体阳性率高达68%;2018 年张迎春等[10]对新疆南疆部分规模牛场进行IBR 血清流行病学调查,发现规模化奶牛场的IBRV 群抗体阳性率高达100%。2012 年李玲等[11]对南北疆、十三地州13 个县(市)的3 600 份牛血清进行布鲁氏菌抗体检测,发现阳性率为0.38%;2019 年齐姗姗[12]对新疆乌鲁木齐县的1 203 份奶牛血清进行布鲁氏菌抗体检测,发现阳性率为4.7%。
新引进的安格斯牛经进境检疫检测,虽可以保证未感染BVDV、IBRV 和布鲁氏菌,但引入后,因周边存在这些疫病的流行,防控稍有松懈,就会引入病原。因此,建议牛场实施全群IBRV 和BVDV 疫苗免疫,筛选并淘汰持续感染(PI)牛;严格外购冻精、胚胎的BVDV、IBRV 和布鲁菌检测;坚持自繁自养,慎重从场外引进牛只。
4 结论
本研究对新引进安格斯牛和引进2 年以上安格斯牛的2 家牛场进行BVDV、IBRV 和布鲁氏菌病原学和血清学检测,发现安格斯牛引进后存在较大的BVDV、IBRV 和布鲁氏菌感染风险,提示该地养殖场必须严格实施疫病防控措施,防止引进牛群感染当地流行疫病病原。
