猪血凝性脑脊髓炎病毒实时荧光RT-PCR 检测方法的建立与应用
2020-08-07张安洁董雅琴李晓成
张 慧,张安洁,张 锋,尼 博,刘 爽,崔 进,董雅琴,李晓成,魏 荣
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.云南农业大学动物医学院,云南昆明 650201)
猪血凝性脑脊髓炎病毒(porcine hemagglutinating encephalomyelitis virus,PHEV)属于冠状病毒科β 冠状病毒属,1962 年在加拿大首次被分离到[1]。猪是PHEV 唯一自然易感动物,所有年龄的猪对其均易感,3~4 周龄以下仔猪感染后较易出现临床症状,表现为厌食、呕吐、沉郁、肌肉颤抖等,最后消瘦、死亡,致死率可高达100%[2-3]。血清学调查[3-4]显示,该病的隐性感染在我国及世界各地普遍存在。鉴于目前尚无疫苗可用及基因变异的潜在威胁,该病的病原学诊断非常重要。本研究建立了PHEV 快速、特异、敏感的实时荧光RT-PCR 检测方法,并进行了临床样品检测的初步应用。
1 材料与方法
1.1 试剂与仪器
超净工作台:美国Forma Scientific 公司;移液器:Eppendorf;涡旋振荡器:美国Scientific Industries 公司;荧光定量PCR 仪:Bio-Rad CFX96 Real-time PCR System;核酸提取仪:德国QIAGEN 公司;电泳仪:Bio-Rad 公司;凝胶成像系统:Bio-Rad GelDoc EZ。
HiScript II U+One Step qRT-PCR Probe Kit,2×TaqMaster Mix(Dye Plus):诺唯赞生物科技有限公司;Evo M-MLV 一步法RT-PCR 试剂盒:艾科瑞生物工程有限公司;核酸提取试剂盒:德国QIAGEN 公 司;Low-Profile PCR Tubes 8-tube strip、Optically clear flat 8 Cap Strips:Bio-Rad 公司。异丙醇、无水乙醇等,均为国产分析纯试剂。
1.2 引物、探针设计及阳性质粒合成
GenBank 中下载不同国家、不同分离时间的PHEV 毒株结构蛋白(S、M、N、HE)基因序列,采用MEGA 6.0 进行序列比对,选择加拿大分离株(GenBank 登录号AF481863)N 蛋白基因为参考序列,用primer express 3.0.1 软件设计引物和探针。将该N 蛋白基因序列送至华大基因公司合成并克隆至Puc57 质粒,构建重组质粒Puc57-PHEVn。
1.3 反应条件优化
依次选择PHEV-f、PHEV-r 终浓度0.9、0.3、0.1 μmol/L,probe 终浓度0.05、0.15、0.25 μmol/L,退火温度56、57、58 ℃进行正交试验,优化反应条件。配制反应体系20 μL:2×One Step U+Mix 10 μL、One Step U+Enzyme Mix 1 μL,引物和探针按终浓度加入,阳性质粒Puc57-PHEVn(34 ng/μL)1 μL,RNase free ddH2O 补齐至20 μL。RT-PCR 反应条件为:第1 阶段,55 ℃15 min;第2 阶段,95 ℃ 30 s;第3 阶段,95 ℃10 s,56~58 ℃ 30 s,40 个循环。
1.4 敏感性和特异性评估
先将Puc57-PHEVn 稀释至1 ng/μL,之后依次10 倍稀释至10-1~10-7ng/μL;取1 μL 作为反应模板,按照1.3 中优化好的反应条件进行实时RT-PCR 反应,评估敏感性;每个梯度重复2 次,并绘制标准曲线。提取猪繁殖与综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪瘟病毒(CSFV)、猪圆环病毒2 型(PCV2)核酸,评估该方法的特异性。
1.5 临床样品检测
采集山东、广西、河南、江西等地发病猪组织样品共计233 份,加入PBS(pH7.2)缓冲液匀浆,4 ℃ 12 000 r/min 离心10 min;取上清提取病毒核酸,加入上述反应体系进行实时RT-PCR。同时,参照Sekiguchi等[2]2004 年建立的巢式PCR 方法,对样品核酸进行平行检测,并将扩增目的片段送华大基因测序,同时与本试验建立方法进行结果比对,计算两种方法的符合率。
2 结果与分析
2.1 引物和探针筛选
最终筛选出的上下游引物和探针序列见表1。探针5'端进行荧光基团Texas red 标记,3'端进行淬灭基团BHQ2 标记。

表1 引物及探针序列
2.2 反应条件优化
以Puc57-PHEVn为模板,采用“四因素三水平”正交试验进行实时荧光RT-PCR 反应,得出最佳反应条件为PHEV-f、PHEV-r 终浓度均为0.9 μmol/L,probe 终浓度为0.25 μmol/L,退火温度为56 ℃时,荧光信号最强,起峰较早,扩增曲线最明显(图1)。
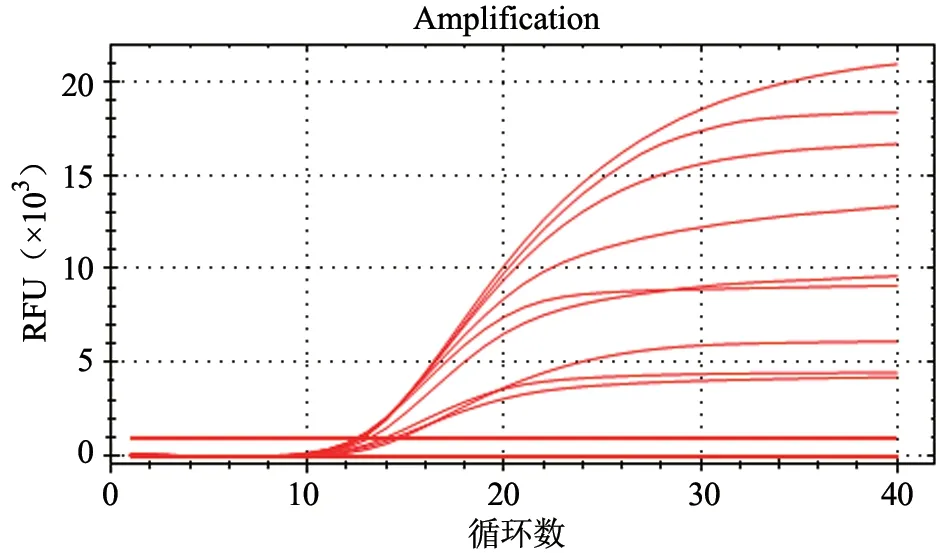
图1 反应条件优化结果
2.3 敏感性和特异性
筛选的引物和探针在优化的反应条件下,检测的Puc57-PHEVn 灵敏度为10-6ng/μL。按照公式DNA 拷贝数/μL=[6.02×1023×DNA 浓度(ng/μL)×10-9]/(DNA 碱基数×660),计算出的拷贝数为224 拷贝/μL(图2)。标准曲线见图3,扩增效率E=93.6%,R2=0.998。特异性试验结果显示,仅有阳性质粒Puc57-PHEVn 有明显扩增曲线,上述其他病毒及阴性对照均未出现扩增曲线(图4)。
2.4 临床样品检测
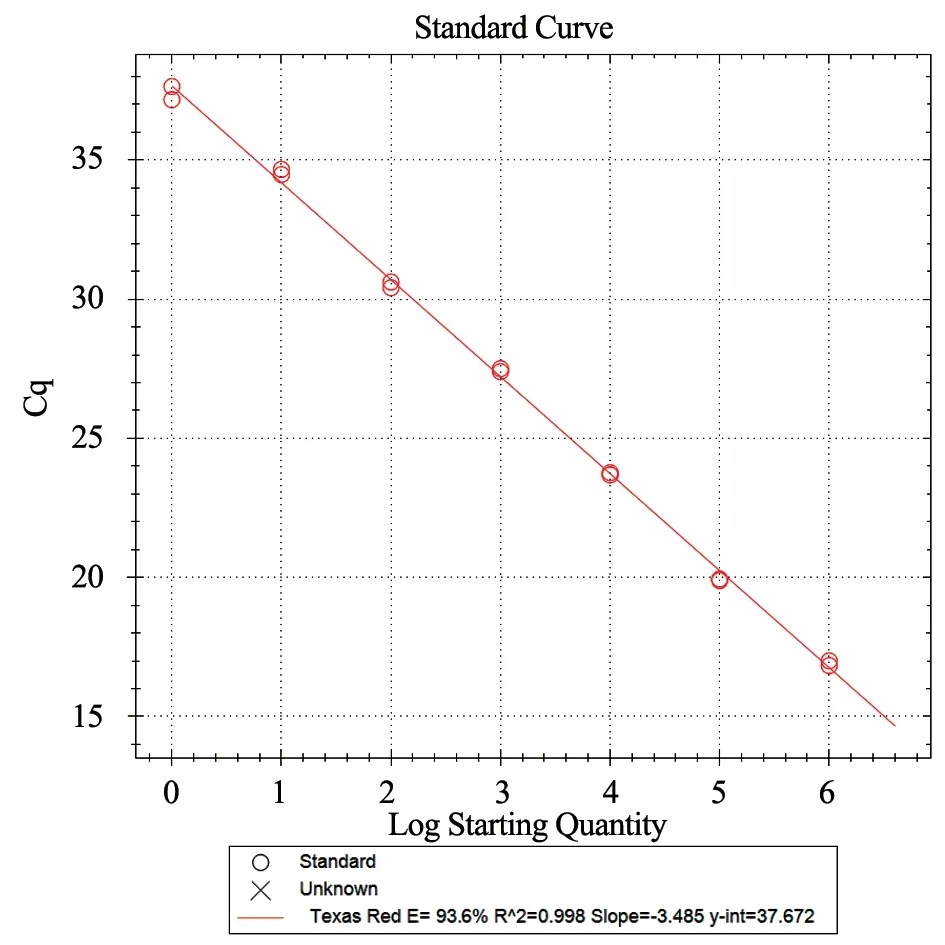
图3 PHEV 实时荧光RT-PCR 标准曲线
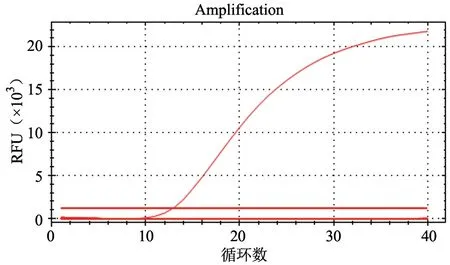
图4 PHEV 实时荧光RT-PCR 特异性试验结果
Ct ≤36 且出现典型扩增曲线,判为阳性;36 <Ct <40 且出现典型扩增曲线,重复检测仍为阳性,则判为阳性,否则为阴性;无Ct 值且无扩增曲线,判为阴性。用建立的实时荧光RT-PCR,对233 份发病猪组织样品进行检测,结果18 份为阳性,而巢式RT-PCR扩增并测序阳性的为14份(表2),两种方法符合率为98.3%。部分巢式RT-PCR结果见图5,最终扩增片段为110 bp。
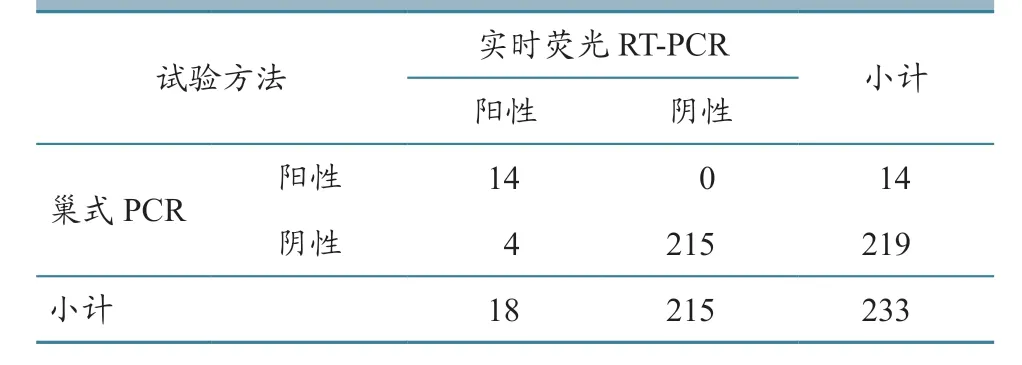
表2 两种方法临床样品检测结果 单位:份
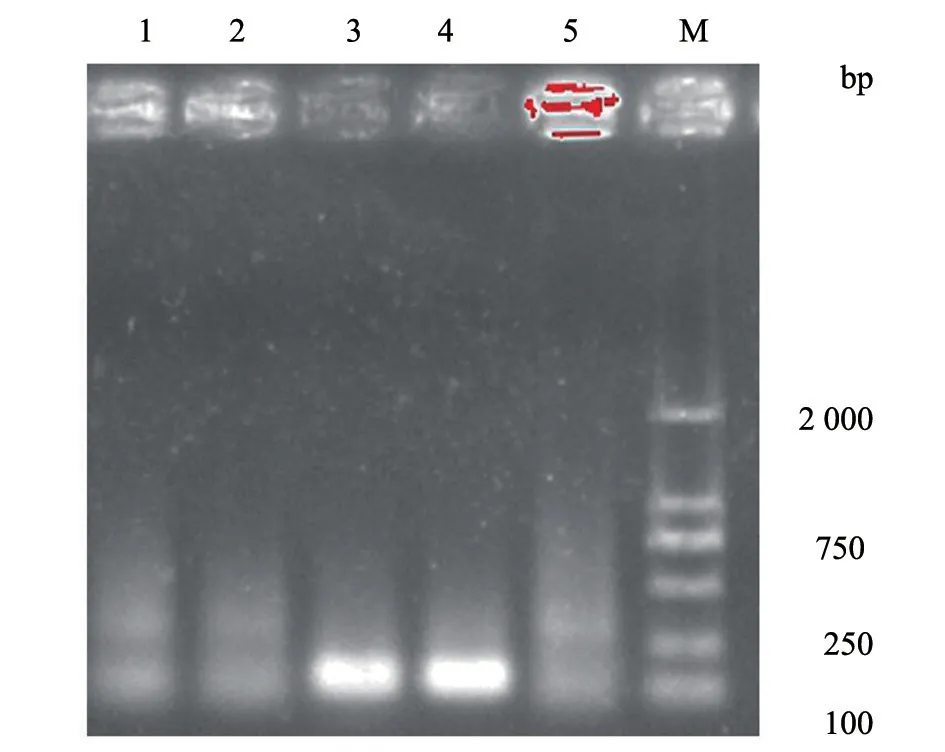
图5 巢式RT-PCR 检测部分样品电泳图
3 讨论
PHEV 已在世界范围内流行[5],其基因组的结构特点及其独特的套式系列转录方式决定其容易发生变异和进化,致使其致病性和抗原性复杂多变[1]。虽然本研究在采自山东、广西、河南、江西等地的样品中均检出阳性,但该病临床暴发的报道却不多。猪群感染PHEV 后,3~4 周龄仔猪较易出现临床症状,而母猪及育肥猪可针对病毒产生较强的体液免疫,母猪还可通过初乳对仔猪提供免疫保护,这可能是世界范围内PHEV 临床暴发并不多的原因[3,6-7]。我国仅吉林省和台湾地区报道过该病的暴发[8-10]。本研究所用临床样品为发病猪组织样品,在检出PHEV 的同时,均有PRRSV、PRV或PEDV等病毒检出。PHEV 与这些病原的相关性仍需进一步研究。因此,随着病毒的变异及养殖模式的变化[2-3],PHEV 对猪群仍有一定的威胁。
目前,国内外已建立了针对PHEV 的RTPCR[6,9]及巢式RT-PCR 方法[2],但这些方法均耗时较长。臧德跃等[11]根据PHEV S 蛋白基因建立了SYBR Green I 荧光定量RT-PCR 方法。该方法具有快速、特异、敏感和重复性好等优点,为疾病早期快速诊断提供了良好的技术手段。目前国内尚未有PHEV 探针法荧光定量RT-PCR 方法的报道。本研究根据N 蛋白基因建立的PHEV 荧光定量RT-PCR 探针法,对阳性质粒的检测下限达10-6ng/μL,即224 拷贝/μL。将该方法与巢式RTPCR 同步应用于临床检测,结果两种方法的符合率达98.3%,准确筛查出巢式RT-PCR 并测序阳性的14 份样品,且实时荧光RT-PCR 检出率为7.7%(18/233),高于巢式RT-PCR 的6.0%(14/233),敏感性和重复性均较好。该方法的建立补充了现有PHEV 的分子生物学检测方法,为该病的有效防控提供了技术支撑。
