重组结核杆菌融合蛋白(EC)的免疫特性和临床前安全性研究
2020-08-07张凯陶立峰韦芬都伟欣仇晶晶陈伟陈保文朱银猛程兴苏城钟再新卢锦标蒲江
张凯 陶立峰 韦芬 都伟欣 仇晶晶 陈伟 陈保文 朱银猛 程兴 苏城 钟再新 卢锦标 蒲江
肺结核是由结核分枝杆菌感染引起的严重危害人类健康的疾病。据WHO[1]估计,全球潜伏性结核感染(latent tuberculosis infection,LTBI)人群约17亿,约占全人群的1/4左右。2018年全球结核病新发患者约1000万例,约145万例死于结核病[2]。WHO[3]提出了2035年“终止结核病”战略目标,将结核病发病率控制在10/10万以下。WHO 2018年发布的LTBI管理指南及关于结核病发病率低的国家及地区消灭结核病的新框架文件中,都将LTBI者的筛查与预防作为控制结核病疫情的重要手段[4]。因此,如何简便、高通量诊断结核感染者并实施预防是结核病防治工作的关键。
差异区域1(region of difference-1,RD-1)是结核分枝杆菌在长期传代过程中丢失的重要保护性抗原,RD-1仅存在于致病性分枝杆菌中,而在卡介苗及环境分枝杆菌中缺失。目前,国内外均以RD-1基因编码的结核分枝杆菌早期分泌性抗原靶6(ESAT-6)和培养滤液蛋白10(CFP-10)为研究热点[5],制成的结核感染鉴别用变态反应原皮肤试验(IST),既有γ-干扰素释放试验(IGRA)特异性又有结核菌素皮肤试验(TST)适合大规模筛查的简便性,是极具潜力的新一代结核分枝杆菌感染筛查试剂。本研究的重组结核杆菌融合蛋白(EC)(该制品名称是国家药典委员会确定的药品中文通用名称,“EC”为重组融合蛋白“ESAT-6和CFP-10”)(简称“EC”),有望应用于结核分枝杆菌感染的诊断和结核病的辅助诊断。
资料和方法
一、 材料
(一) 菌株
结核分枝杆菌H37Ra,上海复旦大学三级安全防护实验室提供并开展相关试验;卡介菌,安徽智飞龙科马生物制药有限公司提供。
(二) 主要试剂
EC原液,安徽智飞龙科马生物制药有限公司生产;TB-PPD (50 IU/ml,批号:20171010),北京祥瑞生物制品有限公司生产。
(三) 实验动物
无特殊病原体(specific pathogen free,SPF)级白色豚鼠,34只,雌性22只,雄性12只,体质量300~400 g,购自北京维通利华实验动物技术有限公司;新西兰兔,6只,雌雄各半,体质量2 ~3 kg,由浙江省实验动物中心提供;ICR[(美国)Institute of Cancer Research]小鼠,80只,雌雄各半,体质量17~19 g,由浙江省实验动物中心提供。
二、方法
(一) 迟发型超敏反应试验
1. 动物筛选(TB-PPD)皮肤试验:将体质量合格豚鼠背部局部去毛,用酒精棉消毒去毛部位皮肤,用1 ml注射器吸取 50 IU/ml 的TB-PPD,在去毛部位皮内注射 0.2 ml TB-PPD,注射部位应有皮丘凸起,旋转180°拔出针头。于注射后48 h观察局部硬结或红晕反应的纵径与横径(以硬结或红晕反应大者为准),平均硬结或红晕反应直径[(纵径+横径)/2]≥5 mm判为阳性,<5 mm判为阴性;TB-PPD 皮肤试验阴性豚鼠留做试验用。
2. 效价测定:选取6只经TB-PPD皮肤试验阴性的300~400 g SPF级雌性豚鼠,每只豚鼠大腿腹股沟内侧皮下注射结核分枝杆菌H37Ra活菌菌液0.5 ml,致敏5周后,将豚鼠背部脊柱两侧去毛,去毛后每只豚鼠于背部脊柱两侧以轮圈法皮内注射2.5 μg/ml EC原液0.2 ml。于注射后24 h观察局部硬结或红晕的纵径与横径(以硬结或红晕反应大者为准),平均硬结或红晕反应直径[(纵径+横径)/2]≥5 mm判为阳性,<5 mm判为阴性。
3. 鉴别试验:选取4只经TB-PPD皮肤试验检测阴性的300~400 g SPF级雌性豚鼠,豚鼠大腿腹股沟内侧皮下注射卡介菌活菌菌液0.5 ml,致敏5周后,将豚鼠背部脊柱两侧去毛,去毛后每只豚鼠于背部脊柱两侧以轮圈法皮内注射20 μg/ml EC原液和50 IU/ml TB-PPD各0.2 ml,于注射后48 h观察局部硬结或红晕的纵径与横径(以硬结或红晕反应大者为准),平均硬结或红晕反应直径[(纵径+横径)/2)]≥5 mm判为阳性,<5 mm判为阴性。
(二) EC临床前安全性研究
将EC原液送浙江省医学科学院安全性评价研究中心进行急性毒性试验、豚鼠全身主动过敏试验和兔皮内刺激试验进行临床前安全性研究。
1. 急性毒性试验:取80只健康ICR小鼠,分为背部皮肤单次单点肌内注射组和皮内注射组,每组40只,雌雄各半;每组再分为4组,每组10只,雌雄各半。高剂量组(注射EC 53.61 μg/0.1 ml)、低剂量组(注射EC 0.2 μg/0.1 ml)、溶剂对照组(注射EC稀释液0.1 ml)、空白对照组(不给予任何受试物)。给药前禁食,给药后立即观察小鼠的外观、运动功能、排便、尿、皮肤、口、眼、鼻等一般情况。给药第一天每隔0.5 ~1.0 h观察1次,以后每天观察1次,连续观察14 d。在此期间,观察记录所有出现的症状、症状起始时间、严重程度、持续时间及死亡分布情况,并在0 d、1 d、3 d、5 d、7 d、8 d、10 d、12 d、14 d称量小鼠体质量。试验结束后,将小鼠通过颈椎脱臼安乐处死,并进行大体解剖,观察各脏器和药物注射部位皮肤是否有异常病变。
2. 豚鼠全身主动过敏试验:取健康无伤白色普通级豚鼠24只,分为4组,每组6只,雌雄各半,各组豚鼠分别隔日腹腔注射高剂量(5 μg/kg)、低剂量(0.5 μg/kg)EC,牛血清白蛋白(60 mg)(阳性对照组)和0.9%NaCl(质量分数为0.9%的NaCl溶液)注射液(2 ml)(阴性对照组),连续3次。致敏结束,末次致敏后第12天静脉快速注射2倍致敏剂量对以上相应的各组致敏豚鼠进行激发。致敏期间,每天观察豚鼠的症状,并于初次和最后一次致敏及激发当日测定豚鼠的体质量。静脉注射激发后即刻至30 min,观察并记录豚鼠反应症状,并评价豚鼠全身致敏反应,过敏反应阴性(-):正常;过敏反应弱阳性(+):出现不安宁、竖毛、发抖、搔鼻;过敏反应阳性(++):出现喷嚏、咳嗽、呼吸急促、排尿、排粪、流泪;过敏反应强阳性(+++):出现呼吸困难、哮鸣音、皮肤紫癜、步态不稳、跳跃、喘息、痉挛、旋转、潮式呼吸;过敏反应极强阳性(++++):死亡。
3. 兔皮内刺激试验:取健康皮肤无伤新西兰兔6只,试验前24 h,剃毛刀剔除每兔脊椎两侧的毛。兔背部左右侧去毛区分别单次皮内注射EC 10 μg(0.2 ml)/点和相同容量的0.9% NaCl(质量分数为0.9%的NaCl溶液)注射液0.2 ml/点剂量,每侧5个点,每点间隔2 cm,注射后即刻、24 h、48 h和72 h 观察注射局部及其周围皮肤组织反应,包括红斑、水肿和坏死等。于末次给药后72 h由耳静脉注入空气处死兔,解剖观察注射部位的皮肤组织的变化,并进行病理组织学检查。
三、 统计学处理

结 果
一、 迟发型超敏反应试验
EC原液诱导结核分枝杆菌H37Ra活菌致敏豚鼠的24 h皮肤试验,阳性为6只(表1);TB-PPD诱导卡介菌活菌致敏豚鼠的48 h皮肤试验,阳性为4只;EC诱导卡介菌活菌致敏豚鼠的48 h皮肤试验,阳性为0只(表2)。
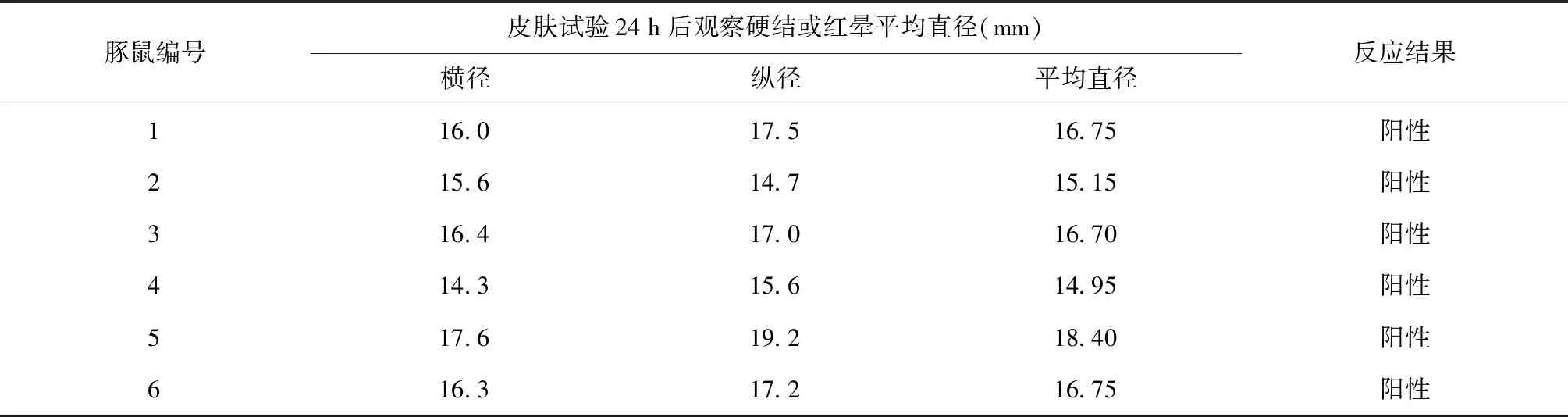
表1 EC对结核分枝杆菌H37Ra活菌致敏豚鼠迟发型超敏反应试验结果
二、 急性毒性试验结果
在整个试验过程中,高剂量组、低剂量组、溶剂对照组、空白对照组小鼠的外观、运动功能、排便、排尿、皮肤、口、眼、鼻等一般情况未出现任何异常反应和死亡。小鼠皮内注射EC在不同观察时间点,即注射前、注射后1 d、3 d、5 d、7 d、8 d、10 d、12 d、14 d EC高剂量组、低剂量组小鼠平均体质量分别为(20.6±1.3) g~(24.9±2.1) g、(20.5±1.6) g~(26.0±3.1) g;注射后不同观察时间各组平均体质量和相应时间的空白对照组[(21.0±1.1) g~(25.3±2.3) g]比较差异均无统计学意义(P值均>0.05)(表3)。小鼠肌内注射EC在不同观察时间点,即注射前、注射后1 d、3 d、5 d、7 d、8 d、10 d、12 d、14 d EC高剂量组、低剂量组小鼠平均体质量分别为(21.0±1.5) g~(26.2±1.9) g、(20.5±2.1) g~(25.8±3.8) g;注射后不同观察时间各组平均体质量和相应时间的空白对照组[(21.2±1.7) g~(25.8±3.1) g]比较差异均无统计学意义(P值均>0.05)(表4)。试验结束后解剖所有试验小鼠,各脏器和药物注射部位皮肤均未发现任何肉眼可见的异常病变。

表3 皮内注射EC前后不同观察时间各组小鼠的体质量比较
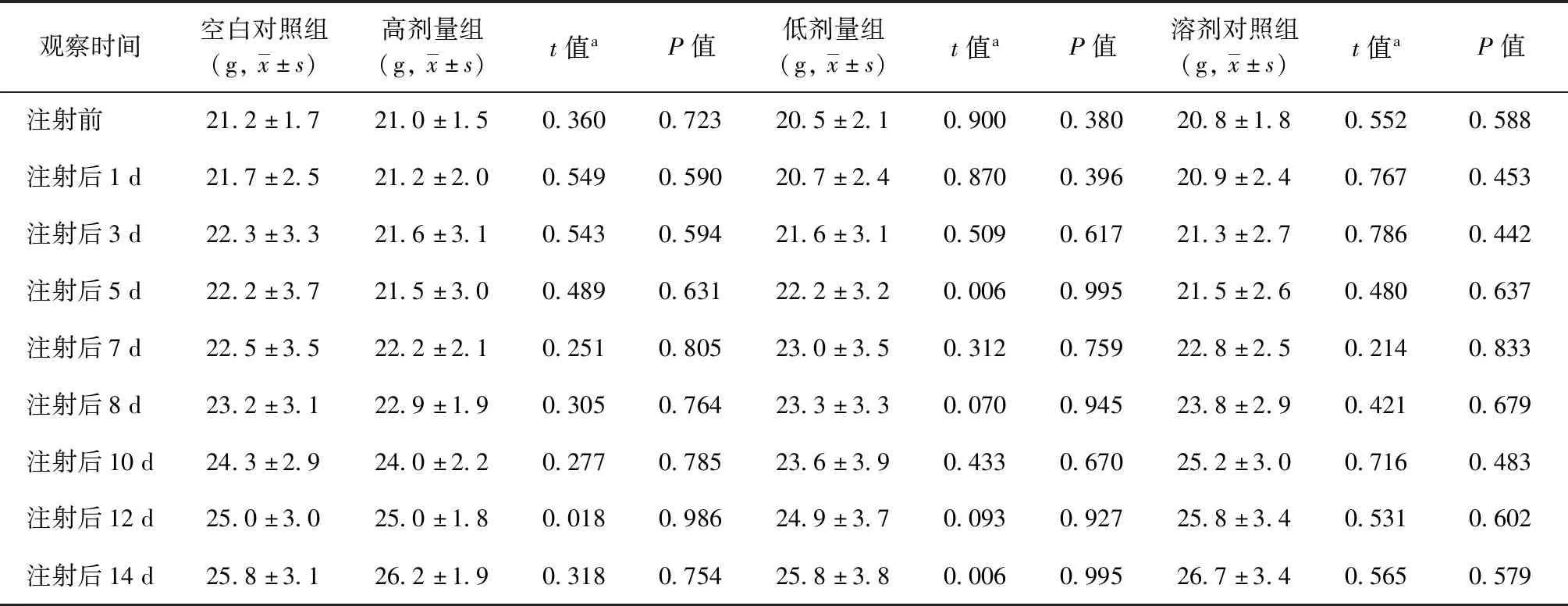
表4 肌内注射EC前后不同观察时间各组小鼠的体质量比较
三、 豚鼠全身主动过敏试验结果
各试验组豚鼠在致敏期间均未见明显异常反应,体质量也均随试验时间延长而增加。高剂量组、低剂量组豚鼠首次致敏、末次致敏、激发时的平均体质量分别为(327.5±24.3) g、(347.2±32.7) g、(402.2±34.9) g;(331.3±26.7) g、(346.2±32.0) g、(411.3±38.9) g,与相应时间的0.9% NaCl注射液阴性对照组[(329.5±27.4) g、(348.3±27.0) g、(399.4±25.4) g]比较差异均无统计学意义(P值均>0.05)(表5)。末次致敏后第12天给予激发剂量后,高剂量组、低剂量组与相应时间阴性对照组均无过敏反应发生。而阳性对照组豚鼠均出现明显的过敏反应症状,主要表现为不安宁、竖毛、发抖、搔鼻、喷嚏、咳嗽、呼吸急促、排尿、流泪、呼吸困难、步态不稳、跳跃、痉挛,甚至死亡,死亡时间在给药后5 min左右,有过敏反应的存活豚鼠在给药后30 min内逐渐恢复正常,其发生过敏反应的豚鼠有6只,死亡数为3只,过敏反应为极强阳性(表6)。
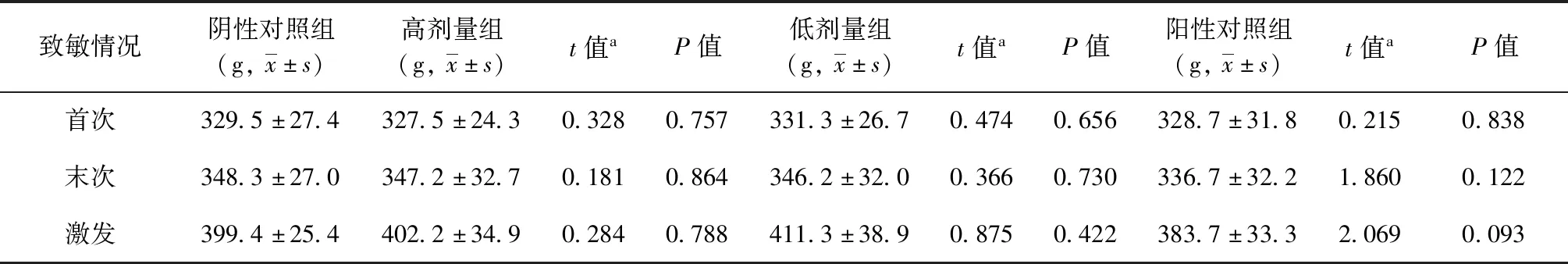
表5 注射EC全身主动过敏试验致敏后不同时间各组豚鼠的体质量比较

表6 EC不同剂量组豚鼠全身主动过敏试验结果
四、 兔皮内刺激试验结果
兔背部分别单次皮内注射0.9%NaCl、 EC后,在各观察时间点均未见皮肤红斑、水肿现象。停药72 h后解剖,可见兔左、右侧给药局部皮肤色泽均匀、红润,无红斑、水肿、突起、溃疡等异常。镜下检查,兔左、右侧给药局部皮肤各层均未见充血、水肿、变性和炎性浸润等病理变化(图1,2)。

皮肤各层未见充血、水肿、变性和炎性浸润等病理变化图1 兔皮内注射0.9%NaCl注射液后局部皮下组织学切片(HE ×400)
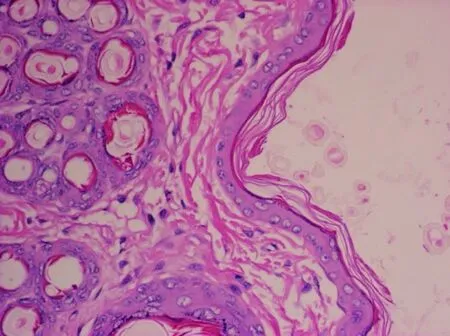
皮肤组织结构正常,各层未见充血、水肿、变性和炎性浸润等病理变化图2 兔皮内注射EC后局部皮下组织学切片(HE ×400)
讨 论
结核病作为单病因致死率最高的传染性疾病,由于人口流动、耐药结核分枝杆菌和结核分枝杆菌与人获得性免疫缺陷病毒双重感染等因素,结核病防治工作面临巨大的挑战[6]。因此,如何早期发现高危人群并给予预防是结核病控制的重要问题,而其中寻找能诊断和确定患者体内是否留有存活结核分枝杆菌应该是实现的关键。目前对于LTBI患者的诊断手段主要有IGRA及PPD皮肤试验,但IGRA检测费用昂贵、检测技术高等实际问题,难以在结核病高发的发展中国家实施;PPD皮肤试验不能有效区分卡介苗接种与结核感染,更不能鉴别结核感染者体内有无存活的结核分枝杆菌[7]。因此,研制一种特异性强、方便使用的结核病诊断试剂对控制我国结核病传染具有重要价值。
结核分枝杆菌生长期间分泌的蛋白对结核病的保护性免疫作用非常重要。迄今为止,大量结核分枝杆菌的抗原被作为结核病疫苗的候选蛋白。据报道,现已用基因工程技术研究了分枝杆菌的多种抗原蛋白,比如CFP-10、ESAT-6和Ag85家族蛋白[8-9]。ESAT-6蛋白诱导机体产生明显的T细胞免疫应答和释放高水平γ-干扰素(IFN-γ),具有良好的抗原刺激性并能被大多数结核病患者所识别;CFP-10与ESAT-6 同属于ESAT-6家族,也是免疫优势抗原,能诱导机体产生免疫应答。
根据Swissprot和GenBank数据库资料分析,ESAT-6和CFP-10基因严格限制于结核分枝杆菌复合群和4种非结核分枝杆菌(堪萨斯分枝杆菌、海分枝杆菌、微黄分枝杆菌和苏加分枝杆菌)中,卡介苗和大部分非结核分枝杆菌缺失[10-12],因此ESAT-6和CFP-10蛋白不受卡介苗和绝大多数环境分枝杆菌的影响,具有很好的特异性。EC对结核分枝杆菌H37Ra活菌致敏豚鼠的皮肤试验,阳性为6只;对卡介菌活菌致敏豚鼠的皮肤试验,阳性为0只。迟发型超敏反应试验表明,EC能够鉴别结核感染与卡介苗免疫。
临床前动物安全性研究表明,采用不同注射方式(单次皮内注射和单次肌内注射),EC在每只鼠注射高剂量(53.61 μg)和等效剂量(0.2 μg)的条件下,所有小鼠未出现明显的急性中毒反应和显示有急性中毒的靶器官。采用3次腹腔注射致敏和1次静脉注射激发的模式,豚鼠在致敏期间均未见明显异常反应,体质量随试验时间延长而增长;激发后,注射EC高剂量组、低剂量组均无过敏反应发生,表明EC对豚鼠无过敏反应。采用单次皮内注射方式,EC在试验剂量[10 μg(0.2 ml)/点,每侧5个点]条件下,对兔皮内无明显刺激反应。 EC临床前动物试验安全性好,能够鉴别结核感染与卡介苗免疫,有望应用于人群结核感染的诊断与鉴别诊断。
