重组结核杆菌融合蛋白(EC)的稳定性与有效性研究
2020-08-07杨蕾韦芬张凯仇晶晶汪莹莹都伟欣卢锦标陶立峰蒲江
杨蕾 韦芬 张凯 仇晶晶 汪莹莹 都伟欣 卢锦标 陶立峰 蒲江
重组结核杆菌融合蛋白(EC)[该制品名称是国家药典委员会确定的药品中文通用名称,“EC”为重组融合蛋白“结核分枝杆菌早期分泌性抗原靶6(ESAT-6)和培养滤液蛋白10(CFP-10)”](以下简称“EC”)是安徽智飞龙科马生物制药有限公司自主研发的产品,该产品利用基因工程技术将ESAT-6和CFP-10基因融合后表达ESAT-6与CFP-10蛋白,能有效鉴别卡介苗(BCG)接种和结核分枝杆菌(MTB)感染,是一种特异性强、使用方便的MTB感染用体内诊断试剂[1-3]。由于蛋白对温度敏感,存放温度不当可能导致其理化性质、免疫原性和效价发生变化,因此,该类制品的温度稳定性是质量控制的关键因素,对制品的储存、运输、分发和使用有重要指导作用[4-5]。笔者根据《生物制品稳定性研究技术指导原则(试行)》[6]对EC原液、成品进行储存稳定性及成品使用稳定性研究,获得EC稳定性试验结果,为该产品的生产、运输、贮存和使用方法的制订提供了数据支持。
材料和方法
一、材料与来源
EC原液,液体剂型,规格为≥450 μg/ml,批号为M20101101、M20101102、M20101201;EC成品,液体剂型,规格为每瓶15 U/0.3 ml,批号为20150501c、20150502c、20150503c;EC成品,液体剂型,规格为每瓶50 U/1.0 ml,批号为20171204、20171205、20171206;EC原液参考品,规格为≥450 μg/ml,成分与EC原液相同;EC成品参考品,规格为每瓶50 U/1.0 ml,成分与EC成品相同;EC稳定剂为0.001 mol/L的磷酸盐缓冲液(PBS);均由安徽智飞龙科马生物制药有限公司研制。结核菌素纯蛋白衍生物(TB-PPD),规格为50 IU/ml,北京祥瑞生物制品有限公司生产。
二、实验动物
无特定病原体(SPF)级昆明(KM)小鼠,体质量18~20 g、雌雄不限,购自安徽医科大学;SPF级Hartley豚鼠,体质量300~400 g,雌雄不限,购自北京维通利华实验动物技术有限公司。
三、动物致敏用菌液
结核分枝杆菌减毒株(H37Ra)活菌菌液由上海复旦大学三级安全防护实验室提供;BCG由安徽智飞龙科马生物制药有限公司提供。
四、主要仪器和试剂
紫外分光光度计为岛津仪器(苏州)有限公司产品;高效液相色谱仪(HPLC 1260)为安捷伦科技(中国)有限公司产品;等电点水平电泳仪为通用电气(中国)有限公司产品;SpectraMax多功能酶标仪为美谷分子仪器(上海)有限公司产品;垂直电泳仪、小型转印槽为伯乐生命医学产品(上海)有限公司产品。
Quant-iTTMPicoGreen dsDNA Assay Kit试剂盒为赛默飞世尔科技(中国)有限公司产品;卡那霉素快速检测试剂盒为北京勤邦生物技术有限公司产品;大肠埃希菌宿主菌蛋白质残留量检测试剂盒(E.Colihost cell protein)为美国Cygnus Techno-logies 公司产品;牛血清白蛋白购自中国食品药品检定研究院;重组结核分枝杆菌ESAT-6与CFP-10融合蛋白兔多抗由中国食品药品检定研究院分发;山羊抗兔IgG/辣根酶标记为北京中杉金桥生物技术有限公司产品。
五、方法
(一)原液储存稳定性研究
将3批EC原液(批号:M20101101、M20101102、M20101201)保存于-70 ℃,保存0、3、6、9、12、18、24、36个月时取样检测,检测项目和检测方法如下。
1. 致敏效应试验:试验组与对照组分别用体质量300~400 g未做过任何试验的豚鼠各3只。试验组每只豚鼠皮内注射0.1 ml EC原液,共3次,每次间隔5 d;对照组每只豚鼠皮内注射0.1 ml EC稳定剂,共3次,每次间隔5 d。在第3次注射后15 d,试验组与对照组均各皮内注射0.1 ml EC原液,观察试验组与对照组动物反应,连续观察3 d。
2. 鉴别试验:取经卡介苗致敏的豚鼠4只,以轮圈法于每只豚鼠背部脊柱两侧皮内注射20 μg/ml EC原液与50 IU/ml TB-PPD各0.2 ml;48 h后观察测量TB-PPD局部反应硬结和EC原液局部反应硬结或红晕的纵径和横径(以硬结或红晕大者为准),计算平均直径(纵径和横径测量值相加除以2)。
3.效价检测:分别将EC原液及其参考品稀释至2 μg/ml、4 μg/ml及6 μg/ml。取6只经MTB活菌致敏的豚鼠,去毛后于背部脊柱两侧以轮圈法分别皮内注射上述3种稀释度的EC原液及其参考品各0.2 ml,分别于注射后24 h和48 h 2次测量局部反应硬结或红晕的纵径和横径(以硬结或红晕反应大者为准),求出硬结或红晕的平均直径(纵径与横径测量值相加除以2);同时计算每个稀释度注射后2次测量局部反应的平均硬结或红晕直径总和(每个稀释度6只豚鼠皮内注射后24 h和48 h测量局部反应的硬结或红晕平均直径总和),求出各稀释度EC原液与相应稀释度参考品皮内注射后2次测量局部反应的硬结或红晕平均直径总和的比值。
4. 理化检定项目:EC原液外观、蛋白质含量、纯度(电泳法)、细菌内毒素检查、无菌检查、鉴别试验(免疫印迹法)、分子量、等电点、紫外光谱扫描、外源性DNA残留量、残余抗生素活性、宿主菌蛋白残留量、肽图、N-端氨基酸序列,均按照《中华人民共和国药典(2015年版 三部)》[7]所规定的方法进行。
(二)EC成品储存稳定性研究
将3批EC成品(批号:20150501c、20150502c、20150503c)分别保存于37 ℃和2~8 ℃。37 ℃保存0、7、14、21、28 d时取样检测;2~8 ℃保存0、3、6、9、12、18、24、36个月时取样检测。检测项目和检测方法如下。
1. 鉴别试验:取经卡介苗致敏的豚鼠4只,以轮圈法于每只豚鼠背部脊柱两侧皮内注射EC成品与50 IU/ml TB-PPD各0.2 ml,48 h后观察测量TB-PPD局部反应的硬结和EC成品局部反应的硬结或红晕的纵径和横径(以硬结或红晕大者为准),计算平均直径(纵径和横径测量值相加除以2)。
2. 效价检测:取4只经MTB活菌致敏的豚鼠,去毛后于背部脊柱两侧以轮圈法分别皮内注射EC成品及其参考品各0.2 ml,于注射后24、48 h分别测量局部反应硬结或红晕的纵径和横径(以硬结或红晕大者为准),求出硬结或红晕的平均直径(纵径与横径测量值相加除以2),计算EC成品与其参考品皮内注射后2次的硬结或红晕平均直径总和(4只豚鼠皮内注射后24 h和48 h测量局部反应的硬结或红晕平均直径总和),求出EC成品及其参考品皮内注射后2次测量局部反应的硬结或红晕平均直径总和的比值。
3. 理化检定项目:EC成品外观、装量、pH值、苯酚含量、无菌检查、异常毒性检查,均按照《中华人民共和国药典(2015年版 三部)》所述的方法进行。
(三)成品使用稳定性研究
将3批EC成品(批号:20171204、20171205、20171206)开启后分别放置温度为(25±2) ℃、湿度为(60±5) %和温度为(40±2) ℃、湿度为(75±5) %的条件下,分别于0、10、20、30、40、50 min取样进行检测。取样方法为打开铝塑盖后从胶塞针刺位置使用一次性注射器多次抽取样品进行检测。检测项目和检定方法同上述“成品储存稳定性”,其中苯酚含量和装量未检验,增加了按照《中华人民共和国药典(2015年版 三部)》进行的不溶性微粒和渗透压摩尔浓度检测。
结 果
一、EC原液储存稳定性研究
(一)致敏效应试验结果
检测结果表明,3批次EC原液按照建立的致敏效应方法进行检测,均表现为致敏后、攻击后动物无异常反应,与对照组动物的表现无差异,符合制定的质量标准。
(二)鉴别试验结果
检测结果表明,3批次EC原液对BCG致敏组豚鼠的皮肤试验均呈阴性,而TB-PPD对卡介苗致敏组豚鼠的皮肤试验均呈阳性,符合制定的质量标准。
(三)效价检测结果
检测结果表明,不同稀释度的3批次EC原液与相应稀释度的参考品在皮内注射后24、48 h 2次所测量的硬结或红晕平均直径总和的比值均为1.0±0.2,符合制定的质量标准(表1)。
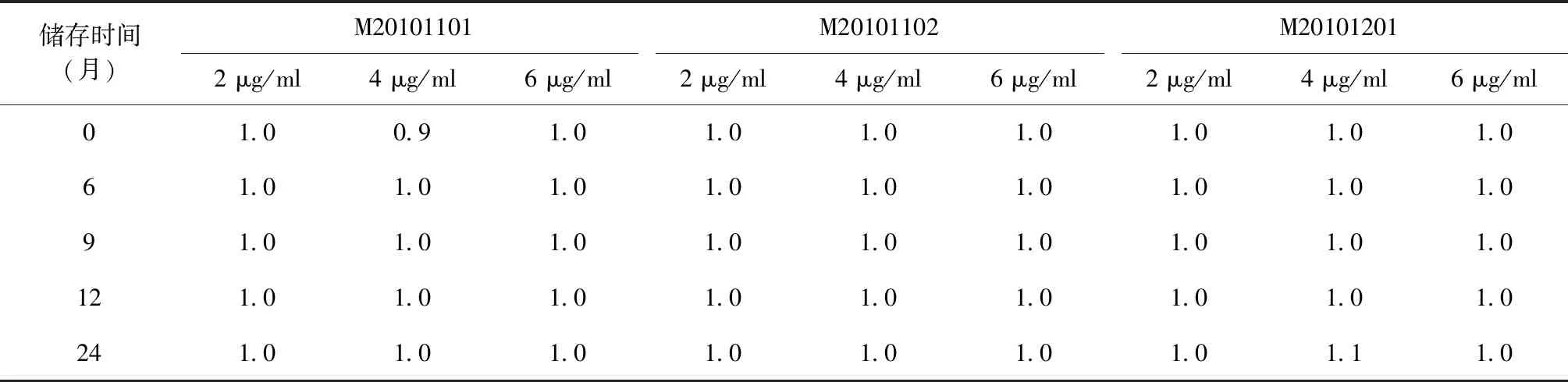
表1 不同储存时间3个批次EC原液按照不同稀释度皮内注射后的效价检测结果(-70 ℃)
(四)理化检测项目
检测结果表明,3批次EC原液外观、细菌内毒素检查、无菌检查、鉴别试验(免疫印迹法)、外源性DNA残留量、残余抗生素活性、宿主菌蛋白残留量、肽图、N-端氨基酸序列、等电点、紫外光谱扫描、分子量、蛋白质含量、纯度(电泳法)等指标,检测结果均符合EC质量标准的规定。其中等电点、分子量、蛋白质含量和纯度(电泳法)检测结果见表2。
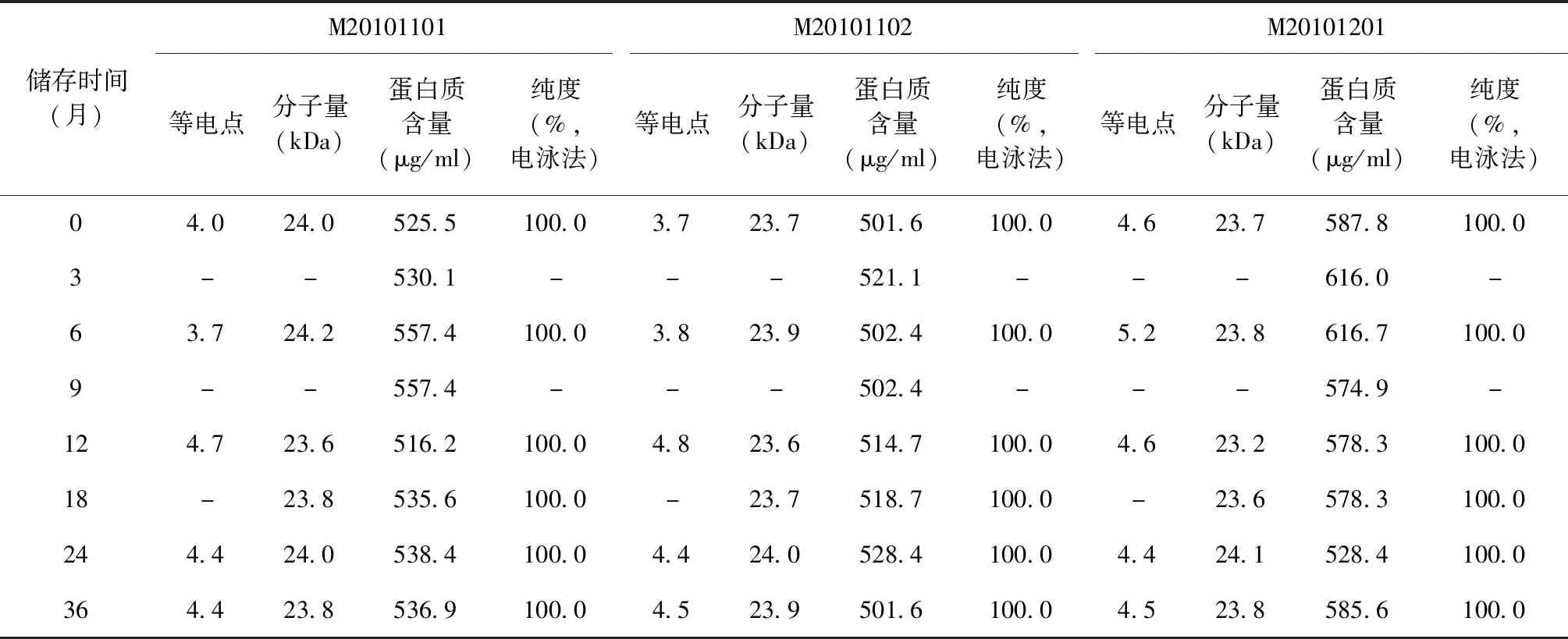
表2 不同储存时间3个批次EC原液的理化检测结果(-70 ℃)
二、EC成品储存稳定性研究
(一)鉴别试验结果
检测结果表明,3个批次EC成品对卡介苗致敏组豚鼠的皮肤试验均呈阴性,而TB-PPD对卡介苗致敏组豚鼠的皮肤试验呈阳性,符合制定的质量标准。
(二)效价检测结果
检测结果表明,3个批次EC成品与其参考品在皮内注射后24 h、48 h 2次所测量的硬结或红晕平均直径总和的比值均在1.0±0.2范围内,符合制定的质量标准(表3,4)。
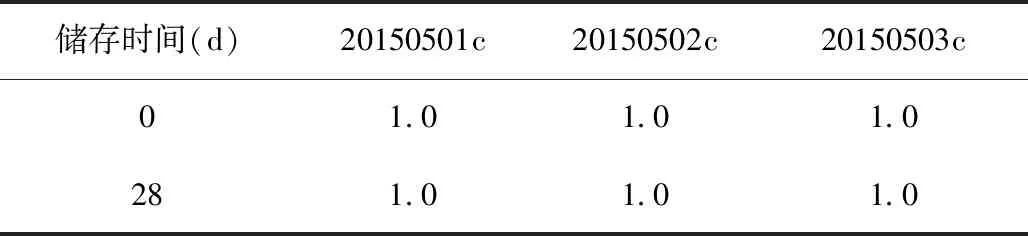
表3 不同储存时间3个批次EC成品的效价检测结果(37 ℃)

表4 不同储存时间3个批次EC成品的效价检测结果(2~8 ℃)
(三)理化检测项目
检测结果表明,3个批次EC成品外观、装量、无菌检查、异常毒性检查、pH值、苯酚等指标检测结果均符合EC质量标准的规定,其中pH值和苯酚检测结果见表5、6。
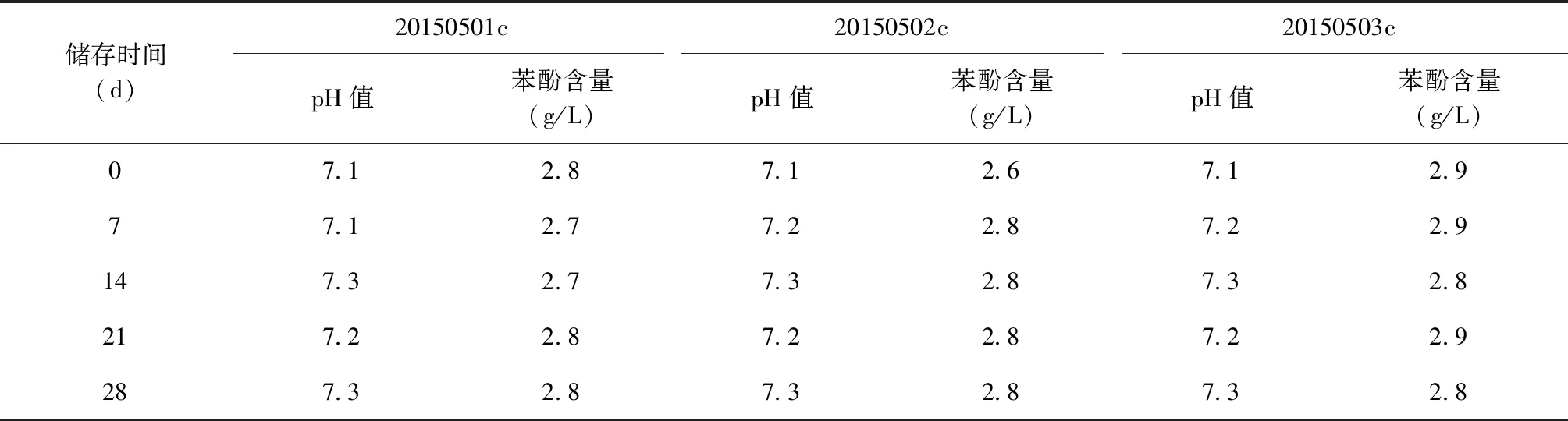
表5 不同储存时间3个批次EC成品的理化检测结果(37 ℃)
三、EC成品使用稳定性研究
(一)鉴别试验结果
检测结果表明,3个批次EC成品对卡介苗致敏组豚鼠的皮肤试验均呈阴性,而TB-PPD对卡介苗致敏组豚鼠的皮肤试验呈阳性,符合制定的质量标准。
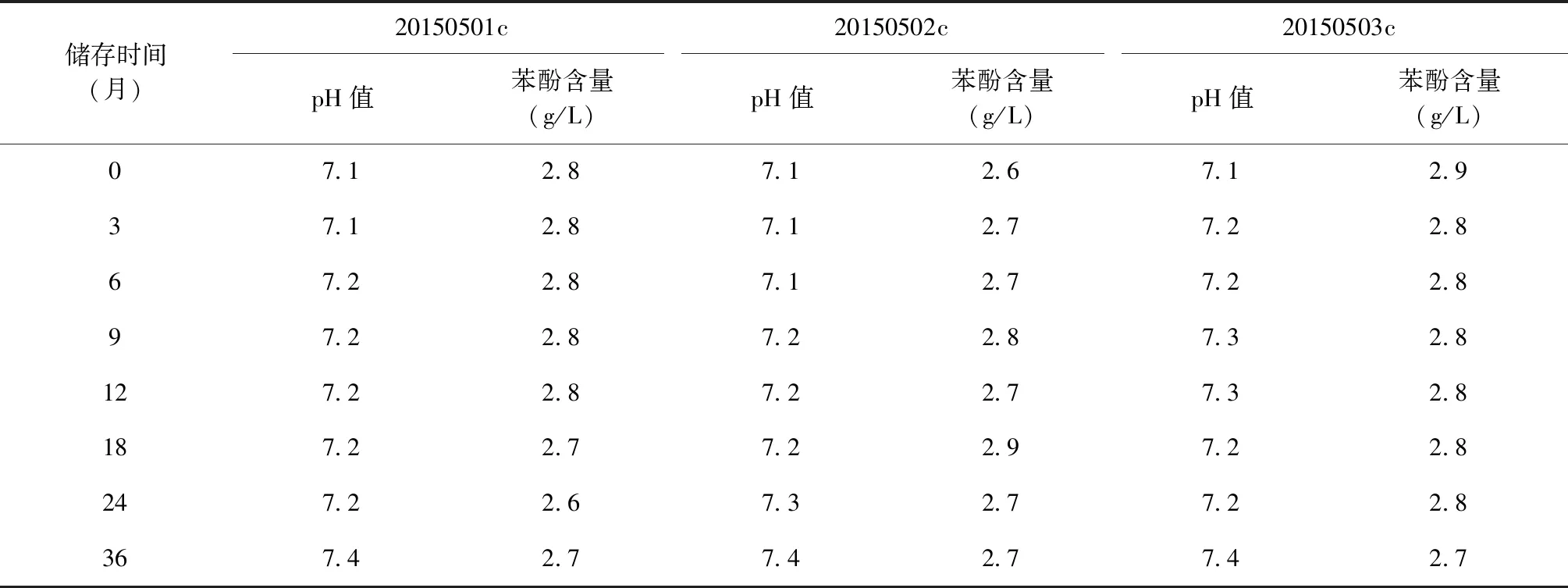
表6 不同储存时间3个批次EC成品的理化检测结果(2~8 ℃)
(二)效价检测结果
检测结果表明,3个批次EC成品与其参考品皮肤试验局部反应的硬结或红晕平均直径总和(4只豚鼠皮内注射后24 h和48 h测量局部反应的硬结或红晕平均直径总和)的比值均为1.0±0.2,符合制定的质量标准(表7,8)。

表7 不同放置时间3个批次EC成品的稳定性效价检测结果 [温度(25±2) ℃,湿度(60±5) %]

表8 不同放置时间3个批次EC成品的稳定性效价检测结果 [温度(40±2) ℃,湿度(75±5) %]
(三)理化检测项目
检测结果表明,3个批次EC成品外观、不溶性微粒、无菌检查、异常毒性检查、细菌内毒素检查、pH值、渗透压摩尔浓度等指标分别于温度(25±2) ℃、湿度(60±5) %和温度(40±2) ℃、湿度(75±5) %条件下放置0、10、20、30、40、50 min,检测结果均符合EC质量标准的规定,其中pH值和渗透压摩尔浓度检测结果见表9、10。

表9 不同放置时间3个批次EC成品的稳定性理化检测结果 [温度(25±2) ℃,湿度(60±5) %]
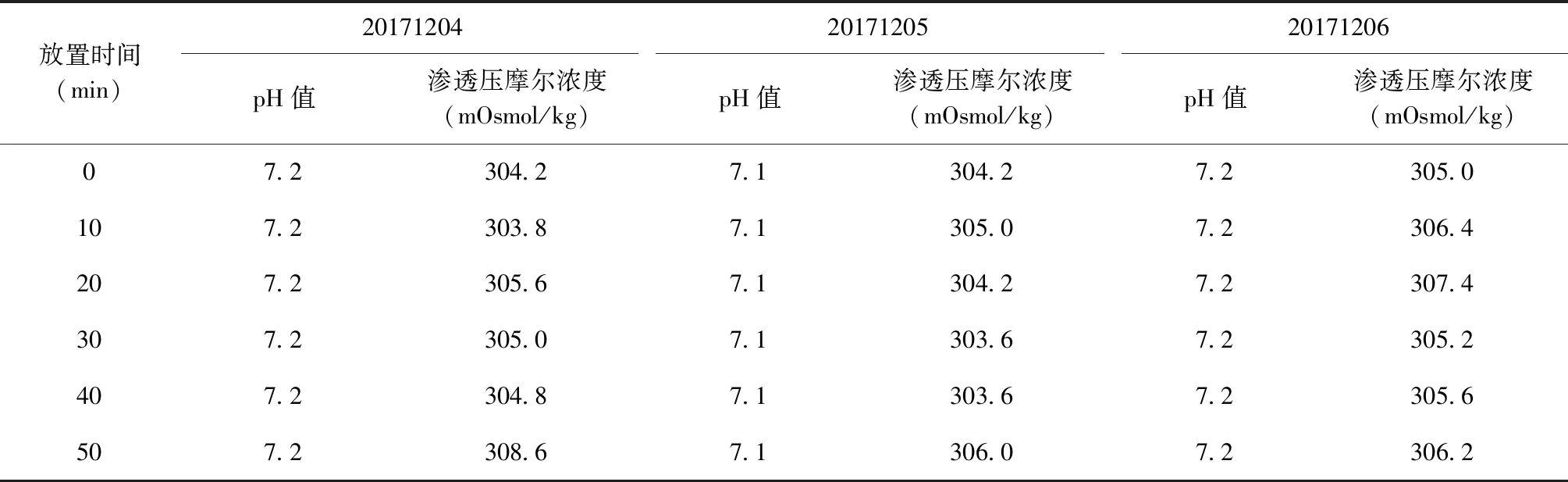
表10 不同放置时间3个批次EC成品的稳定性理化检测结果 [温度(40±2) ℃,湿度(75±5) %]
讨 论
稳定性研究是药品质量控制的重要内容,目的在于考察药品的质量稳定性,为药品制定效期和临床使用提供科学依据[8]。生物制品的活性成分一般为多肽或蛋白质,结构复杂,结构的改变可能会引起生物制品活性、效力或理化性质的改变。因此,基于生物制品的特性,在进行其稳定性研究中应需要综合考虑温度、湿度、使用条件等因素的影响。另外,生物制品质量控制中生物活性/效价常作为评价质量的核心指标,反映生物制品的有效性,应保证产品生物活性测定结果的稳定性及不同批次产品测定结果的一致性[9]。所以,本研究也重点考察了不同时间点本品的生物活性,如致敏效应试验、鉴别试验、效价检测等结果的变化,进一步评估本品在储存、使用过程中的稳定性。
EC是单一重组的相对分子质量为23 000的蛋白产品,属于1类治疗类生物制品,目前也无相关稳定性研究的报道。本研究结合EC特性及研究目的的不同,分别进行了原液储存稳定性研究、成品储存稳定性研究及成品使用稳定性研究。
EC原液的常规储存条件为-70 ℃。因此,笔者选取连续3批保存于-70 ℃的EC原液进行了本品储存稳定性研究,其中各检测时间点的选择参考了《生物制品稳定性研究技术指导原则》及本品的特性,选取0、3、6、9、12、18、24、36个月进行取样检测。研究的结果显示,3批次EC原液在不同储存时间点取样检测的结果均符合制定的质量标准,进而表明当EC原液在-70 ℃的条件下储存36个月,各项检测指标特别是生物活性检测结果均能保持稳定,这也为EC原液的储存效期提供了依据。
EC成品的常规储存条件为2~8 ℃,笔者分别进行了37 ℃储存条件下的加速稳定性研究和2~8 ℃ 条件下的长期稳定性研究。37 ℃储存条件下的加速稳定性研究的目的是通过加速药品的物理和化学变化,探讨药品的稳定性,在本品37 ℃储存条件下的加速稳定性研究中,笔者选取0、7、14、21、28 d 进行取样检测,研究结果表明3批次EC成品在不同储存时间点取样检测的结果均符合制定的质量标准;这也表明本品在37 ℃储存条件下的稳定性,为后期运输或使用过程中若本品储存温度出现短暂变化,提供了风险评估的依据。2~8 ℃储存条件下的长期稳定性研究结果表明,本品在2~8 ℃条件下储存36个月后,各项检测结果均符合制定的质量标准,为EC成品储存效期提供了依据。
EC成品有15 U/0.3 ml、25 U/0.5 ml及50 U/1.0 ml三种规格,每人使用剂量为0.1 ml。因此,本品在实际使用过程中会出现一瓶药品进行多人注射的情况,进而出现一次性注射器多次针刺抽取样品和样品长时间室温放置的情况。因此,笔者结合本品实际应用情况,分别进行了常规使用条件[温度为(25±2) ℃、湿度为(60±5) %)]和较为恶劣使用条件下[温度为(40±2) ℃、湿度为(75±5) %)]的使用稳定性研究。研究过程中检测项目的设置参考了本品的相关要求,但由于本品中苯酚为防腐剂,主要起到抑菌的作用,并不会对本品的效价起到作用,故使用稳定性研究中未设置对苯酚含量的检测;另外,进行使用稳定性研究过程中会出现多次针刺取样的操作,不同时间点的装量其本身就是一个变量,故使用稳定性研究中也未设置装量检测。由于在多次针刺取样过程中可能会导致硅胶塞上微粒的脱落至药品瓶中,故在使用稳定性研究中新增了不溶性微粒检测;同时,由于多次取样又可能出现取样不均一的现象,导致药品瓶中剩余药液渗透压的改变,进而危害到人身安全,故在使用稳定性研究中又新增了渗透压摩尔浓度的检测。两种使用条件下,不同取样点的检测结果均符合制定的质量标准,结果进一步证明了本品在常规使用条件下的稳定性和安全性。
综上,EC稳定性与有效性研究结果表明,EC理化性质、生物活性/效价稳定可控,符合《生物制品稳定性研究技术指导原则(试行)》[6]的要求,为该产品的上市生产和使用提供了实验室数据支撑。
