杞菊地黄丸联合美托洛尔光感受器细胞保护及视网膜重塑相关研究*
2020-08-07吴晗晗杜霄烨崔金刚
吴晗晗,徐 静,郭 红,杜霄烨,崔金刚,张 腾,陈 瑜
(上海中医药大学附属岳阳中西医结合医院,上海市中医药研究院中西医结合临床研究所 上海 200437)
正常视网膜由光感受器细胞将光信号转化为电信号,传递至视网膜二级神经元、三级神经元,进一步传递至脑,产生完整的视觉。以光感受器细胞退行性改变为核心病理表现的视网膜退行性病变是多种神经元和神经胶质细胞共同参与的复杂疾病,可见于视网膜色素变性(Retinitis pigmentosa,RP)、年龄相关性黄斑变性(age-related macular degeneration,AMD)和Stargardt 病(Stargardt disease,SD)等。RP 通常在于儿童和青年人中引起失明[1],AMD 主要发生于55 岁以上成年人,到2020年将影响全球1.96 亿人[2],而SD 则是常见的遗传性青少年黄斑变性[3]。这些疾病尽管有不同的病因和人口统计学特征,但都呈现出以光感受器细胞破坏、丢失为病理机制的视觉损害[4]。上述视网膜退行性疾病病理进程的不同阶段中,可累及光感受器细胞和视网膜色素上皮细胞,伴随着视网膜外层神经元的退行性改变,视网膜内层神经元逐渐解体,视网膜神经信号传导受损,导致病理性视网膜重塑的发生,最终形成进行性不可逆的视觉损害甚至失明[5]。
目前现代医学针对以光感受器细胞退行性改变为核心病理的相关视网膜退行性疾病的治疗尚无有效手段,新药的研发需要大量的时间和成本,而发掘现有已知药理概况药物的新应用可为视网膜退行性疾病提供新的治疗思路[6]。美托洛尔是选择性β1受体阻滞剂,在心血管疾病中应用广泛,课题组前期的研究提示在光损伤的小鼠模型中,美托洛尔腹腔给药具有一定的光感受器细胞保护效应[7]。此外,基于中医药的干预手段在视网膜退行性疾病的防治中具有一定的效应。经典明目方剂杞菊地黄丸临床应用于糖尿病视网膜病变[8]、中心浆液性脉络膜视网膜炎[9]、年龄相关性黄斑变性[10]等多种眼底疾病的治疗,但其明目效应的细胞靶点及机制尚缺乏系统的实验依据。本研究采用光损伤小鼠模型模拟光感受器细胞退行性改变,探讨杞菊地黄丸联合美托洛尔干预光感受器细胞退行性改变的可能的协同作用,杞菊地黄丸用量参考成人推荐范围,酒石酸美托洛尔则使用亚临床剂量(低于心血管疾病用药剂量),以期为相关视网膜退行性疾病的治疗提供部分临床前理论与实验参考。
1 实验材料与方法
1.1 实验动物
清洁级BALB/c 小鼠,4 周龄,雌性,购于上海斯莱克实验动物有限公司(合格证号为:SCXK(沪)2012-0002),饲养于动物实验中心。饲养室温度:22±4℃,相对湿度40~60%,光照周期(12 h 光照/12 h 黑暗),自由进食、饮水。
1.2 实验药物
杞菊地黄丸(北京同仁堂,浓缩丸),国药准字Z19993069,产品批号:17072513/17071644;酒石酸美托洛尔(阿斯利康制药有限公司,25 mg/片),国药准字H32025391,产品批号:1705128。
1.3 实验仪器
白色荧光灯(45w):Philips;FA1004B电子天平:上海精密科学仪器有限公司;光照度照度计,上海嘉定学联仪器厂;光学相干断层扫描(optical coherence tomography,OCT),视网膜电图(Electroretinogram,ERG),NSIGHT 软件,均来自美国Phoenix Research Labs;组织包埋机(EG1150C)、自动脱水机(TP1020)、石蜡切片机(RM2235)、冰冻切片机(CM30505)、荧光显微镜(DM6000B),均来自德国Leica公司。
1.4 实验方法
1.4.1 实验分组
经过两周适应性饲养,按照随机数字分组法将BALB/c 小鼠分为正常对照组(No bright light,No BL),光损伤模型组(Bright light vehicle,BL_Vehicle),美托洛尔治疗组(Bright light metoprolol,BL_MTP),杞菊地黄丸治疗组(Bright light QJD,BL_QJD)及杞菊地黄丸联合美托洛尔治疗组(Bright light_QJD+MTP,BL_QJD+MTP),每组各7只。
1.4.2 给药与造模
杞菊地黄丸及酒石酸美托洛尔磨粉过筛后,按给药量溶解,酒石酸美托洛尔3.2 mg·kg-1bw,杞菊地黄丸2.3g·kg-1bw 溶解,每只小鼠灌胃体积0.2 mL,溶剂为0.5%羧甲基纤维素钠(超纯水配置)。正常对照组和光损伤模型组以同体积0.5%羧甲基纤维素钠灌胃。
小鼠饲养至(20±1)g 随机分组进行灌胃,连续给药7 天后暗适应24 h,第8 d 给药后15 min 进行30 min光损伤造模,光照强度(10000±10)lux。光照结束后送回暗室,3 天后进行ERG 检测,7 天后进行OCT检测。
1.4.3 ERG检测
正常对照组、光损伤模型组、美托洛尔治疗组、杞菊地黄丸治疗组及杞菊地黄丸联合美托洛尔治疗组,按体重腹腔注射配制好混合麻醉溶液:甲苯噻嗪(8.25 mg·kg-1bw)和氯胺酮(82.5 mg·kg-1bw),扩瞳滴用0.5%托吡卡胺滴眼液,羟丙甲纤维素溶液保湿。两颊中央皮下插入红色电极,黑色接地电极插入小鼠尾部表皮下,电极线固定。弱红灯光下(5 lux)进行试验。记录条件:检测a 波、b 波的通频带为2-1000 Hz,用不同强度的光进行刺激,检测视功能[11]。
1.4.4 OCT检测
造模成功后7 天,小鼠腹腔注射戊巴比妥麻醉(200 mg·kg-1bw),双眼予5 g·L-1的托吡卡胺扩瞳3 min 后进行活体OCT 影像采集、分析。并采用INSIGHT 软件对OCT 成像图片进行外核层(outer nuclear layer,ONL)厚度的测量分析。
1.4.5 取材
OCT 检测后脱颈处死取眼球,4%多聚甲醛固定,石蜡包埋固定24 h、脱水、包埋,制作视网膜组织石蜡切片4 μm 备用;冰冻包埋则固定30 min 后从4%多聚甲醛中取出眼球,挑出晶状体,剩下完好的视杯结构。然后依次放入5%,10%,20%,40%的蔗糖溶液及40%蔗糖和O.C.T.(optimal cutting temperature,O.C.T.)冰冻包埋剂混合溶液中,4℃分别放置2 h 进行脱水。最后经O.C.T.冰冻包埋剂包埋冰冻,切片12 μm 存-20℃备用。
1.4.6 HE染色
取石蜡切片,二甲苯脱蜡后,按照无水乙醇、90%乙醇、80%乙醇每缸分别浸泡2 min,流水冲10 min,稍控水后,浸入苏木素溶液5 min,流水冲洗10 min,再经伊红染液2 min。拿起控液,入95%乙醇快速涮洗10次,经水乙醇浸泡4 min,再入二甲苯浸泡4 min即可以中性树胶封片。光学显微镜观察并采集照片。
1.4.7 免疫组织化学
视蛋白染色仍采用石蜡切片,经热修复后,封闭液封闭30 min,滴加鼠源视紫红质(rhodopsin,RHO)多克隆抗体(1:1000,novusbio),室温孵育1 h,PBS浸洗3次,滴加Cy3标记的羊抗鼠二抗(1:1000,Sigma),室温孵1 h,PBS 浸洗3 次,4′,6-二脒基-2-苯基吲(4′,6-diamidino-2-phenylindole,DAPI)溶液封片后在荧光显微镜20 倍下观察并拍照。中波敏感视蛋白(midwavelength sensitive cone opsin,M-opsin)步骤同上(一抗1:100,Millipore);其余免疫荧光染色采用冰冻切片,PBS 洗去O.C.T.包埋剂,直接进行封闭,后步骤同前,抗体浓度:蛋白激酶Cα(protein kinase Cα,PKCα)(1:5000,Sigma),钙结合蛋白D(Calbindin-D)(1:1000,Abcam),胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(1:500,DAKO)。兔源一抗则采用Cy3标记的羊抗兔的二抗(1:1000,Sigma)。
1.4.8 统计学分析
采用SPSS 20.0统计软件分析,检测数据正态性及方差齐性,采用方差分析统计结果,数据以均数± 标准误(Mean±S.E.M)表示,P<0.05 视为差异有统计学意义。
2 实验结果
2.1 杞菊地黄丸联合美托洛尔显著保护光感受器细胞结构
与正常对照组完好的视网膜形态及ONL 厚度相比较,光损伤模型组视网膜结构严重破坏,ONL 厚度显著变薄(P<0.05);与光损伤模型组相比较,美托洛尔及杞菊地黄丸治疗组均可见不同程度的视网膜ONL 结构破坏,其中美托洛尔给药组视网膜ONL 形态与光损伤模型组相似,杞菊地黄丸治疗组视网膜尚可见视网膜ONL 结构层次,ONL 厚度测量结果表明美托洛尔与杞菊地黄丸治疗组ONL 厚度较光损伤模型组增加(P<0.05);与光损伤模型组和美托洛尔治疗组及杞菊地黄丸治疗组相比较,杞菊地黄丸联合美托洛尔治疗组小鼠视网膜结构清晰,ONL 厚度显著增厚(P<0.05)。
HE 染色可见,正常对照组视网膜形态正常,光感受器细胞核排列整齐,内核层与外核层分界清晰,外核层细胞排列整齐;与正常对照组比较,光损伤模型组外核层变薄,细胞数目减少,细胞核排列紊乱,内、外核层界线模糊,光感受器细胞内、外节层结构破坏;与光损伤模型组相比较,美托洛尔治疗组视网膜结构无改善,杞菊地黄丸治疗组,可见视网膜内、外核层界限,形态优于模型组;与光损伤模型组和美托洛尔治疗组及杞菊地黄丸治疗组相比较,杞菊地黄丸联合美托洛尔治疗组视网膜基本形态相对完好,结构层次分明,光感受器细胞内、外节层结构清晰(见图1、2)。

图1 各组OCT检测及HE染色结果

图2 各组OCT检测后ONL厚度测量结果
2.2 杞菊地黄丸联合美托洛尔显著保护小鼠视功能
ERG 的a 波由光感受器细胞电位构成,代表光感受器细胞的电活动,因此a 波振幅减小代表光感受器细胞受抑制或损害,视觉细胞受到刺激兴奋后产生的电位是b 波,b 波可能起源于双极细胞,反应的是视网膜内核层细胞电位变化,若视网膜内信号传导的完整性受损则b 波下降。图3 分析结果提示,正常对照组的视网膜电图振幅随着光刺激增大而上升;与正常对照组相比较,光损伤模型组a/b 波振幅显著下降(P<0.05);与光损伤模型组相比较,美托洛尔治疗组小鼠视功能未见改善,杞菊地黄丸治疗组视网膜电图振幅增高(P<0.05);与光损伤模型组和美托洛尔治疗组及杞菊地黄丸治疗组相比较,杞菊地黄丸联合美托洛尔治疗组显著的提高了视网膜电图a/b 波的振幅(P<0.05)。因此杞菊地黄丸联合美托洛尔对视功能具有显著的保护作用,不仅体现在一级神经元功能的改善,对二级神经元及视觉信号传导完整性也具有积极的意义(见图3)。
2.3 杞菊地黄丸联合美托洛尔显著改善光损伤小鼠视网膜重构
2.3.1 杞菊地黄丸联合美托洛尔显著保护视网膜光感受器细胞结构和功能
视紫红质(Rhodopsin,RHO)特异性地表达于视杆细胞外节,中波视蛋白(mid-wavelength sensitive cone opsin,M-opsin)特异性地表达于视锥细胞外节。免疫组织化学分析结果表明,正常对照组光感受器细胞外节可见丰富分布的RHO 和M-opsin 的阳性染色;与正常对照组比较,光损伤模型组RHO 和M-opsin 光感受器细胞外节免疫阳性反应显著减弱;与光损伤模型组相比较,美托洛尔治疗组及杞菊地黄丸治疗组这两种蛋白免疫阳性染色并无改善;与光损伤模型组和美托洛尔治疗组及杞菊地黄丸治疗组相比较,杞菊地黄丸联合美托洛尔治疗组视网膜光感受器细胞外节RHO和M-opsin免疫阳性表达增强(见图4)。
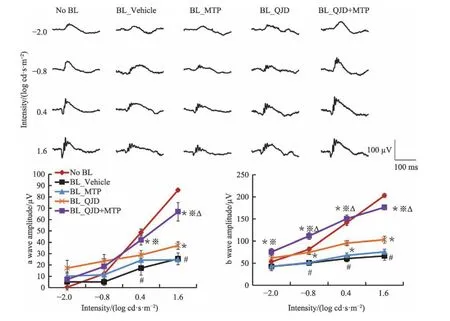
图3 杞菊地黄丸联合美托洛尔对视功能具有显著保护作用
2.3.2 杞菊地黄丸联合美托洛尔显著保护视网膜双极细胞结构
蛋白激酶Cα(protein kinase Cα,PKCα)是双极细胞的标记物,常用于观察光损伤小鼠视网膜双极细胞的变化[12]。该蛋白免疫组织化学分析表明,正常对照组外丛状层(outer plexiform layer,OPL)可见丰富分布的PKCα 阳性着染的双极细胞树突;与正常对照组比较,光损伤模型组视网膜外丛状层PKCα 免疫阳性反应显著减弱,双极细胞的树突和胞体都出现严重的缺失;与光损伤模型组相比较,美托洛尔治疗组PKCα免疫阳性染色未见改善,杞菊地黄丸治疗组视网膜PKCα 免疫阳性染色增强。与光损伤模型组和美托洛尔治疗组及杞菊地黄丸治疗组相比较,杞菊地黄丸联合美托洛尔治疗组视网膜PKCα 免疫阳性着染的双极细胞胞体和树突均增强(见图5)。
2.3.3 杞菊地黄丸联合美托洛尔显著保护视网膜水平细胞结构
钙结合蛋白D(Calbindin D)标记水平细胞及其突触[13],水平细胞与双极细胞一样,属于视网膜二级神经元。Calbindin D 免疫组织化学评估表明,正常对照组视网膜Calbindin D 标记的水平细胞树突及胞体均有丰富表达;与正常对照组相比较,光损伤模型组在OPL 中Calbindin D 免疫阳性染色显著减弱;与光损伤模型组相比较,美托洛尔治疗组视网膜Calbindin D 阳性染色无差异,杞菊地黄丸治疗组视网膜Calbindin D免疫阳性着染的水平细胞增强。与光损伤模型组和美托洛尔治疗组及杞菊地黄丸治疗组相比较,杞菊地黄丸联合美托洛尔治疗组视网膜外丛状层Calbindin D 免疫阳性染色标记的水平细胞及其树突均增强(见图6)。
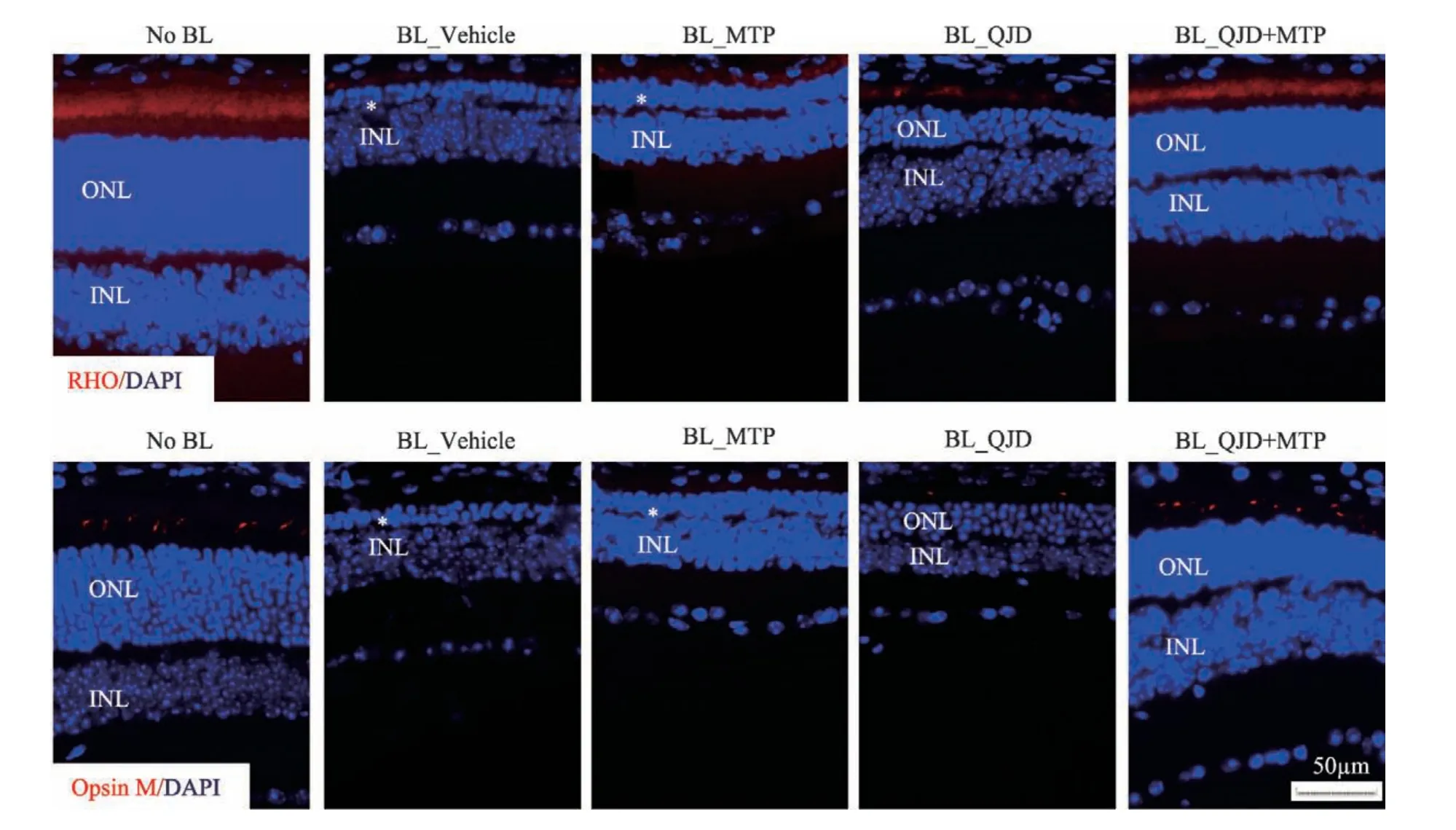
图4 杞菊地黄丸联合美托洛尔显著保护光损伤视网膜视锥和视杆细胞结构和功能
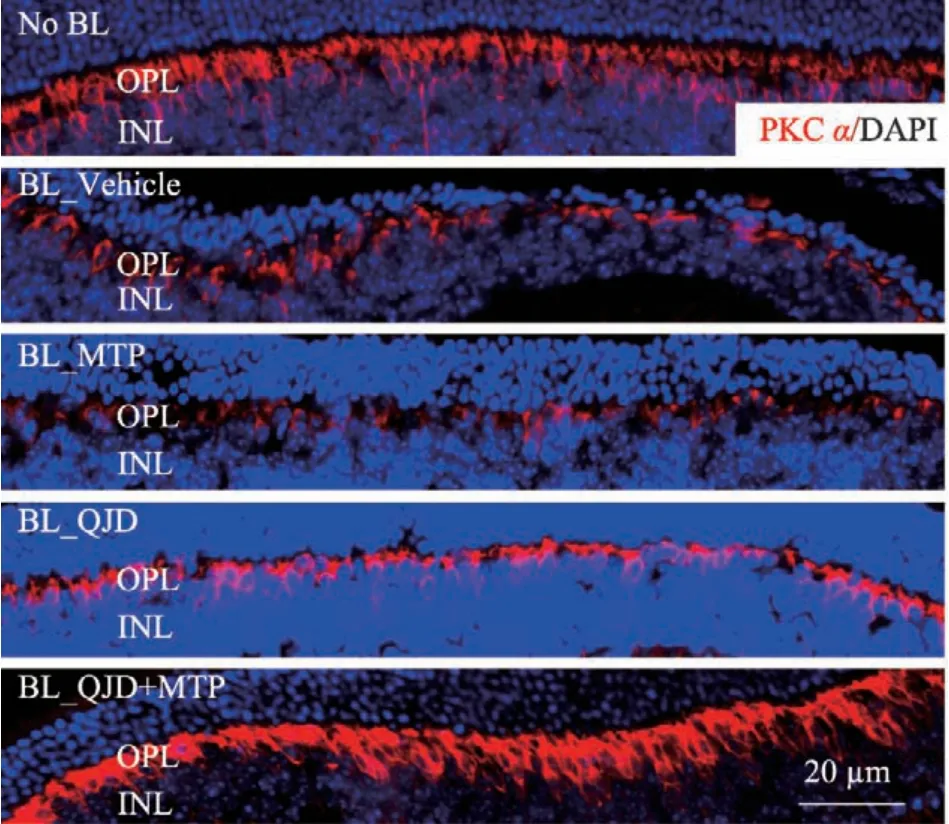
图5 杞菊地黄丸联合美托洛尔显著保护光损伤视网膜双极细胞结构

图6 杞菊地黄丸联合美托洛尔显著保护视网膜水平细胞结构
2.3.4 杞菊地黄丸联合美托洛尔显著抑制视网膜Müller细胞异常增生
胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是Müller 细胞标志物,Müller 细胞突起包饶着视网膜内的神经元细胞,维持视网膜的正常结构并起到营养视网膜等多种生理功能[14],而在光损伤退行性病变中Müller 细胞胶质异常增生、肥大并将视网膜分隔,阻碍视网膜损伤后结构和功能的良性重塑。GFAP 免疫组织化学分析表明,正常对照组的Müller细胞纤维束集中于视网膜神经节层,少量胞体存在于内核层;与正常对照组相比较,光损伤模型组Müller细胞大量增生肥大贯穿整个视网膜全层;与光损伤模型组相比较,美托洛尔治疗组、杞菊地黄丸治疗组视网膜Müller 细胞增生状况未见改善;与光损伤模型组和美托洛尔治疗组及杞菊地黄丸治疗组相比较,杞菊地黄丸联合美托洛尔治疗组Müller细胞胶质异常增生被抑制(见图7)。
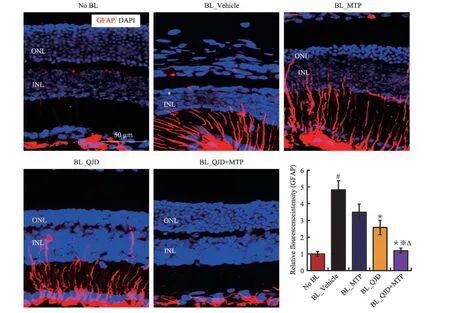
图7 杞菊地黄丸联合美托洛尔显著抑制视网膜Müller细胞异常增生
3 讨论
以光感受器细胞退行性改变为核心病理表型的视网膜退行性病变在中医学理论体系中被归入“内障眼病”,可见于“视瞻昏渺、高风雀目”[15]等症状相关的疾病过程中。《证治准绳》提出“视瞻昏渺及肝肾不足之病,由于阴虚血少,精液耗尽”,为从肝肾论治视网膜退行性病变提供了一定的理论依据。杞菊地黄丸出自清·董西园《医级宝鉴》,是经典的明目方剂。该方以熟地黄、枸杞子滋补肝肾精血,共为君药;山药补脾阴而固精,山茱萸养肝肾精血,共为臣药;茯苓平渗脾湿,牡丹皮清泄肝火,泽泻泄肾湿浊,菊花清肝明目,四药共为佐使。全方有滋补,有清泄,共奏滋肾养肝,清肝明目的功效[16]。视网膜退行性病变病因和发病机制十分复杂,研究表明氧化应激参与其病理过程[17]。现代药理研究表明,杞菊地黄丸内的中药含有如多糖,黄酮类化合物和三萜类化合物等多种抗氧化成分[18-19],抗氧化可能是其视网膜保护效应的机制之一,有待进一步探讨。
G 蛋 白 偶 联 受 体(g protein coupled receptors,GPCRs)介导的信号转导系统是哺乳动物细胞中最重要的信号传导机制之一,参与多种细胞生物学及病理生理学过程。本课题组前期研究结果提示GPCR 功能性改变是光感受器细胞退行性改变的上游机制之一[6]。此外,前期研究结果提示β1 肾上腺素能受体阻滞剂美托洛尔腹腔注射可显著抑制光感受器细胞退行性改变[7]。本研究采用临床常用的酒石酸美托洛尔进行口服干预,对其亚临床剂量的光感受器细胞保护效应进行进一步的研究(该剂量并未影响各组小鼠心率/血压,未附数据)。
本研究结果表明,杞菊地黄丸与美托洛尔联合给药视网膜保护效应显著优于杞菊地黄丸治疗组和美托洛尔治疗组。杞菊地黄丸与美托洛尔联合给药可显著拮抗光损伤引起的光感受器细胞结构和功能的退行性改变,其视网膜功能的保护效应可能与其保护光感受器细胞及视网膜二级神经元(双极细胞、水平细胞)结构,抑制Müller细胞介导的反应性胶质增生效应相关。此外,值得注意的是,OCT 影像学分析虽然提示亚临床用量口服美托洛尔治疗具有部分光感受器细胞结构保护效应,但进一步的功能和免疫组织化学分析结果表明残存的光感受器细胞并不具备正常的生物学功能,提示非治疗量的美托洛尔灌胃并不能发挥显著的光感受器细胞保护的效应;杞菊地黄丸具有一定的拮抗光损伤诱导光感受器细胞结构及视网膜功能退行性改变的效应,对视网膜双极细胞和水平细胞体现出一定的保护效应,但对于光感受器细胞RHO 及M-Opsin 等功能蛋白的表达以及Müller 细胞反应性胶质增生等病理过程未体现出显著的干预效应,提示杞菊地黄丸单独灌胃治疗也不能实现促进视网膜良性重塑的作用。而杞菊地黄丸与美托洛尔联用在起到显著的光感受器细胞及视网膜二级神经元保护效应的同时,显著抑制反应性胶质增生,促进视网膜良性重塑,提示杞菊地黄丸与美托洛尔两药联用视网膜保护效应显著优于两药单独使用,具有显著的协同效应。
多种机制参与视网膜退行性病变的发生发展,多途径多靶点的治疗有助于复杂病理过程的有效干预[20]。光感受器细胞保护对于延缓相关视网膜退行性疾病进程具有直接的意义,而促进视网膜修复性重塑对视网膜退行性疾病的转归和预后具有积极的意义。本研究揭示了杞菊地黄丸与美托洛尔联合给药对视网膜光感受器细胞的保护效应及视网膜重塑相关机制,提示了其在相关视网膜退行性疾病中可能的多途径多环节多靶点的治疗优势,为相关视网膜退行性疾病的治疗提供了新的理论思路和部分实验依据。
