外周伤害性刺激对大鼠脑和脊髓星形胶质细胞胶质纤维酸性蛋白表达的影响
2020-08-06李震郭灵
李 震 郭 灵
(1 广西卫生职业技术学院人体形态学教研室,南宁市 530021,电子邮箱:421980848@qq,com;2 广西医科大学人体解剖教研室,南宁市 530021)
星形胶质细胞参与许多疾病的病理过程。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞的骨架蛋白之一,其表达情况在星形胶质细胞受到刺激时发生相应的变化,是反映星形胶质细胞被激活的标志物之一[1-3]。中枢神经系统(central nervous system,CNS)损伤时,星形胶质细胞由常态转变为反应性星形胶质细胞[4-5],后者在CNS对损伤的反应中起着重要作用,包括形成瘢痕和清除变性的突触末梢,此时GFAP含量也明显增加。星形胶质细胞在神经元受损时反应性上调GFAP水平,因此,GFAP可作为研究CNS损伤后胶质细胞反应的一个客观指标[6-7]。但是目前有关外周伤害性疼痛刺激是否对星形胶质细胞产生影响,国内外的研究报道仍较少。故本研究分析外周伤害性刺激对大鼠脑和脊髓星形胶质细胞GFAP表达的影响,现报告如下。
1 材料和方法
1.1 实验动物 选取30只Wistar 纯系雄性大鼠,56日龄,体重180~290 g,由广西医科大学医学实验动物中心提供[合格证号:桂检字(2003)第0005号],饲养环境温度控制在25℃~28℃,通风、自然采光。
1.2 主要试剂和仪器 主要试剂:小鼠抗大鼠GFAP单克隆抗体(批号:20170318)以及亲和素-生物素复合物(avidin-biotin complex,ABC)试剂盒(批号:20170419)、粉末型二氨基联苯胺(diaminobenzidine,DAB)(批号:20170312)均购自北京中杉金桥生物技术有限公司;水合氯醛(分析纯,批号:20130513)购自四川成都市科龙化工试剂厂;多聚甲醛(分析纯,批号:20120409)购自上海溶剂厂;30%过氧化氢(分析纯,批号:20130611)购自重庆川江化学试剂厂;无水乙醇(分析纯,批号:20110509)购自上海振兴化工厂;二甲苯(分析纯,批号:20110315)购自广州化学试剂厂;柠檬酸(分析纯,批号:20110318)购自天津市化学试剂一厂;柠檬酸钠(分析纯,批号:20120513)购自广州化学试剂厂。实验仪器:江湾Ⅰ型C大鼠立体定位仪(上海川沙花木农机厂);Leica RM 2253轮转式石蜡切片机(德国Leica公司);ZHPY型恒温式附贴切片展片仪(河北医学院);202-1型电热干燥箱(上海县第二五金厂);CHS型光学显微镜(日本Olympus光学有限公司);AE-240型电子分析天平(Mettler-Toledo仪器有限公司);BCD-108CT型低温冰箱(河南新飞电器有限公司);DG-401型电热恒温孵育箱(天津市实验仪器厂);0.25 mm×25 mm无菌针灸针(北京汉医医疗器械中心)。
1.3 动物分组及干预方法 按随机数字表将30只大鼠分为实验组(n=18)、假手术组(n=6)、正常对照组(n=6),其中实验组又分1 h组(n=6)、3 h组(n=6)及6 h组(n=6)。实验组大鼠在清醒状态下,用组织钳迅速打断大鼠左侧前肢的尺骨、桡骨及右侧后肢的胫、腓骨中段,造成多发性、闭合性骨折;假手术组大鼠在清醒状态下,用组织钳轻轻夹取大鼠左侧前肢的尺骨、桡骨及右侧后肢的胫、腓骨中段;正常对照组大鼠则不予任何刺激处理。
1.4 标本获取 分别在刺激后1 h、3 h、6 h获取实验组大鼠的脑和脊髓标本。给予3.5%水合氯醛(1.2 mL/100 g体重)腹腔注射进行麻醉,快速开胸,经左心室插管至升主动脉,剪开右心耳,快速灌注pH 7.4的生理盐水100~200 mL,然后按先快后慢次序灌注4%多聚甲醛500 mL(0.1 mol/L 磷酸缓冲液配制,pH 7.4),于30~40 min完成灌注。灌注完毕后,首先去除大鼠颅盖骨,将大鼠头部准确地安置在大鼠脑立体定位仪上,参照大鼠脑立体定位图谱[8],切取出脑组织(前囟前1.70 mm至前囟后0.92 mm、前囟后0.92 mm至前囟后3.80 mm)各两块,此范围的脑组织包括全部扣带回皮质(cg1)、第一躯体感觉区、斜角带以及部分背侧海马,每块大小约为3 mm×1.5 cm×1 cm;然后去除大鼠脊柱暴露脊髓,切取脊髓颈膨大(大小为1.5 mm×5 mm×1 mm)和腰骶膨大(2 mm×5 mm×1 mm)。将脑与脊髓组织块放置于4%多聚甲醛固定液后固定3 h(4℃)后,用自来水冲洗脑组织2~3次,再将所有脑与脊髓组织放于盛有蒸馏水的烧杯中漂洗(30 min/次,6次);脱水透明:70%乙醇(4 h)→80%乙醇(4 h)→90%乙醇(2 h)→95%乙醇(2 h)→100%Ⅰ乙醇(1.5 h)→100%Ⅱ乙醇(1 h)→100%乙醇与二甲苯1 ∶1溶液(0.5 h)→二甲苯Ⅰ(0.5 h)→二甲苯Ⅱ(0.5 h),此时组织块已完全脱水与透明;浸蜡:石蜡Ⅰ(58℃,1 h)、石蜡Ⅱ(58℃,1 h)、石蜡Ⅲ(54℃,过夜);包埋:铁板架包埋,蜡块大小约为2 cm×1 cm×1.5 cm,要求快速冷却。假手术组、正常对照组均与实验1 h组同时用相同的方法取材。
1.5 染色方法 在正式进行免疫组织化学反应前均需将石蜡组织切片常规脱蜡至水:二甲苯Ⅰ→二甲苯Ⅱ→二甲苯Ⅲ,每步骤各10 min。脱去切片中的石蜡;下行梯度乙醇入水:100%乙醇Ⅱ→100%乙醇Ⅰ→95%乙醇→85%乙醇→70%乙醇→60%乙醇→50%乙醇,每级乙醇脱水5 min以去除二甲苯;双蒸馏水漂洗10 min(次),2次,以去除乙醇;磷酸缓冲盐溶液漂洗5 min(次),2次,待进行相关的免疫反应。
取常规脑冠状冰冻切片及脊髓水平冰冻切片,片厚40 μm,将0.1 mol/L柠檬酸盐缓冲液(pH 6.0)放入微波盒中,用微波炉煮沸后插入已脱蜡至水的组织片进行抗原微波修复,将温度控制在95℃~98℃,修复1.5 min,自然冷却至室温。用0.01 mol/L 磷酸缓冲盐溶液(pH 7.4)漂洗2次,5 min/次。室温下用3%过氧化氢(双蒸水配制)消除切片内源性过氧化物酶催化活性15 min,再用0.01 mol/L磷酸缓冲盐溶液漂洗3次,5 min/次。用正常山羊血清工作液封闭组织中的抗原10 min(37℃),倾去工作酶,勿洗,并保持组织湿润。加入小鼠抗大鼠GFAP单克隆抗体(1 ∶1 000)4℃过夜;然后用0.01 mol/L 磷酸缓冲盐溶液冲洗3次,5 min/次。加生物素兔抗鼠IgG(北京中杉金桥生物技术有限公司,批号:20170415)(1 ∶200)室温孵育2 h。0.01 mol/L 磷酸缓冲盐溶液冲洗3次,5 min/次。加标记的卵白素(ABC复合物)室温孵育2 h。0.01 mol/L磷酸缓冲盐溶液冲洗3次,5 min/次。DAB试剂盒显色,37℃显色约2 min,自来水充分冲洗终止显色反应。脱水透明:70%乙醇(4 h)→80%乙醇(4 h)→90%乙醇(2 h)→95%乙醇(2 h)→100%Ⅰ乙醇(1.5 h)→100%Ⅱ乙醇(1 h)→100%乙醇与二甲苯1 ∶1溶液(0.5 h)→二甲苯Ⅰ(0.5 h)→二甲苯Ⅱ(0.5 h)、中性树胶封片。
选取每只大鼠脑组织前囟前1.2 mm的切片和前囟后3.14 mm的切片,在40倍物镜×10倍目镜的光学显微镜下分别观察和计数每张切片的扣带回皮质(cg1)、第一躯体感觉区、斜角带和海马各亚区CA1、CA2、CA3及齿状回双侧视野内的阳性细胞数(单位:个/视野),然后取双侧视野的平均数作为该脑区的阳性细胞计数的原始数据。取脊髓的颈膨大和腰骶膨大水平切片,在10倍物镜×10倍目镜定位脊髓后角,在40倍物镜×10倍目镜的光学显微镜下分别观察和计数每张切片的左右侧灰质后角的阳性细胞数(单位:个/视野)。阳性细胞为深棕褐色。
1.6 统计学分析 采用SPSS 10.0软件进行统计学分析。计量资料用(x±s)表示,多组间比较采用方差分析,两两比较用LSD-t法检验,组内比较采用配对t检验。P<0.05表示差异统计学有意义。
2 结 果
2.1 各组大鼠各相关脑区GFAP阳性细胞数量 1 h组大鼠端脑3个区域(扣带回皮质、第一躯体感觉区、斜角带)、海马各亚区(CA1、CA2、CA3)及齿状回的GFAP阳性细胞数量均高于其余各组(均P<0.05),3 h组端脑3个区域、海马各亚区及齿状回的GFAP阳性细胞数量均高于6 h组、假手术组及正常对照组(均P<0.05),而6 h组、假手术组及正常对照组的各相关脑区GFAP阳性细胞数量差异均无统计学意义(均P>0.05)。见表1、表2。
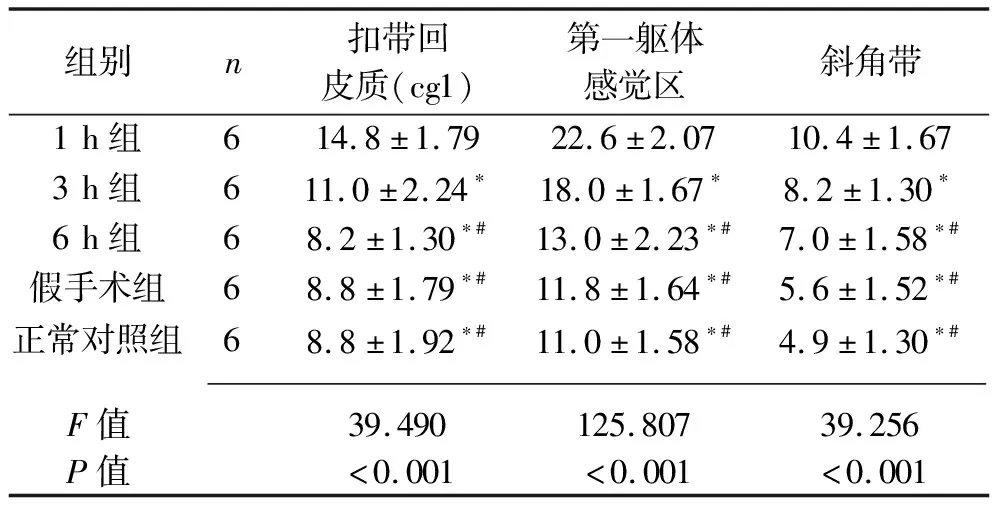
表1 5组大鼠端脑3个区域GFAP阳性细胞数比较(x±s,个/视野)

表2 5组大鼠海马各亚区及齿状回GFAP阳性细胞数比较(x±s,个/视野)
2.2 各组大鼠脊髓颈膨大后角GFAP阳性细胞 除正常对照组外,其余各组大鼠脊髓颈膨大后角伤侧GFAP阳性细胞数量均高于健侧(均P<0.05)。1 h组大鼠大鼠脊髓颈膨大后角伤侧GFAP阳性细胞数量均高于3 h组、6 h组、假手术组及正常对照组(均P<0.05),3 h组大鼠脊髓颈膨大后角伤侧GFAP阳性细胞数量均高于6 h组、假手术组及正常对照组(均P<0.05),而6 h组、假手术组及正常对照组大鼠脊髓颈膨大后角伤侧GFAP阳性细胞数量差异均无统计学意义(均P>0.05)。各实验组、假手术组及正常对照组组大鼠脊髓颈膨大后角健侧GFAP阳性细胞数量差异均无统计学意义(均P>0.05)。见表3。
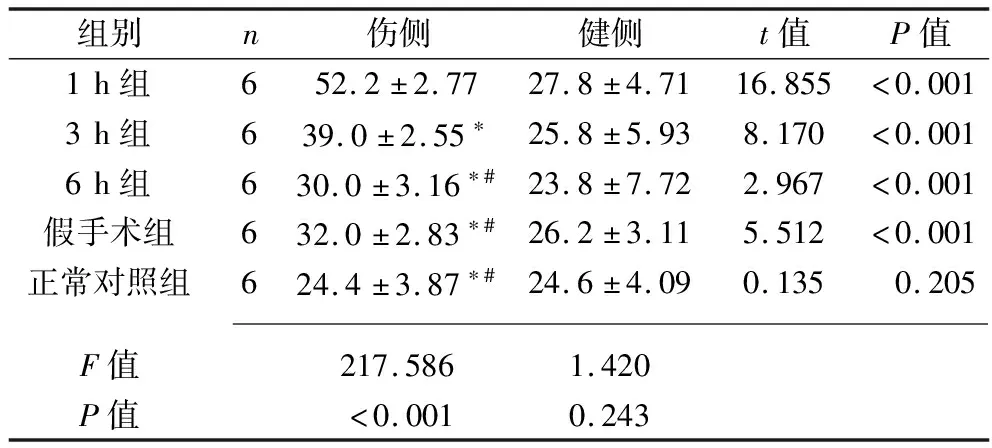
表3 5组大鼠颈膨大后角双侧GFAP阳性细胞数比较(x±s,个/视野)
2.3 各组大鼠脊髓腰骶膨大后角GFAP阳性细胞的变化 除正常对照组外,其余各组大鼠腰骶膨大后角伤侧GFAP阳性细胞数量均高于健侧(均P<0.05)。1 h组大鼠大鼠腰骶膨大后角伤侧GFAP阳性细胞数量均高于3 h组、6 h组、假手术组及正常对照组(均P<0.05),3 h组大鼠腰骶膨大后角伤侧GFAP阳性细胞数量均高于6 h组、假手术组及正常对照组(均P<0.05),而6 h组、假手术组及正常对照组大鼠腰骶膨大后角伤侧GFAP阳性细胞数量差异均无统计学意义(均P>0.05);各实验组、假手术组及正常对照组组大鼠腰骶膨大后角健侧GFAP阳性细胞数量差异均无统计学意义(均P>0.05)。见表4。
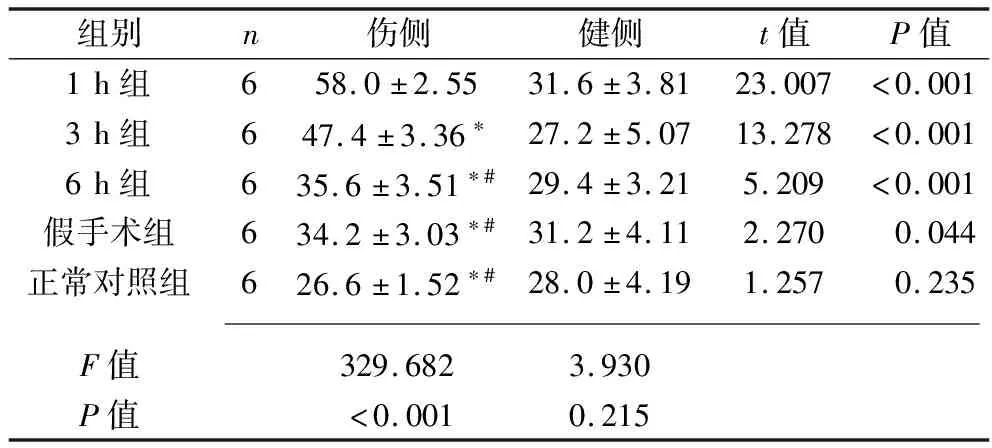
表4 5组大鼠脊髓腰骶膨大后角双侧GFAP阳性细胞数变化(x±s,个/视野)
3 讨 论
疼痛在脊髓水平的调节和整合一直被认为只与脊髓神经元及其递质有关,而神经胶质细胞被认为仅对神经元起着支持和营养作用,不具有细胞之间的信号传递功能。然而,用完全由神经元参与的模型却无法解释一些疼痛现象,如获得性免疫缺陷综合征、区域外疼痛、镜像痛等[9]。有研究表明,神经胶质细胞参与急性疼痛的发生和维持,激活后参与许多重要的生理功能,如释放促炎性因子、神经营养因子、信号转导等,在急性疼痛的调节过程中发挥重要作用[10-11]。此外,孙涛等[11]还发现脊髓灰质后角星形胶质细胞的增殖活化参与了慢性疼痛的发生与维持。脊髓灰质I和Ⅱ层是脊髓中神经结构和化学成分最复杂的区域,是伤害性信息出入的第一站,主要接受高阈值伤害性感受器的初级感觉传入,其中含有大量的突触球结构,相互构成各种类型的突触,在伤害性信息调节中起重要作用[13-14]。而脊髓灰质第Ⅲ、Ⅳ层相当于激素背角固有核所在部位,有很多背角大细胞,在疼痛感知中起关键作用,被称为T细胞(Tract Cell),其接受从背根传来的外周伤害性刺激,将信息传递到脑组织;四肢的神经纤维传入脊髓背角后,终止于背角神经元及星形胶质细胞,而四肢伤害性刺激后的痛觉超敏症状与此类纤维及脊髓背角上行投射纤维密切相关[15]。本研究结果显示,大鼠脊髓灰质后角中实验组大鼠脊髓伤侧的GFAP阳性细胞数均比健侧的显著增多(P<0.05),且胞浆着色明显,细胞较肥大,这些变化可能是星形胶质细胞被激活后,其标志物GFAP的表达也显著升高的结果。这提示星形胶质细胞有可能与神经元共同参与形成回路网络连接,对疼痛进行负性调节。此外,在本研究中,大鼠伤侧脊髓后角的GFAP阳性细胞数在不同时间段的表达存在着差异,具体表现为1 h组>3 h组>6 h组(均P>0.05),说明多发性闭合性伤害性刺激后1 h,大鼠的星形胶质细胞增殖且功能活跃,而3 h后开始降低,其数量在6 h后降至更低。
大脑皮层作为感觉整合的最高级中枢,接受各种感觉传入信息,并进行加工,最终上升到认知阶段。研究表明,急性疼痛可激活对侧的脑区,包括大脑躯体感觉区、前扣区、前额皮层,提示这些脑区参与急性疼痛的中枢信息加工[16]。研究证实,神经元可塑性变化和中枢敏感化在疼痛的产生和维持中具有关键作用[17-18],但星形胶质细胞的作用却少见报道。因此,本研究对大鼠相关脑区的星形胶质细胞进行了定量观察,结果显示,1 h及3 h组大鼠的大脑皮质、海马、齿状回、扣带回皮质的GFAP阳性细胞数量较假手术组与正常对照组增多(均P<0.05),这些变化可能是由于脊髓后角的神经元及星形胶质细胞被激活后,神经冲动通过神经纤维上行传导到以上相应的脑区,并激活其中的神经元及星形胶质细胞引起的。本研究中,实验组大鼠的大脑第一躯体感觉区、海马区、齿状回、扣带回皮质的GFAP阳性细胞数量随刺激时间的变化趋势与伤侧的脊髓灰质后角几乎相同,即为1 h组>3 h组>6 h组(均P<0.05),这提示脑内各区感觉神经元和星形胶质细胞与脊髓的相互协作,导致中枢过敏化,从而参与痛觉的发生、维持、调节的过程,故在伤害性信息传递模式中,脊髓与相关脑区关系可能发生相互作用。此外,在信息传递中未必只有激活神经元兴奋后才激活胶质细胞的模式,还可能存在着神经元与胶质细胞同时兴奋或者胶质细胞兴奋后激活神经元的模式,而后两种模式很有可能是由于伤害性刺激造成星形胶质细胞膜电位的改变,从而通过不同的细胞连接来影响神经元的兴奋性实现的[17]。故神经元与胶质细胞的相互作用,可能在CNS的痛觉信息处理中起着重要作用。
综上所述,外周伤害性刺激可同时激活大鼠脊髓灰质后角和脑相关各区的星形胶质细胞,脑和脊髓相关区域GFAP阳性细胞数增加。在伤害性信息传递模式中,脊髓与相关脑区可能相互作用,星形胶质细胞可能与神经元一起共同参与形成回路网络连接,对疼痛进行负性调节。
