基于过氧化物模拟酶的电化学传感器的制备及其在食品检测中的应用
2020-08-06徐生盼戴子捷张芝琳
徐生盼,戴子捷,张芝琳,江 凌,黄 和
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.淮阴师范学院 化学化工学院,江苏 淮安 223300;3.南京工业大学 食品与轻工学院,江苏 南京 211800;4.南京工业大学 药学院,江苏 南京 211800)
过氧化氢(H2O2)是一种强氧化剂,在食品加工过程中广泛被用作漂白剂和杀菌防腐剂。在此过程中产生大量含有H2O2的废水,严重危害环境和人类健康。此外,一些食品加工行业在加工过程中可能会违规使用H2O2作漂白防腐剂,导致食品中的H2O2残留超标[1]。过量的H2O2进入人体,会造成皮肤黏膜和细胞的大范围损伤,并在代谢过程中产生大量的羟自由基,从而引起细胞凋亡与癌变,加快人体衰老甚至诱发心血管疾病[2-3]。随着人们对食品安全问题的重视,实现对H2O2的快速稳定、高灵敏检测具有重要的实际意义。
酶基生物传感器由于结合了酶的高特异性和灵敏性,常被用来检测H2O2,然而由于天然酶固有的局限性,比如储存条件苛刻、容易变性失活、提取及使用成本高等缺点,促进了科研工作者对“人工酶”的研究热潮,合成了各种各样可以模仿天然酶功能的纳米材料[4-5]。在2013年Wei等[6]关于纳米酶的全面综述中,纳米酶被定义为“具有类酶特性的纳米材料”。至今为止,已有模拟氧化酶、过氧化物酶和超氧化物歧化酶(SOD)、水解酶以及多功能的纳米酶的研究出现[6],其中具有过氧化物酶活性的纳米颗粒由于诸多优异性能而受到广泛关注和开发[7-8]。含有金属离子的过氧化物模拟酶是最早发展起来的纳米材料,迄今为止,科研工作者已发现诸如Fe3O4@ZnO纳米颗粒[9]、Au/Co3O4-CeOx纳米颗粒[10]、金属硫化物[11-13],金属有机框架材料[14-17]等材料具有过氧化物模拟酶的催化活性。
水热合成法是在一定温度和压力条件下,在水溶液中进行化学反应的一种合成方法。采用该方法制备的纳米材料具有操作简单、产物纯度高、分散性好、粒度易控制等优点,因而已被广泛应用于纳米材料的制备[18-19]。本文中,笔者利用水热合成法合成3种不同的过氧化物酶,比较3种酶的催化活性,将活性最好的FeCo纳米复合材料修饰于金电极表面,制得用于检测H2O2的电化学生物传感器。与传统的滴定法(GB 5009.226—2016)与比色法相比,该方法具有预处理简单、检测快速、灵敏度高等优点[20],在食品检测中展现了良好的应用前景。
1 材料与方法
1.1 仪器与试剂
FeCl3(六水)、乙酸钴(四水)、乙酸镍(四水)、NaOH、H2O2、3,3′,5,5′-四甲基联苯胺(TMB)、冰醋酸、醋酸钠、NaH2PO4、Na2HPO4等化学试剂均为分析纯,国药集团化学试剂有限公司。实验用水为超纯水(18 MΩ·cm)。
SEM S-4800型扫描电子显微镜,日本Hitachi公司;XRD-6000型X线衍射仪,日本SHIMADZU公司;UV1902PC型紫外可见分光光度计,上海凤凰科学仪器厂;CHI760D型电化学工作站,上海辰华仪器有限公司(电化学测量采用三电极测量体系,工作电极为修饰过氧化物模拟酶的金电极,直径2 mm,对电极为铂丝电极,参比电极为饱和甘汞电极)。
1.2 铁钴镍纳米复合材料的制备的制备
金属硫化物具有较好的过氧化物模拟活性,但所用的硫源通常是对环境不友好的H2S、Na2S或者硫脲等等。受Cova等[11]的启发,笔者从常见的生活废料中寻找硫源。鸡毛中富含角质蛋白,含硫丰富,用鸡毛作为硫源引入纳米复合材料。
Fe纳米复合物的制备如下:首先称取0.4 g剪成2 mm左右的鸡毛,加入50 mL NaOH溶液(0.1 mol/L),超声溶解得棕色的羽毛水解液。然后在水解液中加入1.08 g FeCl3,超声10 min后,倒入聚乙烯内衬的水热反应釜150 ℃反应10 h,自然冷却后,得到的沉淀分别用乙醇和水清洗2次,60 ℃真空干燥过夜,得Fe纳米复合物。FeCo纳米复合物以及FeCoNi纳米复合物的制备过程类似,不同之处在于:将上述制备过程中的1.08 g FeCl3换为0.54 g FeCl3和0.498 g乙酸钴制得FeCo纳米复合材料;同理,将上述制备过程中的1.08 g FeCl3置换为0.54 g FeCl3、0.249 g乙酸钴和0.249 g乙酸镍,制得FeCoNi纳米复合物。
1.3 3种材料的过氧化物模拟酶活性研究
3种材料的过氧化物模拟酶活性采用传统的双底物显色反应,即所制得的样品材料催化H2O2与TMB的反应,TMB从无色被氧化为蓝色氧化态的TMBox,然后测量吸光度。具体过程如下:取4个1.5 mL的离心管(a、b、c、d),a作为空白对照组,其中混合液组成为含有0.5 mmol/L H2O2和0.5 mmol/L TMB的0.1 mol/L、pH 4.0 的醋酸缓冲液;b中混合液组成为含有0.5 mmol/L H2O2、0.5 mmol/L TMB以及0.1 mg/mL Fe纳米复合物的0.1 mol/L、pH 4.0的醋酸缓冲液;c中混合液组成为含有0.5 mmol/L H2O2、0.5 mmol/L TMB以及0.1 mg/mL FeCo纳米复合物的0.1 mol/L、pH 4.0的醋酸缓冲液;d中混合液组成为含有0.5 mmol/L H2O2、0.5 mmol/L TMB以及0.1 mg/mL FeCoNi纳米复合物的0.1 mol/L、pH 4.0的醋酸缓冲液。反应30 min后拍照,各稀释10倍后测吸光度。
1.4 3种材料的过氧化物模拟酶的米氏常数的测定
米氏常数是通过分析含有催化样品的反应体系在652 nm处的吸光度动力学曲线,根据Lineweaver-Burk 双倒数公式:
(1)
式中:v表示最初反应速率,min-1;vmax表示最大反应速率,min-1;[S]表示底物的浓度,mmol/L;Km表示米氏常数[21-22],mmol/L。
因该系统中有2个底物,使得其中一个底物的浓度过量,改变另外一个底物的浓度,可以考察另外一个底物的活性。为了考察过氧化物模拟酶对H2O2的亲和力,固定TMB的终浓度为2 mmol/L,样品终质量浓度为0.1 mg/mL,改变H2O2终浓度为0.1、0.15、0.20、0.25、0.3、0.4、0.8以及1 mmol/L,在0.1 mol/L、pH 4.0的醋酸缓冲液中于652 nm处测量吸光度,8 min内终止,测量动力学曲线。
1.5 过氧化物模拟酶修饰电极的制备
电极预处理。金电极使用水虎鱼溶液(98%H2SO4和30%H2O2,体积比为7∶ 3)浸泡30 min以除去电极表面的杂质,超纯水冲洗干净后,分别用0.3和0.05 μm的Al2O3粉末抛光,然后在无水乙醇和超纯水中超声清洗各5 min,接着在0.5 mol/L的H2SO4溶液中进行循环伏安活化(1.6~-0.2 V)至获得稳定的扫描曲线,最后超纯水洗净,氮气干燥待用。
纳米复合物修饰电极的制备。取3 μL含有3 mg/mL过氧化物模拟酶的质量分数0.5%的Nafion溶液滴加到电极上,自然晾干待用。
1.6 实验方法
采用三电极体系,以金电极或过氧化物模拟酶修饰电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为对电极。在含有5 mmol/L Fe(CN)63-/4-的 0.1 mol/L KCl溶液中进行循环伏安扫描(0.6~-0.2 V,扫描速率0.1 V/s)和交流阻抗谱扫描以获得电极修饰的表征数据;在含或不含H2O2的0.2 mol/L PB缓冲液(pH=6.0)中进行循环伏安扫描(0~-0.8 V,扫描速率0.1 V/s)获得修饰电极的可行性数据;在-0.6 V电位下,向搅拌的0.2 mol/L PB缓冲液(pH=6.0)中连续滴加H2O2储备液(100 mmol/L),得到电流(i)-时间(t)曲线,以获得H2O2检测的标准曲线。
2 结果与讨论
2.1 3种材料结构表征
首先对制备的材料进行扫描电子显微镜(SEM)的表征,以确定材料的形貌,结果如图1所示。从图1中可看出,制备的3种材料的形貌都不均一,Fe纳米复合材料(图1(a))主要由纳米棒与无定型的纳米颗粒组成;FeCo纳米复合材料主要由纳米棒和纳米片堆叠而成(图1(b));FeCoNi纳米复合材料由无定形颗粒与纳米棒组成(图1(c))。同时对材料做X线衍射分析(XRD)(图2),通过与PDF卡片进行比对,Fe纳米复合物中的主要成分为α-Fe2O3(PDF 85-0987);FeCo复合物中的主要成分为(CoFe2)O4(PDF 79-1744);FeCoNi纳米复合物结构上与FeCo复合物相似,但是无定形的颗粒更多一些。

图2 3种复合材料的XRD分析

图1 复合材料的扫描电镜图
为了考察复合物中所含有的元素,笔者对FeCo纳米复合物做了元素的X线能谱分析(EDS),结果如图3所示。从图3中可看出,Fe、Co的原子百分含量分别为8.7%和4.6%,基本上符合(CoFe2)O4中的元素原子比值。因为材料制备时FeCo元素比是按1∶ 1添加的,这说明有一部分的Co没有参与反应而被冲洗掉了。材料中的S元素的原子含量大约为0.06%,说明通过该方法的确掺杂了部分S元素。
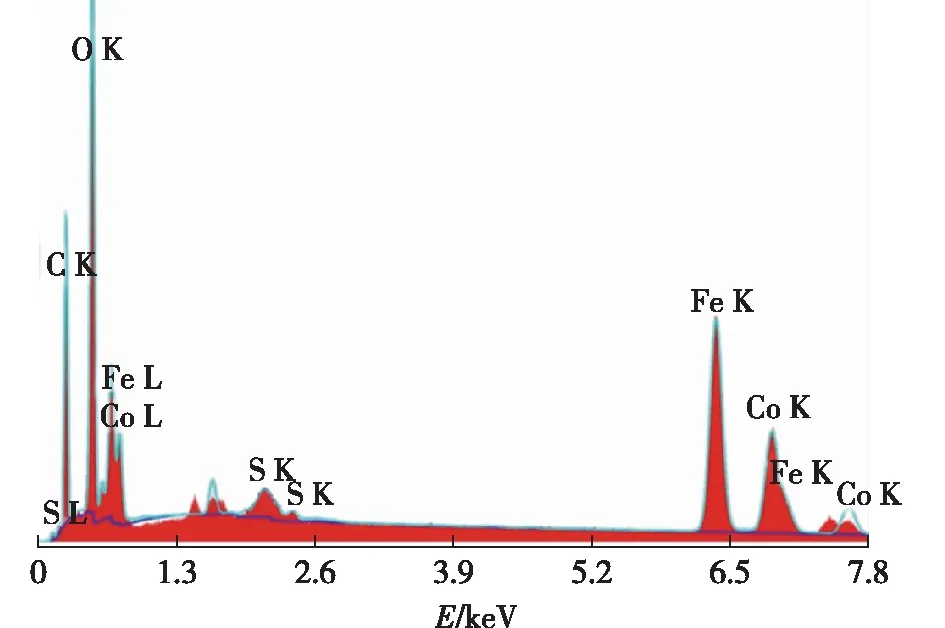
图3 FeCo纳米复合材料EDS能谱分析
2.2 过氧化物模拟酶活性探讨及米氏常数的确定
笔者对3种材料的过氧化物模拟酶活性作了初步探讨,结果如图4所示。从图4中内插的照片可看出,反应系统中含有制备的材料时,反应30 min后都呈现明亮的蓝色,而空白对照反应体系无色,这说明3种材料都具有过氧化物模拟酶的活性,但是c管的颜色最深,这说明FeCo纳米复合材料的催化活性最好。从紫外可见吸收光谱图也可看出,3种材料在652 nm处都出现了氧化态TMBox的特征吸收峰,吸收峰的强弱来看,FeCo纳米复合物的催化活性最好,FeCoNi和Fe纳米复合材料的催化活性都要弱一些。
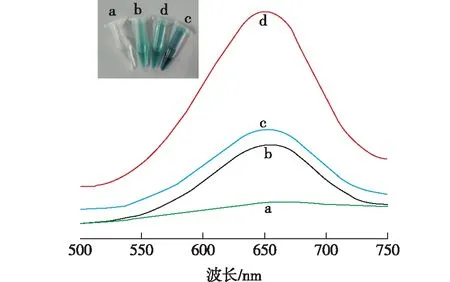
(a)0.5 mmol/L H2O2+0.5 mmol/L TMB;(b)0.5 mmol/L H2O2+0.5 mmol/L TMB+0.1 mg/mL Fe纳米复合材料;(c)0.5 mmol/L H2O2+0.5 mmol/L TMB+0.1 mg/mL FeCo纳米复合材料;(d)0.5 mmol/L H2O2+0.5 mmol/L TMB+0.1 mg/mL FeCoNi纳米复合材料


图5 3种材料的双倒数曲线
2.3 电极修饰表征
通过以上分析可知,FeCo纳米复合材料的过氧化物模拟酶活性最好。因此笔者将FeCo纳米复合材料修饰到金电极上(FeCo/Au电极),用于H2O2的测量,并对组装过程的可行性进行了验证,结果如图6所示。从图6(a)可看出,裸金电极的循环伏安曲线(CV)峰电流为32 μA,FeCo/Au 电极的CV峰电流为5.8 μA,这说明FeCo纳米复合材料减小了电子传递速率,并成功修饰到了电极表面。图6(b)是2种裸电极与修饰电极的交流阻抗谱(EIS),图中插图为交流阻抗等效电路,其中Rs为溶液电阻,Rct为电子传递电阻,Zw为扩散电阻,Cdl为双电层电容,图6中半圆直径代表了Rct的大小。从图6可看出,裸电极的Rct为1 985 Ω,随着电极表面FeCo材料的修饰,电子转移速率降低,Rct增加到3 889 Ω。这进一步说明可以通过质量分数0.5% Nafion溶液将材料固定到电极表面。

图6 裸电极和FeCo纳米复合物修饰电极在含有5 mmol/L Fe(CN)63-/4-的0.1 mol/L KCl中的循环伏安曲线(0.1 V/s)(a);交流阻抗谱(b)
2.4 FeCo纳米材料修饰电极对H2O2检测的可行性分析
在0.2 mol/L PB 缓冲液(pH=6.0)中,笔者对电极做了电化学CV表征,结果如图7所示。从图7(a)中可看出,裸电极(a,b)在不含H2O2以及2.0 mmol/L H2O2的缓冲液中,都没有氧化还原峰,说明裸电极不能催化H2O2的还原。当电极表面修饰上FeCo纳米复合材料后,在含有2 mmol/L H2O2的缓冲液中,-0.6 V处出现了明显的还原峰,这说明FeCo纳米复合材料具有良好的电催化性能。从图7(b)中可看出,随着H2O2浓度的增加(1.0、2.0、2.5以及3.0 mmol/L),FeCo/Au 电极在溶液中的还原电流随之增加,说明该材料可以制备H2O2传感器。

图7 电极在0.2 mol/L、pH 6.0 PB缓冲液中的循环伏安曲线(0.1 V/s)
通过改变CV的扫描速率来研究该H2O2传感器的H2O2催化反应的控制步骤(图8)。从图8(a)看出,随着扫描速率从10增加到200 mV/s,H2O2还原电流逐渐增加。将-0.6 V处的还原电流与扫速的平方根作图(图8(b)),得到良好的线性关系,这说明在电极表面的催化反应速率很快,反应过程可能是扩散控制的,为了降低传质过程对反应的影响,可增强对流传质过程(如搅拌)。

图8 修饰电极在不同扫速下的循环伏安曲线(2.0 mmol/L H2O2)(a)及还原电流与扫速平方根之间的线性关系(b)
2.5 计时电流法检测H2O2的浓度
在-0.6 V电位下,向搅拌的0.2 mol/L PB缓冲液(pH=6.0)中连续滴加H2O2储备液(100 mmol/L),得到电流i-时间t曲线,结果如图9所示。从图9(a)看出,FeCo/Au电化学传感器对H2O2的还原响应在3 s内达到稳态电流。图9(b)是浓度-电流标准曲线。在1 000 μmol/L浓度以下,拟合的标准曲线为i=0.014 1c+8.042(R2=0.998);在大于1 000 μmol/L浓度时,拟合的标准曲线为i=0.007 4c+13.618(R2=0.997),检测限(3σ/s)为4.94 μmol/L。
表1为该电化学传感器与其他H2O2传感器的性能比较。从表1可看出,该传感器的检测限(LOD)与已有的一些H2O2传感器是可比的,检测范围也更宽一些,同时检测限低于食品安全国家标准(GB 5009.226—2016)中的定量限3 mg/kg,即88.2 μmol/L,这说明该传感器具有一定的应用潜力。

表1 该电化学传感器与其他过氧化氢传感器的性能比较
2.6 传感器的抗干扰性能、重现性和稳定性
在测试过程的最后(图9(a)),滴加了终浓度为10 mmol/L抗坏血酸(a)和10 mmol/L小牛血清蛋白(b),结果并没有产生电流响应,表明该传感器具有良好的抗干扰性能。

图9 FeCo修饰电极对不同浓度H2O2的i—t响应曲线(-0.6 V,0.2 mol/L,PB缓冲液)(a);标准曲线(b)
用该传感器平行测定400 μmol/L的H2O25次,相对标准偏差为3.2%,说明该传感器的重现性是可接受的。将制备好的传感器置于4 ℃冰箱保存,每周测量一次(400 μmol/L),4周后响应电流仍能保持在90%,说明该传感器的稳定性比较好。
2.7 食品样品中H2O2的检测
为了验证该检测方法的可靠性,笔者对牛奶、腐竹(干)和水发牛百叶进行了检测,结果如表2所示。某国产婴儿奶粉用温水冲调至0.1 g/mL,PB缓冲液调至pH 6.0,冷却至室温进行电化学检测;将沥干水分后的牛百叶和腐竹样品分别粉碎均匀,准确称取10 g,适量水溶解,PB缓冲液调至pH 6.0,然后定容至100 mL,摇匀并浸泡30 min,过滤后滤液直接进行电化学测量。

表2 食品样品中H2O2的检测
从表2可看出,该婴儿奶粉中没有检测出H2O2,添加标样后,回收率在97.0%~100.5%,对于色泽白亮好看的腐竹和牛百叶样品,检测出了H2O2残留。对于所有的食品样品,该传感器的RSD不大于4.2 %,在可接受的范围之内,说明该传感器具有实际应用于食品检测的潜力。
3 结论
采用水热合成法制备了3种具有过氧化物模拟酶活性的纳米复合材料,将其中催化活性最好的FeCo纳米复合材料修饰于金电极表面,制备了用于检测过氧化氢的电化学传感器。结果表明该传感器具有快速及稳定的电化学响应、较宽的线性范围(80~5 640 μmol/L)和较低检测限(4.94 μmol/L),检测限低于食品安全国家标准中(GB 5009.226—2016)的定量限3 mg/kg,即88.2 μmol/L,在实际的食品样品检测中也展现了良好的效果,说明该传感器在食品监测领域具有一定的应用潜力。
