不同品种猪PBD-119基因的克隆与差异表达研究
2020-08-06刘艳光张珈溯罗新惠柳检强金海国夏广军张立春
刘艳光, 张珈溯, 罗新惠, 柳检强,金海国, 夏广军, 曹 阳, 张立春,*
(1.延边大学农学院,吉林 延吉 133002;2.吉林省农业科学院畜牧分院,吉林 公主岭 136100)
防御素是由机体分泌的具有强烈抗菌作用和抵抗外援微生物入侵的多肽,是机体免疫作用的重要屏障之一[1-3]。哺乳动物的防御素根据二硫键所在位置的不同分为α防御素、β防御素和θ防御素[4-5],β-防御素(β-defensin)具有6个半胱氨酸残基形成β-防御素基序,这也是β-防御素的主要特征[6]。研究表明,β-防御素主要存在于牛、绵羊、猪和人类[7],对包括革兰氏阳性、革兰氏阴性细菌、真菌和酵母菌在内的多种微生物普遍具有抑制活性[8-9]。猪β-防御素(PBD)是猪自身分泌的一种能够杀菌、调节免疫功能的小分子抗菌肽,是猪生长繁殖不可缺少的蛋白质[10],有望成为饲料抗生素添加剂的理想替代品[11-12]。目前猪β-防御素功能研究报道较多,但对不同猪种抗病能力表型性状构成中的作用鲜有报道。该实验室前期对长白与野猪杂交猪,民猪及大白猪群体免疫相关指标比较分析中证实,野杂猪与民猪具有更高的抗病能力[13-14],并进一步证实天然免疫相关基因具有更加丰富的基因遗传多样性[15-16]。鉴于β-防御素在天然免疫系统的重要作用以及不同遗传背景猪中分泌量的差异还很少有人报道。该试验以野杂猪、民猪和大白猪为研究对象,利用RT-PCR技术和分子克隆技术获得PBD-119基因的CDS区;利用qRT-PCR检测该基因在不同品种猪相同组织中的表达量,为进一步阐明PBD-119基因结构和生物学功能奠定基础;为后续研究该基因在不同品种猪体内的免疫调节作用提供参考依据。
1 材料与方法
1.1 试验动物及样品采集
野猪与当地民猪的杂交猪(含75%长白山野猪血统,简称野杂猪)30头,民猪25头,纯种大白猪健康后备母猪29头,分别来自吉林省白山市隆兴牧业有限公司兴隆猪场、吉林省农业科学院畜牧分院民猪保种场和四平红嘴集团梨树种猪场,均为5~6月龄。屠宰后取肝脏和脾脏,用灭菌剪刀剪成小块,放入冻存管并做好标记,于液氮保存;血液用抗凝血管收集,试剂盒提取DNA,于冰箱-20 ℃储存备用。
1.2 主要仪器与试剂
Trizol(Invitrogen公司);cDNA合成试剂盒、感受态DH5α大肠杆菌(TaKaRa公司);梯度PCR仪(北京博辉生物科技有限公司);2×ES Taq Master Mix(北京康为世纪生物科技有限公司);凝胶回收试剂盒(Omega公司);Light Cycler 480 SYBR Green I Master和实时荧光定量PCR仪(罗氏公司)。
1.3 引物设计与合成
目前GenBank中仅公布有PBD-119基因mRNA预测序列信息(XM_005654239.3),为获取该基因真实mRNA序列,该试验以预测序列信息为模板,利用Primer Premier 5.0软件设计克隆引物,序列测定完成后,重新设计定量PCR引物,以猪HPRT1基因[17]为内参基因,引物信息见表1,引物由苏州金唯智生物科技有限公司合成。
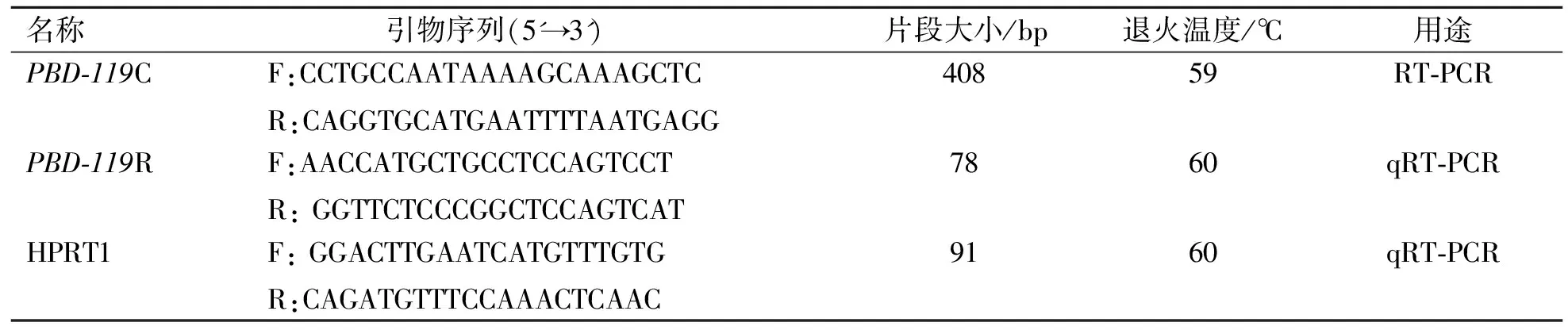
表1 引物序列
1.4 总RNA提取及cDNA合成
按照说明书利用Trizol法提取民猪、大白猪和野杂猪肝脏、脾脏总RNA后,采用Quawell-Q5000超微量分光光度计检测其纯度及浓度,参照Roche Transcriptor First Stand cDNA Synthesis Kit使用说明进行cDNA合成,合成后-20 ℃保存备用。
1.5 PCR扩增及测序分析
以3个品种猪的肝脏、脾脏及血液cDNA为模板,扩增PBD-119基因CDS区。PCR反应体系为50 μL:2×ES Taq Master Mix 25 μL,上、下游引物各1.5 μL,cDNA 2 μL,ddH2O补足体系。PCR反应程序为:95 ℃预变性5 min,95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,从第2部开始共34个循环;72 ℃延伸8 min;4 ℃保存。PCR产物经1%琼脂糖凝胶电泳检测后,利用凝胶回收试剂盒对目的条带进行切胶回收,目的基因进行连接转化,并将阳性克隆菌液送金唯智生物科技有限公司测序。
1.6 生物信息学分析
利用Seqman软件对测序结果进行分析;同时应用Expasy在线软件对PBD-119基因蛋白的理化性质、结构、磷酸化、信号肽以及跨膜结构进行分析,并对其二级、三级结构进行预测;运用MEGA7.0将克隆序列与其他10个物种的PBD-119基因的核苷酸序列构建系统发育进化树。
1.7 差异表达与统计分析
采用qRT-PCR检测PBD-119基因在大白猪、民猪和野杂猪的肝脏、脾脏和血液中的表达情况并分别以组织和品种为对象,比较相同组织不同品种和相同品种不同组织间的差异表达。实时荧光定量PCR反应体系(20 μL)中,cDNA 1.0 μL,上、下游引物各1.0 μL,2×SYBR Premix DimerEraser 10 μL,ddH2O补足体系。扩增程序:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火15 s,72 ℃延伸35 s,从第2步开始共45个循环;95 ℃ 5 s,60 ℃ 1 min,温度以5 ℃/s 的速率从60 ℃递增到97 ℃,最后降到40 ℃保存。每个品种检验3个隔离,每个样品重复3次,采用2-△△Ct方法对数据进行分析,并采用Graph Pad 6.0 Software进行统计绘图。
2 结果与分析
2.1 PBD-119基因CDS区扩增克隆及SNP筛选结果
以野杂猪、民猪和大白猪肝脏、脾脏及血液的cDNA为模板,RT-PCR反应成功扩增出特异性条带(图1)。
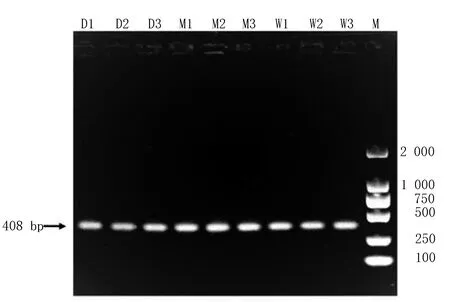
图1 不同群体猪PBD-119基因 RT-PCR 扩增电泳图
由图1可知,琼脂糖凝胶电泳检测发现片段小于500 bp,与预期结果大小一致。进一步通过胶回收、连接、转化及菌落PCR鉴定及阳性菌落测序。测序发现该目的条带全长408 bp,Blast N比对发现,该片段与猪PBD-119基因预测mRNA序列完全一致(XM_005654239.3),其中,包含完整CDS序列252 bp,共编码83个氨基酸(图2),Cys残基组成3个分子内二硫键,其连接方式为 Cys1-Cys5,Cys2-Cys4和Cys3-Cys6,表明该基因高度保守;同时通过PBD-119基因测序结果比对分析得出在第263位碱基上存在多肽位点的改变(C266T),并在第53位氨基酸上引起氨基酸的改变,由脯氨酸变为丝氨酸(P-S),但其并不影响二硫键结构。
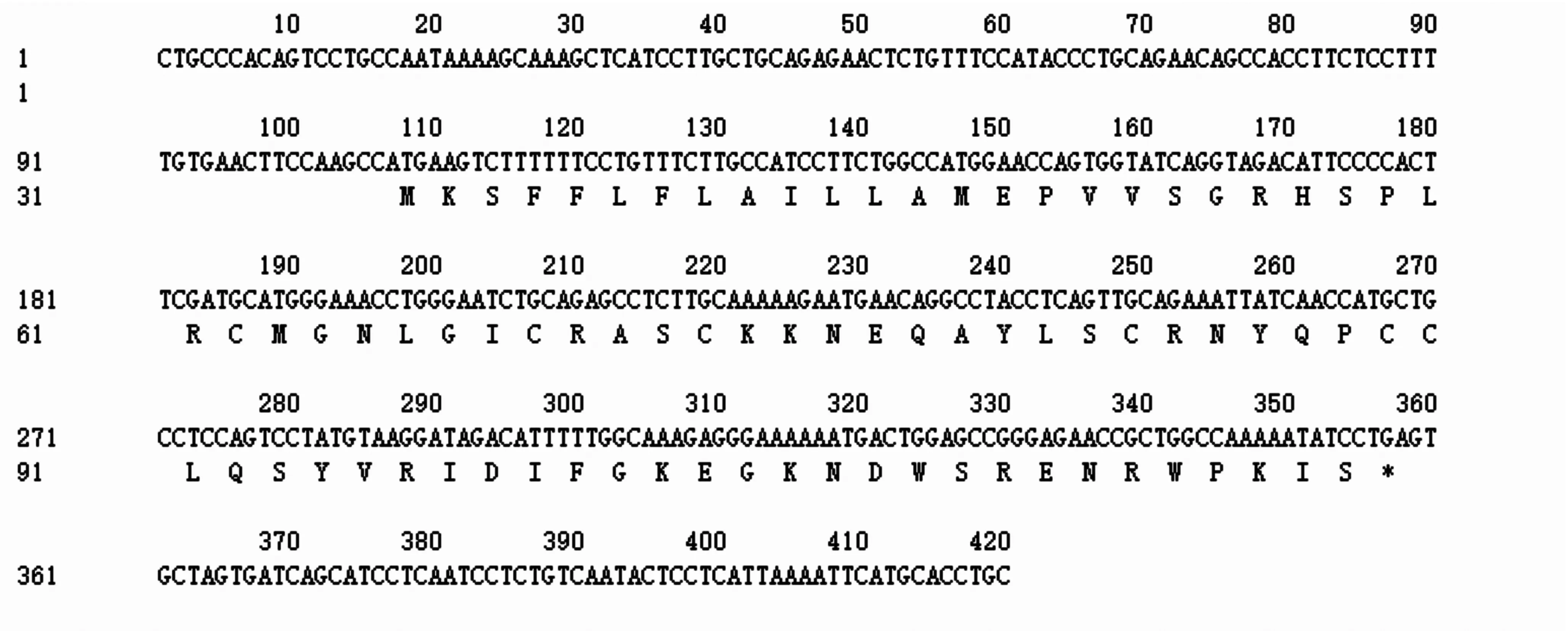
图2 PBD-119基因的全长cDNA序列及其氨基酸序列
2.2 生物信息学分析
2.2.1PBD-119基因蛋白理化性质及蛋白磷酸化分析
利用Protparam软件分析PBD-119基因蛋白理化性质,结果显示PBD-119基因编码83个氨基酸(表2)。
由表2中可知亮氨酸(Leu)和丝氨酸(Ser)含量最高(9.6%),不含苏氨酸、吡咯赖氨酸和硒半胱氨酸;该蛋白分子式为C424H670N122O115S9,分子量为9.6 ku,理论等电点(PI)为9.38,其在哺乳动物网织红细胞中的半衰期为30 h,水溶液在280 nm处的消光系数为15 845,稳定系数为59.43,脂肪系数为76.39,推测该蛋白为不稳定的碱性脂溶性蛋白;利用NetPhos 3.1 对PBD-119蛋白进行磷酸化分析发现(图3),该蛋白存在8个磷酸化位点(分值>0.5),分别为丝氨酸(Serine)6个,酪氨酸(Tyrosine)2个。
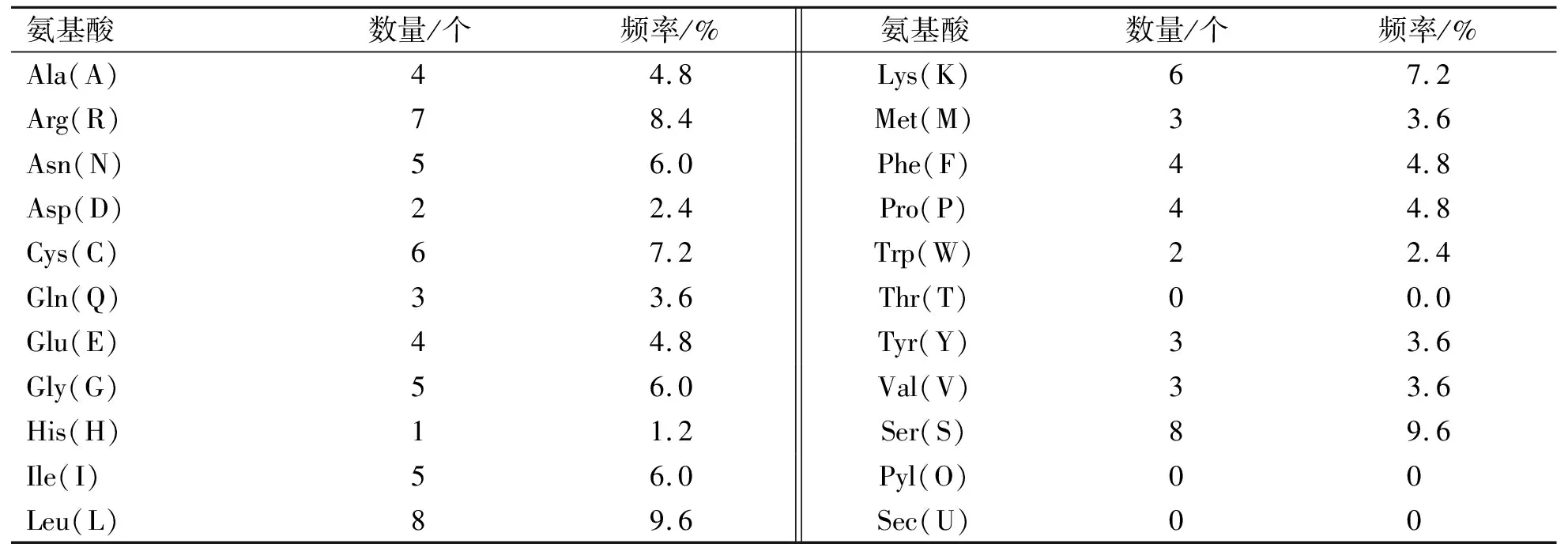
表2 PBD-119基因蛋白氨基酸组成
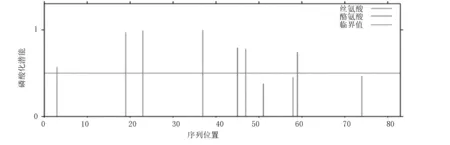
图3 PBD-119基因蛋白磷酸化位点分析
2.2.2PBD-119蛋白跨膜结构及信号肽预测
利用TMHMM在线软件预测该蛋白不存在跨膜结构;利用在线软件SignalP对蛋白信号肽进行预测(图4),结果显示C处最高值出现在第21位氨基酸上,为0.897;Y-max为0.910,也出现在第21位氨基酸上,S-max为0.960,出现在第1位氨基酸上,其值均高于阈值0.5,说明该序列存在信号肽,是分泌型蛋白。

图4 PBD-119基因蛋白信号肽预测
2.2.3PBD-119蛋白二级结构与三级结构预测
利用Protean 软件预测PBD-119蛋白二级结构,由图5可知,该蛋白二级结构包含α螺旋、β-折叠和无规则卷曲,其分别各占20.5%、10.8%和68.7%。利用 SWISS-MODEL 预测PBD-119蛋白三级结构,得到PBD-119蛋白三级预测结构图(图6),并证实二、三级结构存在高度一致性。
1表示α螺旋(HELIX:20.5%);2表示β折叠(STRAND:10.8%);其余部分表示无规卷曲(COIL:68.7%)

图6 PBD-119基因蛋白三级结构预测
2.2.4PBD-119基因核苷酸序列系统发育树构建
利用Mega7.0将克隆序列与人(NM_001271209.2)、马(XM_003363904.4)、牛(NM_001101661.3)、绵羊(XM_027976441.1)、山羊(XM_005688343.3)、小须鲸(XM_007193330.2)、美洲狮(XM_027623094.1)、倭黑猩猩(XM_003833410.3)、双峰驼(XM_006192533.2)和羊驼(XM_006202685.2)10个物种β-防御素-119基因核苷酸序列进行系统进化树的构建(图7)。由图7可知,猪与人、倭黑猩猩、马同源性较高,亲缘性较近,但与双峰驼和羊驼的亲缘关系较远,进化树所呈现的趋势符合物种进化程度。
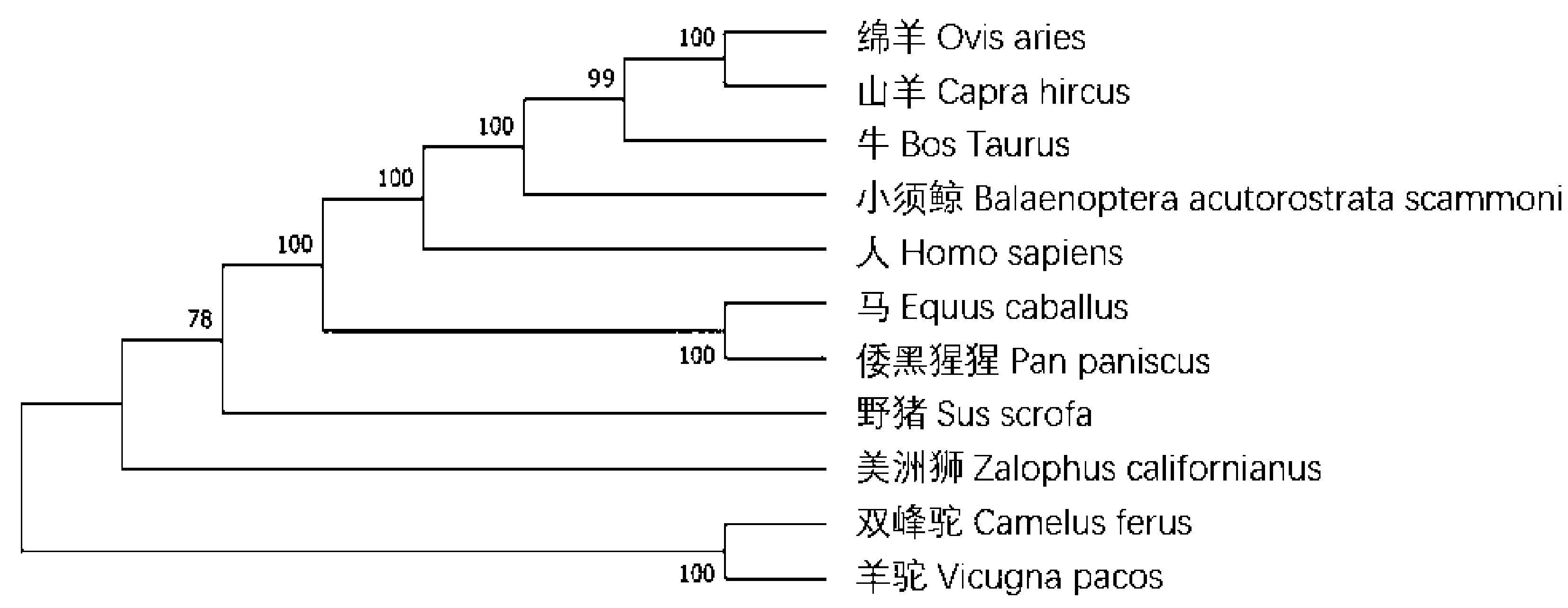
图7 不同物种PBD-119基因核苷酸序列系统发育进化树
2.3 PBD-119基因的组织表达谱的构建
由图8可知,PBD-119基因在3个品种猪肝脏中的表达量野杂猪>民猪>大白猪,且大白猪分别与民猪和野杂猪的表达量差异具有统计学意义(P<0.05),民猪与野杂猪的表达量差异则不明显,不具有统计学意义;PBD-119基因在3种猪脾脏中的表达模式则与肝脏不同,主要差别表现为大白猪表达量最高,民猪和野杂猪表达量依次减少,且野杂猪表达量与大白猪和民猪表达量差异具有高度统计学意义(P<0.001),但大白猪和民猪差异表达较小;在血液中的表达模式则与肝脏相似,表现为民猪中PBD-119基因量最高,大白猪最低,野杂猪居中,其中,大白猪分别与野杂猪和民猪差异表达具有高度统计学意义(P<0.001),但大白猪和野杂猪间不具有统计学意义。以相同品种为目标,检测不同组织间PBD-119基因差异表达(图9),结果发现大白猪与民猪、野杂猪在肝脏、脾脏和外周血中PBD-119基因表达不同,表现为脾脏中最高,肝脏居中,血液中最低,仅脾脏与血液差异表达具有统计学意义(P<0.001),民猪和野杂猪3个组织中PBD-119基因表达模式相似,均表现为肝脏和血液表达较高、脾脏最低的表达模式。
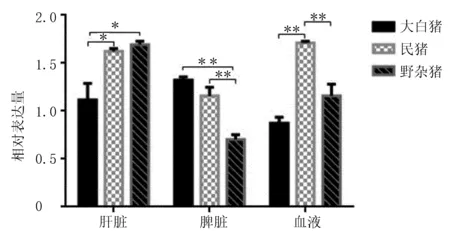
注:P<0.05为差异有统计学意义
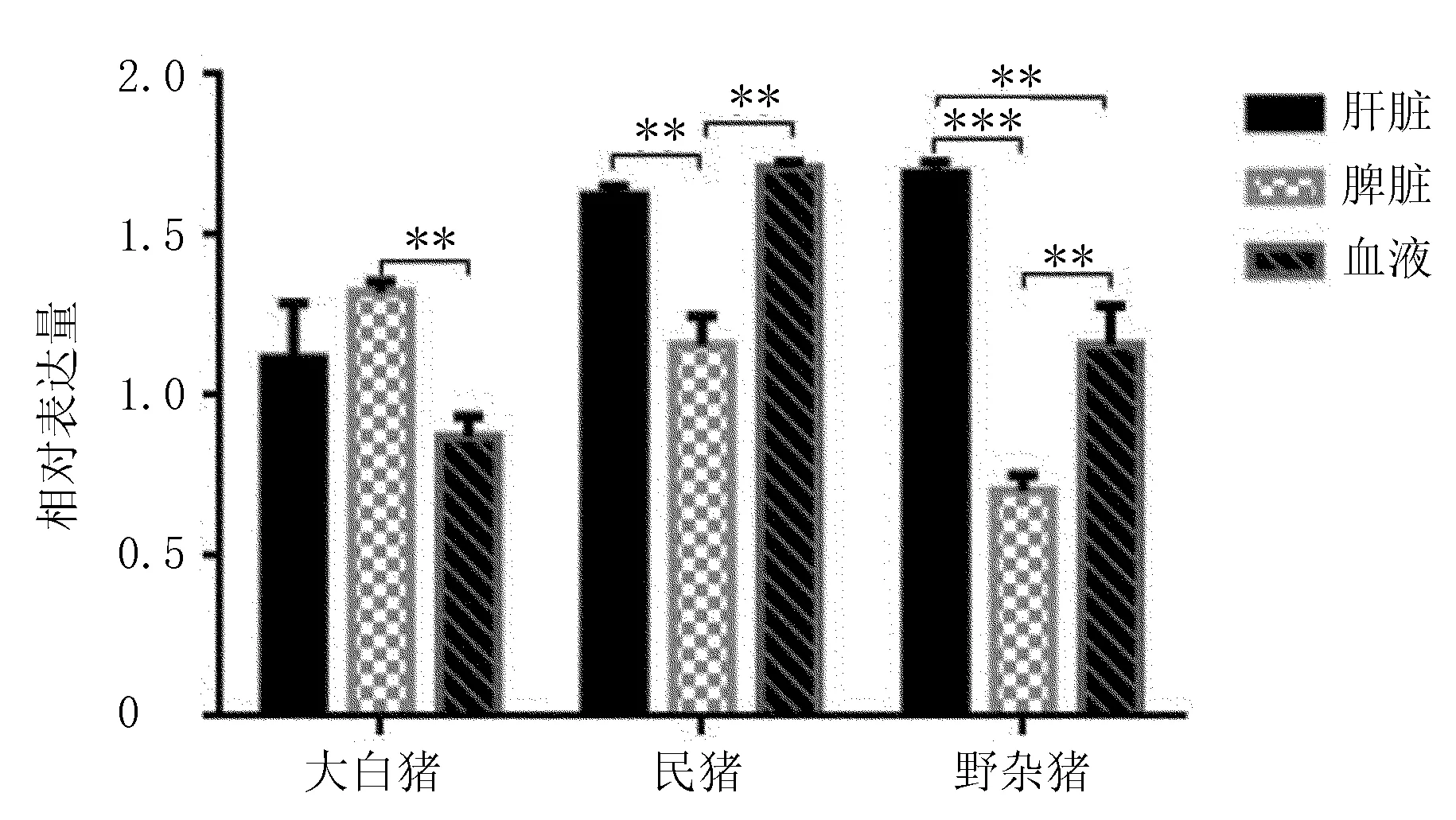
注:P<0.05为差异有统计学意义
3 讨论与结论
猪防御素是内源性抗菌肽的重要组成部分,具有分子结构稳定、抑菌谱广且不易产生耐药性的优点,是抗生素的理想替代品[9,18]。最新研究发现,猪防御素不仅能够抵抗病原菌的入侵,还与生长发育、营养吸收、肠道微生物和免疫调控有密切关系[19-21],同时,通过在妊娠母猪饲粮中添加一些乳铁蛋白(LF)能够促进PBD基因在各组织中的表达,进而提高断奶仔猪的抗病力[22-23]。由于防御素在体内分泌量非常少,所以现大都采用化学合成或者基因工程的方法来获取进行研究。然而,对于PBD-119在同一物种不同品种动物体内表达量的研究却很少有报道。
该试验成功克隆获得了大白猪、民猪、野杂猪PBD-119基因CDS区全长252 bp,编码83个氨基酸,该蛋白分子式为C424H670N122O115S9,分子量为9.6 ku,理论等电点(PI)为9.38,其在哺乳动物网织红细胞中的半衰期为30 h,水溶液在280 nm处的消光系数为15 845,稳定系数为59.43,脂肪系数为76.39,推测该蛋白为不稳定的碱性脂溶性蛋白;不存在跨膜结构,但存在磷酸化位点与信号肽,是分泌型蛋白;在二级结构与三级结构模型预测过程中,发现α螺旋和β折叠结构比例较小,说明蛋白不稳定,这与理化性质分析结果一致;通过进化分析发现,猪PBD-119基因与其他物种均能聚为一类,并且这11个物种PBD-119基因的遗传多样性较低,表明PBD-119基因在进化过程中是较为保守的且这些物种可能是由共同的祖先进化而来的[24],PBD-119蛋白组成与二、三级结构分析也证实β-防御素-119结构与功能的保守性,也由此推断PBD-119基因在不同物种中发挥的调控机制比较相似。有研究报道将PBD基因导入大肠杆菌中表达,诱导纯化的防御素在低浓度时即可对大肠杆菌和金黄色葡萄球菌表现出很强的抑制作用[25]。运用生物信息学分析发现,猪PBD-119蛋白存在8个磷酸化位点,有研究指出蛋白质磷酸化与细胞信号转导、细胞生长周期、生长发育及部分癌症发病机制密切相关,同时,蛋白质磷酸化在翻译过程中也发挥着重要作用,是一种重要的共价修饰方式[26-27]。因此,猪PBD-119蛋白可能在调控细胞信号转导及细胞周期过程中发挥一定的作用。
此外,在以往试验中,大都研究该基因在体内不同组织中的分布情况,对于不同品种动物相同组织中的表达情况鲜有报道。有研究表明血液是生命维持的最大保障,在生命的任何一个阶段都作为免疫屏障并且会随着身体状态发生变化[28],肝脏做为机体最大的免疫器官,在动物体生命过程中发挥重要作用,如解毒、代谢、免疫等[29-30],脾脏作为机体免疫器官中的重要组成部分,是集体最大的淋巴器官[31]。因此,该试验运用实时荧光定量的方法检测PBD-119基因在野杂猪、民猪和大白猪血液、肝脏和脾脏中的表达水平,结果发现,PBD-119基因在3个品种猪的各组织中均有表达,但其表达量存在差异,表明PBD-119基因具有广泛的组织表达特征,该特征进一步表明它可能有助于粘膜和全身宿主免疫防御[32]。该试验中,PBD-119基因在3个品种猪的相同组织和同一品种不同组织中表现为民猪和野杂猪的肝脏和血液中表达量均较高,大白猪的肝脏和血液中表达相对较少,而脾脏表现则相反,说明该基因可能对猪的免疫和消化功能有一定的促进作用,这与野杂猪与民猪抗病能力较强的特性相符合。有研究发现β-防御素基因在不与微生物环境直接接触的那些组织中表达,例如脑、肝、肾、心脏、肌肉和生殖器官,可能有助于抵抗机会性感染;或者,这些小肽可能在这些组织中具有超出其抗菌活性的其他功能,但确定这些β-防御素在非上皮组织中的细胞来源和功能意义还需要进一步的研究[33],这与该试验得出的结论基本一致。因此,对于PBD-119基因在各品种猪的肝脏、脾脏和血液等组织中的表达及作用还有很大潜力,有待进一步研究。
