桔梗提取液经微生物发酵后抗氧化能力研究
2020-08-06刘金熙张恩玮
曾 玲, 刘金熙, 朱 爽, 张恩玮, 金 清
(延边大学农学院,延吉 吉林 133002)
桔梗为桔梗科桔梗属植物,拉丁学名为Platycodongrandiflorum(Jacq.)A.DC.,药用其根[1],含有多种有益人体的活性成分,临床应用价值高、研发潜力大[2-3]。在民间被叫做铃铛花、包袱花、土人参等,为多年生草本植物[4]。在韩国、朝鲜被称为Doraji,在日本叫Kikyo[5]。桔梗在中国东北、日韩等东亚国家均有分布,因为其富含营养,又是一种传统的中草药,所以常被鲜用或制成咸菜,是良好的功能性食品之一[6]。用桔梗腌制成的咸菜,是我国延边朝鲜族人民的传统食品之一,其口感香辣脆爽,酸甜可口,风味独特,老少皆宜。另外,桔梗因为富含多种营养成分,也被加工制作成糕点,饮品等[7]。
目前在波兰桔梗中检测出12种酚酸类及其衍生物[8],用石油醚提取韩国桔梗的根部,分离出棕榈酸和油酸2种酚类化合物[9]。此外,有文献报道,从桔梗中分离出的总黄酮含量大于2.87%[10-11]。由于桔梗富含黄酮类、多酚类等抗氧化活性成分,使其具有抗氧化能力[12]。在微生物发酵的过程中,菌种代谢产生的某些酶类会对桔梗中的酚类、黄酮类、多糖类物质产生影响[13],使大分子葡萄糖苷类化合物转化为小分子苷元,从而提高枯梗中原有的抗氧化活性成分,增强抗氧化能力。国内学者研究发现,贝莱斯芽孢杆菌(Bacillusvelezensis)与库德里阿兹威毕赤酵母(Pichiakudriavzevii)菌株能够较好的转化姜黄素,合成六氢姜黄素与四氢姜黄素。Natio等[14]实验证明了四氢姜黄素的抗氧化能力大于六氢姜黄素大于姜黄素。Gilberto V M等[15]也发现可可豆经库德里阿兹威毕赤酵母菌株LPB06和LPB07发酵后,具有更好的色泽与更丰富的香气组成,可用于可可豆的风味调节。
因此,该菌株在通过天然发酵提高食品营养价值、改善食品风味及益生菌发酵罐的研发制备方面前景广泛[16],且2株菌株均能够在人类胃肠道环境下生存,可直接在宿主体内发挥其益生功效。目前尚未报到过该菌株对人体有致病性,故可用于微生物发酵。但在桔梗提取液经微生物发酵后抗氧化能力研究方面,该试验所用菌种研究甚少。人们都希望通过摄入高品质食品,增强体质、减少疾病,桔梗作为药食同源的植物,具有抗菌、抗过敏、抗肿瘤、抗氧化等多种保健作用[17-18],但目前这一宝贵资源尚未得到广泛利用,且桔梗经提取后其提取液中的总黄酮、总酚含量会有所降低,从而导致其对DPPH·和羟基自由基的清除能力变差,抗氧化能力不显著。因此,该试验以桔梗为原料制备桔梗提取液,往提取液中接种贝莱斯芽孢杆菌(Bacillusvelezensis)与库德里阿兹威毕赤酵母(Pichiakudriavzevii)进行微生物发酵,通过分析望进一步提高其抗氧化能力,为桔梗资源的进一步开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
贝莱斯芽孢杆菌(Bacillusvelezensis)与库德里阿兹威毕赤酵母(Pichiakudriavzevii)菌株由本实验室筛选;桔梗片(河北全泰药业有限公司提供)。
Tris-HCl 缓冲液、邻苯三酚、抗坏血酸(Vc)(北京索莱宝科技有限公司);芦丁标准品、DPPH(上海源叶生物科技有限公司);没食子酸标准品(上海麦克林生化科技有限公司);总抗氧化能力(T-AOC)试剂盒(货号:A015,南京建成生物工程研究所)。
1.2 仪器与设备
Z400K型高速冷冻离心机(德国Hermle公司);FA1104型电子分析天平(上海天平仪器有限公司);U3900型紫外-可见光分光光度计(日本日立公司);HH.S型恒温水浴锅(江苏省医疗机械厂);ZWY-100H/240型恒温培养振荡器(上海智城分析仪器制造有限公司)。
1.3 方法
1.3.1 桔梗原料的预处理
将桔梗片用粉碎机粉碎后,过40目筛制成粉末。往50 mL离心管中加入2.5 g桔梗粉末与30 mL蒸馏水,轻轻摇动混匀后放入恒温振荡器,110 r/min、50 ℃下振荡提取6 h后取出,在4 000 r/min下离心20 min,取出上清液,并往沉淀物中加入20 mL蒸馏水按上述步骤重复提取、离心,将2次上清液合并过滤后,于121 ℃下灭菌15 min,作为原始提取液。由于第2次重复制取上清液需再振荡提取6 h,故第1次上清液需先于4 ℃下保存。
按2%的接种量向原始提取液中接种贝莱斯芽孢杆菌与库德里阿兹威毕赤酵母菌株,分别编号为发酵组1、发酵组2,未发酵组加入等量无菌蒸馏水作为提取液,30 ℃下恒温培养72 h后,将发酵液与提取液在4 000 r/min下离心10 min,分别取上清液置于50 mL容量瓶中并用无菌蒸馏水定容,用于后续试验。
1.3.2 总黄酮含量的测定
精密称取5 mg芦丁标准品,用70%乙醇溶液溶解并定容在25 mL容量瓶中,分别吸取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL的芦丁标准品溶液置于试管中,不足部分用70%的乙醇溶液定容至2 mL,加入5%的NaNO2溶液0.3 mL,摇匀、静置6 min后再加入10%的Al(NO3)3溶液0.3 mL,摇匀、静置6 min,最终加4%的NaOH溶液2 mL,摇匀、静置10 min后,于510 nm波长下测定吸光度并绘制标准曲线[19]。
含量的测定及计算:将待测样品溶液用蒸馏水稀释4倍后,移取1 mL,加入70%的乙醇溶液1 mL,再按照上述步骤测定其吸光度,进行3次重复试验。由标准曲线计算得到总黄酮浓度,并由以下公式计算出样品中的总黄酮含量。
总黄酮含量/mg·mL-1=(X·V·N)/V0
(1)
式中,X-根据标准曲线计算所得的总黄酮浓度(mg/mL);V-待测样品溶液定容总体积(mL);N-稀释倍数;V0-待测样品溶液测定吸光度所用体积(mL)。
1.3.3 总酚含量的测定
精确称取5 mg没食子酸标准品,用蒸馏水溶解并定容在50 mL容量瓶中,配置成0.1 mg/mL的没食子酸标准品溶液。分别吸取0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL的没食子酸标准品溶液于10 mL容量瓶中,并加入蒸馏水定容,配成0、10、20、30、40、50、60、70 μg/mL的系列没食子酸标准品溶液。分别从上述系列标准品溶液中吸取1.0 mL于试管中,分别加入5 mL蒸馏水、1 mL福林酚试剂、3 mL Na2CO3溶液(7.5 g/100 mL),振荡显色1 h后,在760 nm波长下测定吸光度,绘制标准曲线[20-21]。
含量的测定及计算:用蒸馏水将待测样品溶液稀释5倍,取1.0 mL于试管中,再按照上述制备标准曲线步骤,在760 nm波长下测定吸光度,进行3次重复试验。由标准曲线计算得到总酚浓度,并由以下公式计算出样品中的总酚含量。
总酚含量/mg·mL-1=(X·V·N)/V0
(2)
式中,X-根据标准曲线计算得到的总酚浓度(mg/mL);V-待测样品溶液定容总体积(mL);N-稀释倍数;V0-待测样品溶液测定吸光度所用体积(mL)。
1.3.4 总抗氧化能力的测定
选用从南京建成生物工程研究所购买的T-AOC试剂盒测定其总抗氧化能力,按试剂盒说明书配置测定管和对照管。依据张馨妍等[22]和王苗苗等[23]的方法略作修改:精密量取0.1 mL待测样品溶液与显色剂充分混匀,并在37 ℃水浴下反应30 min,设置浓度为1 mg/mL Vc溶液为阳性对照,配置后混匀、静置10 min。以蒸馏水为空白对照,在520 nm下测定各管吸光度值。
总抗氧化能力/U·mL-1=[(ODU-ODC)·V·N]/(0.01×30×V0)
(3)
式中,ODU-测定管的吸光度值;ODC-对照管的吸光度值;V-测定时反应液的总体积(mL);N-样品的稀释倍数;V0-样品取样量(mL)。
1.3.5 DPPH·清除率的测定
精密称取5 mg DPPH·并用无水乙醇溶解,定容在100 mL容量瓶中,用三蒸水将待测样品溶液分别稀释0、2、4、6、8倍。取2 mL不同浓度的待测样品溶液,分别向其中加入2 mL DPPH·溶液与2 mL无水乙醇,无水乙醇、DPPH·溶液各2 mL为空白组,摇匀后在室温下避光静置30 min,进行3次平行试验,在517 nm波长下测定吸光度值[24-25]。
DPPH·清除率/%=[1-(Ai-Aj)/A0]×100%
(4)
式中,Ai-待测样品溶液+DPPH·溶液的吸光值;Aj-待测样品溶液+无水乙醇的吸光值;A0-DPPH·溶液+无水乙醇的吸光值。
1.3.6 水杨酸体系中羟基自由基清除率的测定
分别取1.3.5中不同稀释倍数的待测样品溶液0.5 mL于试管中,按顺序加入8 mmol/L的硫酸亚铁溶液0.6 mL,20 mmol/L的双氧水0.5 mL和3 mmol/L的水杨酸(无水乙醇溶解)2 mL,混匀后于37 ℃水浴锅中反应30 min,流水冷却。用无水乙醇作对照组,去离子水代替水杨酸作空白组,进行3次平行试验,在510 nm 波长下测定吸光度值[26-27]。
羟基自由基清除率/%=[1-(Ai-Aj)/A0]×100%
(5)
式中,Ai-待测样品溶液+水杨酸的吸光值;Aj-待测样品溶液+无水乙醇的吸光值;A0-空白组的吸光值(去离子水代替水杨酸)。
1.3.7 超氧阴离子清除率的测定
按顺序分别向试管中加入0.05 mol/L的Tris-HCl缓冲液(pH值8.2)2.8 mL和3 mmol/L的邻苯三酚0.1 mL,随后再分别加入按1.3.5制备的不同稀释倍数的待测样品溶液0.5 mL、抗坏血酸溶液0.5 mL(对照组)、蒸馏水0.5 mL(空白组),进行3次平行试验。反应30 s后并每隔30 s在320 nm波长下测定其每次的吸光度值,反应5 min[28]。
氧化速率=(最后一次记录值-第1次记录值)/5
(6)
清除率/%=[1-(Ai-Aj)/A0]×100%
(7)
式中,Ai-待测样品溶液吸光值;Aj-对照组吸光值;A0-空白组吸光值。
1.3.8 还原力的测定
分别取1.3.5中不同稀释倍数的待测样品溶液1 mL于试管中,向其中加入pH值6.6的磷酸缓冲液和0.3%的铁氰化钾溶液各2.5 mL,混匀后于55 ℃水浴锅中温育20 min,取出后迅速冷却,加入2.5 mL 10% 的三氯乙酸溶液,3 000 r/min下离心10 min,取上清液2.5 mL,加入2 mL蒸馏水、0.5 mL质量分数0.1%的FeCl3溶液,充分混合,静置10 min后在波长700 nm下测定吸光度值,吸光度值越大,代表还原力越强,进行3次平行试验[29]。
1.3.9 数据统计
试验所有数据以平均值±标准差(Mean±SD)表示。借助Excel、SPSS17.0相关软件进行图表的绘制和数据分析。
2 结果与分析
2.1 总黄酮、总酚含量
微生物发酵对桔梗提取液中总黄酮和总酚含量的影响如表1所示。结果显示微生物发酵显著提高了桔梗提取液中的总黄酮和总酚含量,且发酵组1中的含量最高,分别为3.927和5.871 mg/mL。

表1 发酵对桔梗提取液中总黄酮和总酚含量的影响
2.2 总抗氧化能力
微生物发酵对桔梗提取液总抗氧化能力的影响如表2所示。结果显示未发酵组与发酵组2之间没有显著性差异,且其总抗氧化能力与1 mg/mL的抗坏血酸相当,而发酵组1的总抗氧化能力均显著高于未发酵组、发酵组2与Vc对照组,可见,微生物发酵提高了桔梗提取液的总抗氧化能力。

表2 发酵对桔梗提取液总抗氧化能力的影响
2.3 DPPH·的清除能力
微生物发酵对桔梗提取液DPPH·清除能力的影响如表3所示。
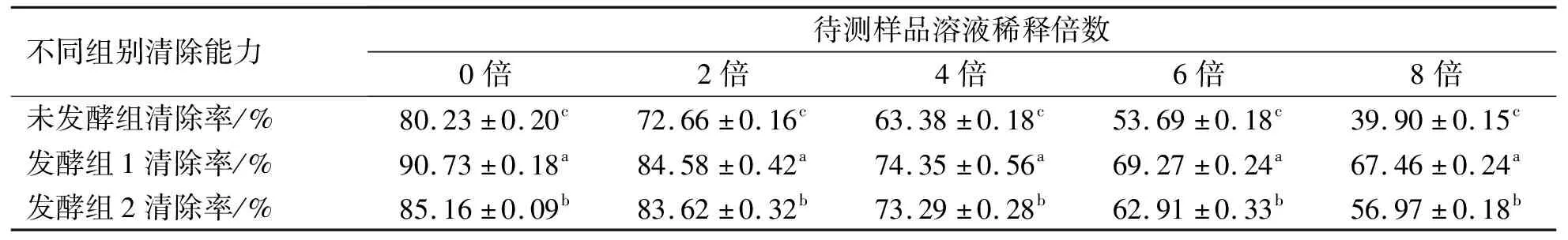
表3 发酵对桔梗提取液DPPH·清除能力的影响
由表3可知,各组DPPH·清除能力均随待测样品溶液稀释倍数的增加而降低,具有浓度依赖性。且稀释倍数相同时,各组对DPPH·清除能力的强弱依次为发酵组1>发酵组2>未发酵组,组间差异显著。
当待测样品溶液未被稀释时,各组DPPH·清除能力均达到最大。其中,发酵组1的清除率最高,为90.73%;发酵组2为85.16%;未发酵组为80.23%。可见,微生物发酵显著提高了桔梗提取液对DPPH·的清除能力。
2.4 水杨酸羟基清除能力
微生物发酵对桔梗提取液羟基清除能力的影响如表4所示。结果显示,各组羟基清除能力均随待测样品溶液稀释倍数的增加而降低。且发酵组1的羟基清除能力显著高于发酵组2与未发酵组,但发酵组2与未发酵组间差异不显著。

表4 发酵对桔梗提取液羟基清除能力的影响
稀释倍数相同时,综合比较发现各组对羟基清除能力的强弱依次为发酵组1>发酵组2>未发酵组。当待测样品溶液未被稀释时,各组羟基清除能力均达到最高。其中,发酵组1的清除率最大,为70.28%;发酵组2为61.54%;未发酵组为57.30%。可见,微生物发酵后显著提高了桔梗提取液清除羟自由基的能力。
2.5 超氧负离子清除能力
微生物发酵对桔梗提取液超氧负离子清除能力的影响如表5所示。结果显示,各组超氧负离子清除能力均随待测样品溶液稀释倍数的增加而降低。稀释倍数相同时,各组对超氧负离子的清除能力强弱依次为发酵组1>发酵组2>未发酵组,组间差异显著。
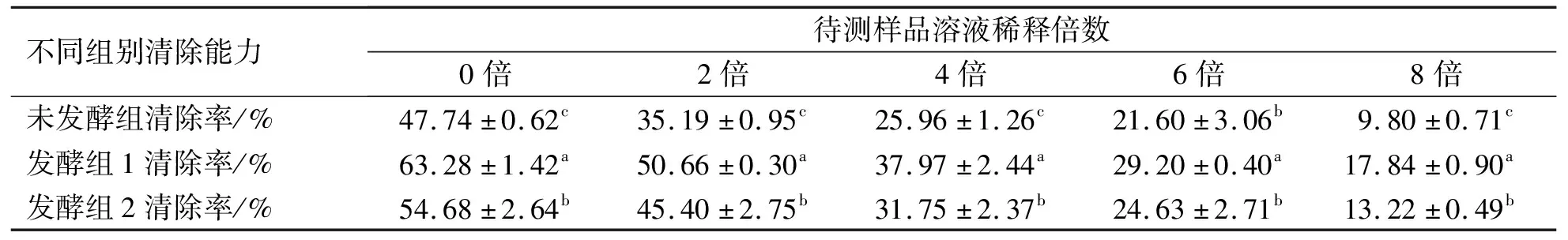
表5 发酵对桔梗提取液超氧负离子清除能力的影响
当待测样品溶液未被稀释时,各组超氧负离子清除能力均达到最大。其中,发酵组1的清除率最大,为63.28%;发酵组2为54.68;未发酵组为47.74%。可见,微生物发酵后桔梗提取液的超氧负离子清除能力也会有显著提高。
2.6 还原力
微生物发酵对桔梗提取液还原力的影响如表6所示。结果显示,各组的还原力均随待测样品溶液稀释倍数的增加而降低,且发酵组1与发酵组2均显著高于未发酵组,但发酵组1与发酵组2间差异不显著。

表6 发酵对桔梗提取液还原力的影响
稀释倍数相同时,综合比较发现各组还原力的强弱依次为发酵组1>发酵组2>未发酵组。当待测样品溶液未被稀释时,各组还原力均达到最高。可见,微生物发酵显著提高了桔梗提取液的还原力。
3 讨论
贝莱斯芽孢杆菌和库德里阿兹威毕赤酵母菌株发酵桔梗提取液后,总黄酮、总酚含量均显著提高。王行等[30]通过测定蓝莓酒发酵过程中酚类物质的动态变化,发现总酚、总黄酮含量呈先增加后减少的趋势,但仍显著高于初始含量;陈彩云等[31]向槐米中接种纳豆菌进行发酵,提高了芦丁和槲皮素含量。但该试验中不论是发酵或未发酵,各组液体中总黄酮、总酚含量均较低,查阅文献发现,购买的桔梗片粉碎过筛成粉末,加入蒸馏水震荡、提取、离心后制成的原始提取液中黄酮等含量会少于醇提、水提,黄酮更易溶于醇类试剂,故含量会较低[32]。钱骅等[33]也表明,抗氧化活性物质如酚类、黄酮类等多存在于醇提物中。
在利用微生物发酵提高体外抗氧化能力方面,杨学娟[34]向豆粕中接种纳豆芽孢杆菌进行固体发酵,证明了豆粕提取物发酵后不仅在体外具有更高的清除DPPH自由基和超氧负离子的活性、还原力及抑制脂质过氧化的能力,而且在体内也具有更高的抗氧化能力。因此,可以推断发酵后的提取液,可能是因为提高或生成了多种具有抗氧化活性的物质含量,从而使抗氧化能力得到显著提高。因此,桔梗提取液经微生物发酵后,研究其抗氧化能力显著提高的机制也是很有必要的,以期为微生物发酵机制提供理论基础。
4 结论
桔梗提取液发酵组1、2中分别接种贝莱斯芽孢杆菌和库德里阿兹威毕赤酵母菌株,并与未发酵的提取液做对比,研究桔梗提取液经微生物发酵后抗氧化能力的变化,结果如下。
1)经微生物发酵后,桔梗提取液中的总黄酮、总酚含量显著提高,未发酵组与发酵组2之间没有显著性差异,且其总抗氧化能力与1 mg/mL的抗坏血酸相当,而发酵组1的总抗氧化能力均显著高于未发酵组、发酵组2与Vc对照组。
2)通过考察DPPH·、羟基自由基、超氧负离子的清除能力及还原力来研究其体外抗氧化能力,发现各组清除自由基的能力和还原力均与样品溶液浓度呈正相关,其中,发酵组的抗氧化能力显著高于未发酵组,且发酵组1的体外抗氧化能力最强。因此,可以说明微生物发酵能显著提高桔梗提取液的体外抗氧化能力。
