2种培养方式下人参不定根生长动态观察及活性物质含量测定
2020-08-06郝悦君孙浩丁车成来廉美兰朴炫春
郝悦君, 孙浩丁, 车成来, 廉美兰, 朴炫春
(延边大学农学院,吉林 延吉 133002)
人参(PanaxginsengC.A.Meyer)是五加科人参属多年生草本药用植物,因其全貌似人形而得名,被誉为“百草之王”[1]。人参在中国、朝鲜、韩国、俄罗斯等地区均有分布,在我国主要产于吉林省长白山地区一带[2]。作为驰名中外的名贵药材,人参中富含多种活性物质,如皂苷、多糖、黄酮、维生素和矿物质等,具有抗氧化、抗疲劳、抗炎、增强免疫力、抗肿瘤等药理活性[3-5]。目前市场上人参的来源主要是采挖野生资源和人工栽培种植2种方式,但近年来由于人们的过度采挖使得野生人参数量日益减少。而由于人参栽培过程中的连作障碍未被解决,加之药材采收期较长,管理成本较高,限制了人参种植业的可持续发展[6]。
通过植物组织培养技术在短期内获得植物材料,已成为一种可替代植物资源传统生产的有效途径之一[7]。利用固体培养基培养植物组织是植物组织培养中最基础的方法,即通过添加凝固剂使配置好的营养液形成固体状态供植物生长,但这种方法却无法进行大规模生产,具有一定的局限性。而生物反应器作为一种可实现植物材料大规模生产的核心设备,具有快速高效、自动化程度高、工作体积大等优点,通过让植物表面与液体培养基充分接触,提供给植物最佳的生长环境从而可以提高植物体内活性物质含量[8]。据报道,利用生物反应器培养的高山红景天[9]、东北刺人参[10]、铁皮石斛[11]、白色紫锥菊[12]等植物中有效活性成分含量高于其他扩繁技术手段。目前,朴炫春等[13]人已建立了人参不定根生物反应器培养体系,但对培养过程中不定根形态变化方面的研究未见报道,人参不定根生长动态研究仍处于空白阶段。因此,为进一步探究不同培养模式对人参不定根生长的影响,了解培养过程中人参不定根的形态变化,该试验对不同时期生物反应器和固体培养基培养的人参不定根进行了观察,对不定根生长指标(根长、根数、根粗)进行测定,为进一步完善人参不定根培养体系提供参考依据。
1 材料与方法
1.1 材料
改良朴炫春等[14]的方法培养人参不定根。将液体培养基中收获的不定根作为试验材料。
1.2 方法
1)固体培养基培养:将人参不定根切成大小约1 cm的小段后,接种于含有固体培养基的培养皿上。培养基为3/4 MS+5 mg/L吲哚丁酸(IBA)+0.1 g/L肌醇+50 g/L蔗糖+7.5 g/L 琼脂,pH值调节至5.8,暗培养下每隔2 d在解剖镜下拍照后测定不定根根长、根粗及根数,计算相对生长速率。
2)液体培养基培养:将人参不定根切成大小约1 cm的小段后,接种于含有2 L培养基的3 L气升式反应器中。培养基为3/4 MS+5 mg/L IBA+0.1 g/L肌醇+50 g/L蔗糖,pH值调节至5.8。反应器中人参不定根的接种量为5 g/L(鲜重),通气量为300 mL/min。暗培养下每隔5 d进行取样,在解剖镜下拍照后测定不定根根长、根粗及根数,计算相对生长速率。
参照马丹丹[14]的方法计算相对生长速率,即
R =(lnQ2-lnQ1)/(t2-t1)
式中,Q1为时间t1时调查的不定根根长、根粗、根数的调查值,Q2为时间t2时不定根根长、根粗、根数的调查值。
1.3 测定方法
1.3.1 不定根中鲜重、干重的测定
收集反应器和培养皿中培养40 d的不定根,用流水清洗不定根以去除表面培养基,置于脱水机中1 min后称重,记为鲜物重。将不定根置于45 ℃的烘干箱(YHW-1103远红外鼓风干燥箱,天津市华北实验仪器有限公司,中国)干燥,烘至恒重后测其干物重。
1.3.2 不定根根长、根数和根粗的测定
对接种于固体培养基(培养皿)和液体培养基(生物反应器)中的人参不定根分别进行每2天1次和每5天1次的观察,拍照记录动态培养下不同培养模式中人参不定根的生长状态变化。利用ImageJ软件对不定根的根长、根粗、根数进行统计。
1.3.3 不定根中总黄酮含量的测定
改良Chang[15]的方法进行总黄酮含量测定。称取不定根干品粉末0.1 g于离心管中,加入10 mL 75%的乙醇溶液,60 ℃水浴加热3 h。完成加热后,过滤,弃滤渣,保留滤液。用75%乙醇溶液将滤液定容至25 mL,为样品待测液。以浓度为40 μg/mL芦丁为标准品溶液。分别吸取0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL芦丁标准液以及1 mL样品待测液加75%乙醇溶液于试管中定容至2.0 mL。向每根试管中加入5% 的NaNO2溶液0.3 mL,摇匀静置6 min后加入 10% 的Al(NO3)3溶液0.3 mL,继续进行充分摇匀6 min,最后加入 4% 的NaOH溶液2.0 mL。用紫外分光光度计(UV1102紫外分光光度计,上海天美科学仪器有限公司,中国)在510 nm下测定吸光值,绘制标准曲线,计算出样品待测溶液浓度。总黄酮含量按下述公示计算:
总黄酮含量/mg·g-1=CVD/m
式中,C为待测样品溶液浓度,V为待测样品溶液体积,D为稀释倍数,m为不定根质量。
1.3.4 不定根中总酚含量的测定
改良葛晓虹[16]的方法对总酚含量进行测定。称取不定根干品粉末0.1 g于离心管中,加入10 mL的80%甲醇溶液,80 ℃水浴加热2 h。完成加热后,过滤,弃滤渣,保留滤液。用80%甲醇溶液将滤液定容至25 mL,为样品待测液。以浓度为100 μg/mL没食子酸为标准品溶液。吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL标准品溶液和1 mL样品待测液于试管中,用80%甲醇溶液定容至2 mL,分别向试管中加入0.1 mL福林-酚试剂,摇匀之后静置6 min,加入0.5 mL 2%的Na2CO3溶液,暗处静置1 h后在760 nm 处测定吸光值,绘制标准曲线,计算出样品待测溶液浓度。总酚含量按下列公式计算:
总酚含量/mg·g-1=CVD/m
式中,C为待测样品溶液浓度,V为待测样品溶液体积,D为稀释倍数,m为不定根质量。
1.3.5 不定根中总皂苷含量的测定
参照陈蕾等[17]的方法测定人参不定根中总皂苷含量。称取1 g人参不定根干品粉末,加入25 mL 80%甲醇溶液,80 ℃恒温水浴2 h,重复2次,离心后取上清,合并2次上清液,80%甲醇溶液定容至100 mL后减压浓缩至5 mL膏状物,再使用蒸馏水定容至50 mL,加入25 mL乙醚萃取2次,弃上层,下层加入20 mL水饱和正丁醇溶液继续萃取保留上层,下层继续萃取,萃取3次,将3次上层液体合并后减压浓缩,加入甲醇溶液定容至10 mL,即为样品待测液。吸取样品待测液10 μL,加入0.5 mL 8%香草醛溶液,摇匀后,加入72%硫酸溶液5 mL,60 ℃水浴加热10 min后,冰水浴10 min冷却,将试管振荡混匀,利用分光光度计在544 nm处测定吸光值。以人参皂苷Re为标准品,取1 mg标准品,用1 mL色谱甲醇溶解后,按上述操作,测量OD值,总皂苷含量按下式计算:
总皂苷含量/mg·g-1=(R1×C/R2)×D
式中:R1为样品的吸光值,C为标准品的浓度,R2为标准品的吸光值,D为样品稀释倍数。
1.4 数据分析
所有试验处理均采用3次重复,通过Image J软件来对根长根粗以及根数进行测量,试验数据利用SPSS 22.0软件进行分析。
2 结果与分析
2.1 人参不定根的生长动态观察结果
2.1.1 人参不定根诱导及生长的形态变化
人参不定根在固体培养基生长的动态变化如图1所示。人参不定根在培养初期变化并不明显,培养至第10天时,不定根慢慢开始膨大,第16天时,不定根分化出侧根,并随着培养时间的延长,分化的侧根数越来越多,长度越来越长。但培养30 d后发现,由于侧根的长度和数量不断增多,难以清晰地捕捉单个不定根图像,故该试验中仅对固体培养基培养30 d之内的形态图像进行捕捉。

图1 人参不定根在固体培养基中生长动态
由图2可知,液体培养基中的人参不定根生长状况良好。培养初期不定根形态无明显变化,培养至第10天时,不定根开始膨大,第15 天后开始分化出小侧根,并随着培养时间的不断增加,侧根数和长度也不断增加。

图2 人参不定根在液体培养基中生长动态
2.1.2 不定根根长、根粗及根数随培养时间的变化
人参不定根根长、根粗以及根数随培养时间的变化趋势见图3。在固体培养基中,人参不定根分生出的侧根根长、根粗及根数随着培养时间的增加呈现上升趋势(图3A~C),培养至40 d时,不定根根长为10.14 mm,根粗为0.74 mm,根数为52个。而在液体培养基中,随着培养时间的增加,人参不定根的根长呈现上升的趋势,根粗和根数呈现出先上升后趋于稳定的趋势(图3D~F),在20~25 d时,不定根根长和根数急剧上升,但培养至35 d后,根粗和根数无明显变化。培养至40 d时,不定根根长为12.45 mm,根粗为0.72 mm,根数为25个。
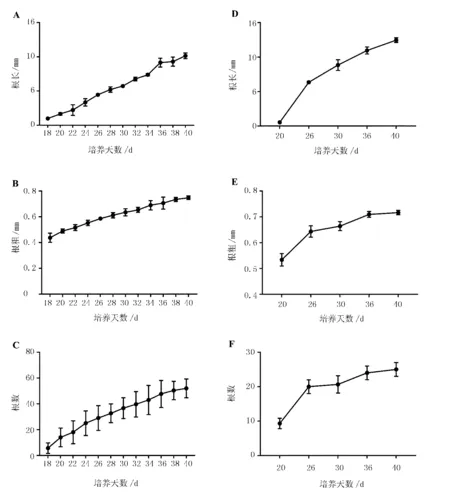
注:A、B、C分别是固体培养基中根长、根粗和根数的变化;D、E、F分别是液体培养基中根长、根粗和根数的变化
2.1.3 不同培养时间不定根相对生长速率的变化
调查人参不定根的相对生长速率时发现,在固体培养基培养初期(0~18 d)和液体培养基培养初期(0~20 d)时,人参不定根并未分生出侧根。因此,该研究仅对固体培养基培养18 d后和液体培养基培养20 d后的人参不定根各项目的相对生长速率进行了统计。结果表明:固体培养基中人参不定根分生出的根长、根粗以及在培养的第18~24天时,生长速率最快,之后各项目的生长速率均有所降低(表1),这可能是由于后期培养基中的养分消耗过多导致的。而在液体培养基中,人参不定根的根长、根粗以及根数在第20~25天达到最大值,生长较为活跃,并且根长的生长速率是固体培养基中不定根根长生长速率的2.44倍(表2)。
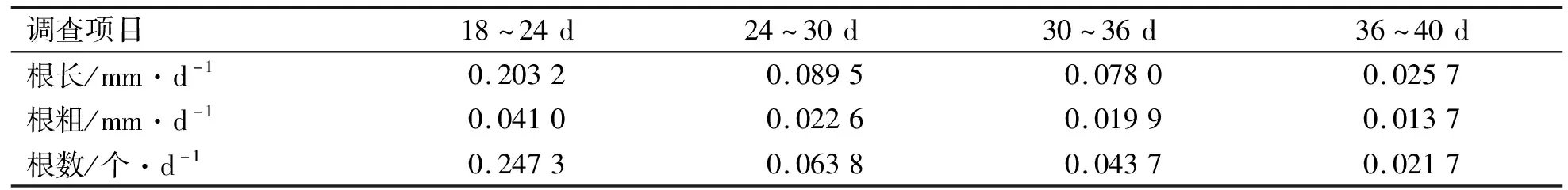
表1 人参不定根在固体培养基中培养时的相对生长速率

表2 人参不定根在液体培养基中培养时的相对生长速率
2.1.4 人参不定根中生物量及有效成分的测定
对于培养40 d后的固体培养基和液体培养基中人参不定根的生物量和有效成分进行测定(表3),以单位体积培养基(L)培养获得的人参不定根的鲜重和干重为生物量评价指标。结果表明:在固体培养基中人参不定根的鲜重和干重仅为10.38和1.37 g/L,而液体培养基培养的人参不定根的鲜重为91.86 g/L,干重为10.73 g/L,优于固体培养模式。2种培养模式下培养的人参不定根有效物质含量无明显差异,在液体培养基培养的人参不定根中总黄酮含量为1.31 mg/g,总酚含量为3.92 mg/g,总皂苷含量为5.82 mg/g。

表3 固体和液体培养基中人参不定根中生物量及有效成分含量的比较
3 讨论与结论
人参喜阴凉,多生长于林地,对栽培环境的要求十分严格,但传统的“伐林栽参”种植模式已不符合目前我国的林地保护政策,使得人参资源的大规模开发受到了限制[18-19]。与传统药用植物栽植方式相比,药用植物组织培养技术为药用植物的开发与利用提供了更大的空间,它不受时间和地理位置的拘束,可在短期内获得所需植物材料[20]。但在植物组织培养的过程中,相同的培养基配方,不同状态的培养条件,对植物生长状态也会造成一定的影响。彭菲等[21]研究发现,黄花石蒜不定根在液体培养下的生根数量和根的增殖倍数均高于固体培养。施和平等[22]发现,与固体培养的毛状根相比,在液体培养基中培养的毛状根生长更加迅速,且三裂叶野葛毛状根中的细胞内活性氧含量、生物量以及可溶性总糖含量都显著高于固体培养的毛状根。这均与该试验的研究结果一致。该试验研究表明:不同培养模式下人参不定根的根长、根粗及根数均随着培养时间增加而增加,但不同模式下的根长、根粗、根数的生长速率有所不同。与固体培养模式相比,液体培养模式更有利于人参不定根生物量的积累,这可能是由于在液体培养模式中人参不定根能够和培养基溶液充分接触,更好地吸收养分,促进不定根的生长。该试验利用生物反应器培养40 d后的人参不定根鲜物重达到91.86 g/L,干物重为10.73 g/L,且不定根中总黄酮含量为1.31 mg/g,总酚含量为3.92 mg/g,总皂苷含量为5.82 mg/g,此结果可为今后更加深入研究人参不定根的生长发育规律和其扩大化生产提供理论依据。
